
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
В комплексных соединениях металлов подгруппы марганца
|
Степень окисления |
Координа- ционное число |
Конфигурация связей центр. атома |
Примеры соединений |
|
-1 |
6 |
октаэдр |
[Mn(CO)5H] |
|
0 |
6 |
октаэдр |
[Mn(CO)5]2 |
|
+2 |
4 |
тетраэдр |
[MnCl4]2- |
|
+2 |
6 |
октаэдр |
[Mn(H2O)6]2+,[MnF6]4- |
|
+4 |
6 |
октаэдр |
[MnCl6]2- |
|
+6 |
4 |
тетраэдр |
[MnO4]2- |
4.4. Подгруппа хрома
В подгруппу хрома входят:
Cr(3d4s1), Mo(4d55s1), W(4f145s25p65d46s2), U(5f36s26p66d17s2).
Для хрома наиболее характерна степень окисления +3, в меньшей степени +6. Для молибдена и вольфрама, как и для других 4d- и 5d- элементов, наиболее характерна высшая степень окисления +6. Для урана тоже характерна степень окисления +6 и его химия сходна во многом с химией Cr, Mo, W. Наиболее типичными координационными числами для этих элементов являются 6 и 4.
Для хрома в степени окисления +2 характерно координационное число 6. Соединения Cr(II) неустойчивы в окислительно-восстановительном отношении и проявляют большую стабильность в кислотно-основных реакциях. Так, Cr(OH)2, который проявляет практически основные свойства и взаимодействует только с кислотами: Cr(OH)2 + 2H3O+ + 2H2O = [Cr(H2O)6]2+ .
Образующийся при этом аквакомплекс имеет синий цвет. Дигалогениды хрома(II) легко с газообразным аммиаком образуют аммиакаты, например, [Cr(NH3)6]Cl2._
Будучи сильными восстановителями, соединения хрома (II) легко переходят в соединения хрома(III).
[Cr(H2O)6]3+ + ē = [Cr(H2O)6]2+ φo = - 0.408 B
Хром(III) является одним из наиболее сильных комплексообразователей. Малые размеры и высокий эффективный заряд иона Cr3+ обеспечивает большую электростатическую составляющую связи хром-лиганд, а электронная конфигурация в октаэдрическом поле t2g3eg0 способствует образованию прочных внутриорбитальных комплексов с гибридизованными d2sp3- орбиталями. Хром(III) способен образовывать комплексные соединения практически со всеми известными лигандами, прочность которых изменяется в широких пределах в зависимости от свойств лигандов.
Гидроксид хрома (III) хорошо растворяется в кислотах и щелочах, образуя катионные [Cr(H2O)6]3+ и анионные комплексы [Cr(OH)6]3- :
Cr(OH)3 + 3H3O+ = [Cr(H2O)6]3+ , Cr(OH)3 + 3OH- = [Cr(OH)6]3-.
Аквакомплекс [Cr(H2O)6]3+ сине-фиолетового цвета входит в состав некоторых кристаллогидратов, например Cr(NO3)3·9H2O, Cr2(SO4)3 ·18H2O, кристаллических квасцов KCr(SO4)2 ·12H2O .
Соли хрома(III) так же, как и соли Al(III) (близкие размеры ионов 0,615 и 0,57Ао соответственно и одинаковая плотность положительного заряда) сильно гидролизуются. Результатом поляризационного воздействия маленького по размеру, высокозаряженного катиона Cr3+ на молекулы воды, входящие в координационную сферу хрома, является то, что вода становится довольно сильной кислотой (сильнее уксусной). Вследствие этого водные растворы солей хрома(III), образованных сильными минеральными кислотами, являются кислыми (рН~3).Таким образом, в качестве первой стадии гидролиза солей Cr(III) можно рассматривать образование гидроксоаквакомплексов:
[Cr(H2O)6]3+ + H2O = [Cr(OH)( H2O)5]2+ + H3O+ .
Для соединений хрома(III) характерно явление гидратной изомерии, что свидетельствует о значительной кинетической инертности химических связей в координационной сфере хрома(Ш). Если бы эти связи были лабильными, то распределение ионов Cl- и H2O между внутренней и внешней координационной сферой в CrCl3·6H2O было бы таким, что всегда получался бы один и тот же продукт. Однако в зависимости от условий (температура, концентрация, рН) состав катионных аквакомплесов изменяется, что сопровождается изменением их окраски от сине-фиолетовой до зелёной. Например:
[Cr(OH2)6]Cl3 [Cr(OH2)5Cl]Cl2 ·H2O [Cr(OH2))4Cl2]Cl· 2H2O
сине-фиолетовый светло-зелёный тёмно-зелёный
Кроме аквакомплексов для Cr(III) известны катионные амминокомплексы [Cr(NH3)6]3+ малинового цвета. Аммиакаты устойчивы в твёрдом состоянии, в воде они постепенно разрушаются:
[Cr(NH3)6]Cl3 + 3H2O = Cr(OH)3↓ + 3NH4Cl + 3NH3 .
Анионный комплекс- гексагидроксохромат(III) ионы [Cr(OH)6)]3- окрашены в изумрудно-зелёный цвет. Устойчивы только в твёрдом состоянии или при большом избытке щёлочи в растворе.
Кроме гидроксоаквакомплексов образуются также комплексы, где лигандами являются анионы растворённой соли, например:
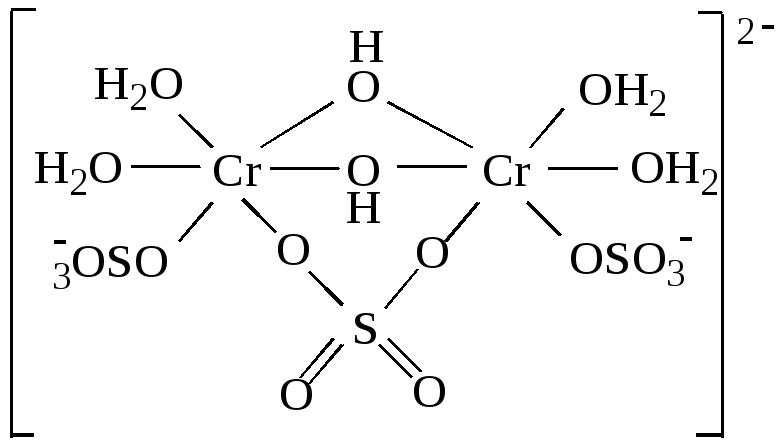
При изменении степени окисления хрома от +2 и +3 до +6 химическая связь переходит от преимущественно ионной к преимущественно ковалентной. В щелочной среде ион [Cr(OH)6]3- окисляется до хромат-иона [CrO4]2- :
[Cr(OH)6]3- + 2OH- = [CrO4]2- + 4H2O + 3ē .
Под воздействием щелочной среды происходит депротонизация ионов ОН-, входящих в координационную сферу хрома. При этом происходит уменьшение координационного числа хрома от 6 до 4 в результате сокращения расстояния Cr-O по сравнению с хромит-ионом [Cr(OH)6]3- или акваионом [Cr(H2O)6]3+ вследствие возникновения ковалентной связи Cr-O в [CrO4]2-. Кроме того, геометрия хромат-ионов является симметричной тетраэдрической, повышающей устойчивость шестивалентного состояния, так как хромат-ионы не содержат ослабленных (мостиковых) связей Cr-O-Cr.
В кислой среде хромат-ионы протонируются, что приводит к искажению симметричной структуры оксоаниона, затем происходит димеризация:
CrO42- + H3O+ = HCrO4- + H2O
2HCrO4- = Cr2O72- + H2O .
Образовавшийся дихромат-ион имеет неравноценные связи. Связь хрома с мостиковым атомом кислорода является более длинной (и, соответственно, менее прочной), чем связь с концевыми атомами кислорода (рис. 34):
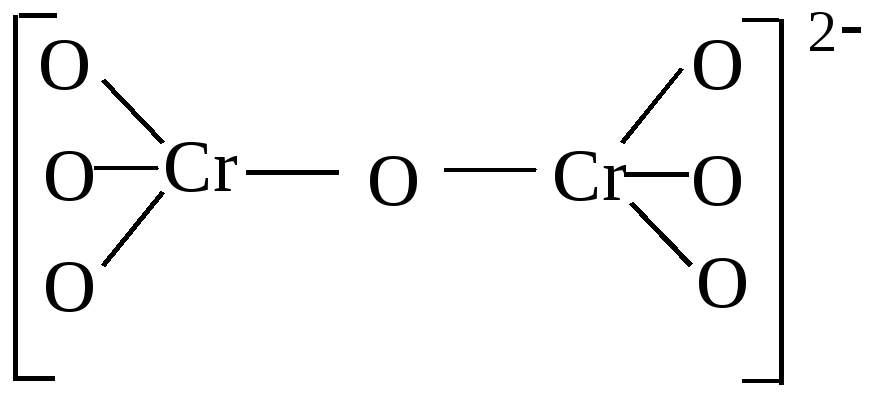
Рис. 34. Дихромат ион.
В щелочной среде, смещаюшей кислотно-щелочное равновесие, в дихромат-ионе происходит разрыв мостиковой кислородной связи Cr-O и образуется два хромат-иона:

Электронная оболочка хрома и размеры его атома допускают различные варианты распределения электронной плотности в его соединениях. В карбониле хрома [Cr(CO)6] хром формально имеет нулевую степень окисления. Однако рентгеноэлектронная спектроскопия регистрирует на атоме хрома в этом соединении положительный заряд, который даже выше, чем у хрома в [Cr(H2O)6]3+. Таким образом, вследствие π– дативного взаимодействия(переноса электронной плотности с хрома на окись углерода) в карбониле хрома реализуется одновременно ионное и ковалентное взаимодействие. В формально нулевой степени окисления хром находится в соединении дибензолхром [Cr(C6H6)2].
Дибензолхром имеет строение сэндвича подобно ферроцену. Все расстояния Cr-C в нём одинаковы. Из pz– орбиталей атомов углерода каждого бензольного кольца образуются 3 связывающих и 3 разрыхляющих молекулярных орбиталей, имеющих π-симметрию. Связь хром-лиганд осуществляется за счёт перекрывания заполненных электронами молекулярных орбиталей бензола с незаполненными атомными орбиталями хрома и одновременно заполненные электронами атомные орбитали хрома взаимодействуют с незаполненными орбиталями бензола. Дибензолхром летуч и способен разлагаться при незначительном нагревании на металл и бензол. Образующиеся при этом хромовые покрытия обладают высокими техническими качествами.
Молибден и вольфрам не являются типичными комплексообразователями. Их комплексы в высших степенях окисления термодинамически нестабильны из-за конкурирующих реакций образования кислородных соединений, а в низких степенях окисления – процессов окисления. В комплексных соединениях Mo(VI) и W(VI) находятся в виде оксогруппы. В качестве примера можно привести следующие соединения:
[MoO4]2-, [WO4]2-, [MoO2Cl4]2- , [WO3F3]3-.
Оксогруппы часто бывают объединены в димер оксомостиком:
K2[(MoO2-MoO2)(C2O4)2(H2O)2].
Связь молибдена(VI) и вольфрама(VI) c кислородом настолько прочная, что не может быть разрушена даже самыми мощными лигандами. В щелочных растворах присутствуют молибдаты [MoO4]2- и вольфраматы [WO4]2- (аналогично [CrO4]2-). В кислой среде образуются слабые кислоты H2MoO4 и H2WO4 в отличие от сильной H2CrO4. В зависимости от рН происходит очень сложный процесс полимеризации, протекающий через стадию образования водородных, гидроксильных и оксомостиков. Этот процесс характерен не только для молибденовой и вольфрамовой кислот, но и для их солей - молибдатов и вольфраматов. Таким образом, процесс полимеризации, приводящий к образованию изополисоединений и гетерополисединений, препятствует образованию «нормальных» комплексных соединений.
Существует небольшое число комплексов Mo и W в низких степенях окисления. Стабилизация низких степеней окисления молибдена и вольфрама достигается, если лиганды обладают
-акцепторными свойствами, например CO, CN-, NO+ и др. Так, для Mo(I) получен комплекс K4[Mo(CN)5(NO)]. Из гексакарбонилов Mo(CO)6 W(CO)6 синтезируют комплексы Mo(II) и W(II), например (-C5H5)W(CO)3Cl. Другой способ стабилизации низших степеней окисления – получение соединений кластерного типа со связями Mo-Mo или W-W, как, например, в комплексном диамагнитном ионе [W2Cl9]3-(рис.35), где вольфрам проявляет степень окисления +3. Интересно отметить, что в этом соединении между атомами W осуществляется тройная связь (одна и две ).
Рис. 35. Структура иона [W2Cl9]3-.
Таблица 13. Основные координационные полиэдры в
