
- •Химическая связь. Типы взаимодействия молекул
- •Ковалентная связь
- •Метод валентных связей Основные положения мвс
- •Механизмы образования химической связи
- •Донорно-акцепторный механизм
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Ионная связь Ионные молекулы существуют только в парах над нагретыми солями. Энергия разрыва ионной связи не определяется энергией притяжения ионов.
- •Потенциальная энергия для однозарядных ионов:
- •Поляризующее действие ионов тем больше, чем меньше радиус и чем устойчивее электронная оболочка иона. Наибольшее поляризующее действие оказывают те ионы, которые слабо поляризуются.
- •Понять механизм восприятия цвета нашими глазами может помочь "круг цветов",
- •Энергия связи
- •1649 КДж/моль. В молекуле метана имеются четыре равноценные связи с-н поэтому средняя энергия такой связи равна
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
Химическая связь. Типы взаимодействия молекул
Химическая связь – это совокупность сил между атомами, образующая устойчивые системы: молекулы, ионы, радикалы.
Ни одно из известных взаимодействий – электрическое, магнитное или гравитационное – в применении к микрообъектам не обладает свойством насыщаемости, т.е. не зависит от числа взаимодействующих тел, с другой стороны, насыщаемость валентных сил – хорошо известный факт.
Квантовая механика дала решение вопроса о природе химической связи.
Основные типы химической связи: ковалентная, ионная, водородная и металлическая. Нет единой теории описывающей все молекулы. Отнесение химической связи к одному из этих типов – не является простой задачей. В большинстве соединений имеет место наложение разных типов связи.
Мельчайшей частицей вещества является молекула, образующаяся в результате взаимодействия атомов, между которыми действуют химические связи или химическая связь. Учение о химической связи составляет основу теоретической химии. Химическая связь возникает при взаимодействии двух (иногда более) атомов. Образование связи происходит с выделением энергии.
Причина образования химической связи – понижение полной энергии системы.
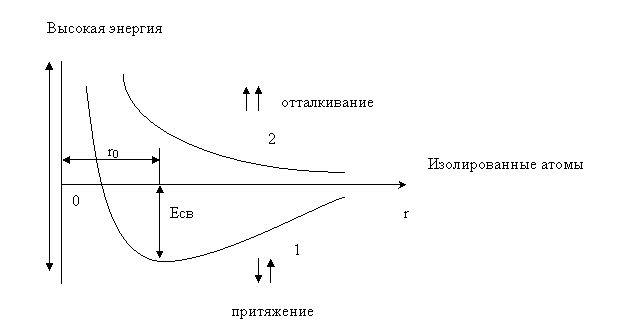
Рис.1 Зависимость потенциальной энергии Е системы из двух атомов водорода от межъядерного расстояния r: 1 - при образовании химической связи; 2 – без ее образования.
На данном рисунке показана энергетическая кривая, характерная для взаимодействующих атомов водорода. Сближение атомов сопровождается выделением энергии, которое будет тем больше, чем больше перекроются электронные облака. Однако в обычных условиях, вследствие кулоновского отталкивания, невозможно достичь слияния ядер двух атомов. Значит, на каком-то расстоянии вместо притяжения атомов, будет происходить их отталкивание. Таким образом, расстояние между атомами r0, которому отвечает минимум на энергетической кривой, будет соответствовать длине химической связи (кривая 1). Если же спины электронов у взаимодействующих атомов водорода одинаковы, то будет происходить их отталкивание (кривая 2). Энергия связи для различных атомов изменяется в пределах 170–420 кДж/моль (40–100 ккал/моль).
Процесс перехода электрона на более высокий энергетический подуровень или уровень (т.е. процесс возбуждения или распаривания) требует затраты энергии. При образовании химической связи происходит выделение энергии. Для того, чтобы химическая связь была устойчивой, необходимо, чтобы увеличение энергии атома за счет возбуждения было меньше энергии образующейся химической связи. Иными словами, необходимо, чтобы затраты энергии на возбуждение атомов были скомпенсированы выделением энергии за счет образования связи.
Ковалентная связь
Для молекулярных систем, как и для многоэлектронных атомов, невозможно точное решение уравнения Шрёдингера. Приближённые решения достигаются введением упрощающих предположений о том, что при образовании молекулы происходят лишь ограниченные изменения.
Существует два способа объяснения характера ковалентной связи- метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
