- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Вид используемого электромагнитного излучения
- •Глава 20
- •20.1. Основной закон поглощения электромагнитного излучения
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.3.1. Процессы, приводящие к появлению аналитического сигнала
- •20.3.2. Измерение аналитического сигнала
- •20.3.3. Практическое применение
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •20.4.1. Молекулярные спектры поглощения в уф- и видимой области
- •20.4.2. Измерение аналитического сигнала
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Фотометрические реакции
- •Дифференциальная (разностная) фотометрия
- •Производная спектрофотометрия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •Природа вещества
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Глава 22
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •22.3. Хроматографические параметры
- •Хроматографические характеристики, используемые для идентификации веществ (характеристики удерживания)
- •Хроматографические характеристики, используемые для количественного определения веществ
- •22.4. Теории хроматографического разделения
- •Глава 23
- •23.1. Общая характеристика
- •23.2. Устройство газового хроматографа
- •Хроматографическая колонка
- •Детекторы
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Неподвижные и подвижные фазы
- •24.4.2. Эксклюзионная хроматография
- •Глава 25
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •В табл. 25.1 приведена классификация основных электрохимических методов анализа в зависимости от измеряемого параметра.
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.2. Условия измерения аналитического сигнала
- •26.1.3. Индикаторные электроды
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •1) Рабочий электрод;
- •2) Электрод сравнения;
- •3) Вспомогательный электрод
- •26.2.3. Кулонометрическое титрование
- •Глава 27
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •27.3. Некоторые современные разновидности вольтамперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
25.3.5. Понятие о высокочастотной кондуктометрии
В высокочастотной кондуктометрии (осциллометрии), применяемой, главным образом, в виде высокочастотного титрования, используется электрический ток высокой частоты (мегагерцы). Электроды в ячейках для высокочастотного титрования не соприкасаются с анализируемым раствором. Существует два типа таких ячеек: емкостная и индуктивная. При использовании емкостных ячеек измеряют изменение частоты генератора в процессе титрования. Индуктивная ячейка помещается внутрь электромагнитной катушки. При титровании происходит изменение величины индуктивности.
К преимуществам высокочастотной кондуктометрии относится возможность анализа растворов как с очень малой, так и с очень большой электропроводностью. Электроды находятся вне раствора, поэтому не происходит их поляризации. Метод высокочастотного титрования может быть использован для анализа агрессивных сред, растворов, находящихся в замкнутых сосудах и т.д. Основной недостаток - более высокая стоимость оборудования.
Глава 26
26.1. Потенциометрический метод анализа
Потенциометрическими называют методы анализа, основанные на измерении зависимости равновесного электродного потенциала от активности определяемого иона.
26.1.1. Общая характеристика и классификация
При потенциометрических измерениях используется электрохимическая ячейка, работающая в режиме гальванического элемента. В состав ячейки входит индикаторный электрод, потенциал которого зависит от активности определяемого иона или от активности хотя бы одного из компонентов протекающей химической реакции, и электрод сравнения (чаще всего хлоридсеребряный), величина потенциала которого постоянна. Величина потенциала индикаторного электрода связана с активностью определяемого иона уравнением Нернста (см. главу 7).
![]()
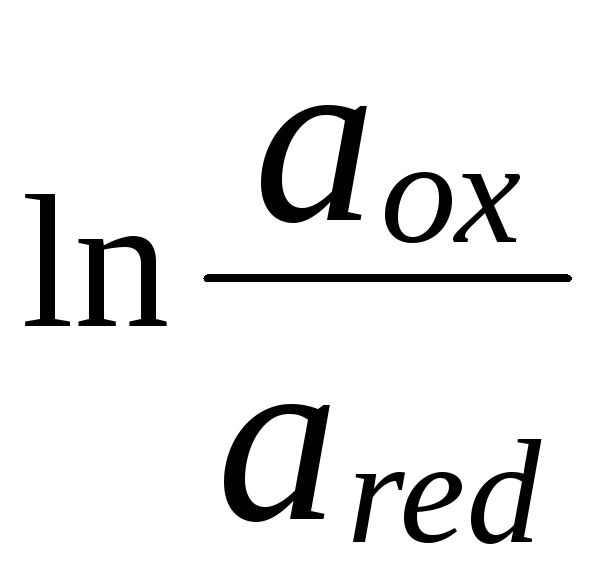
![]()
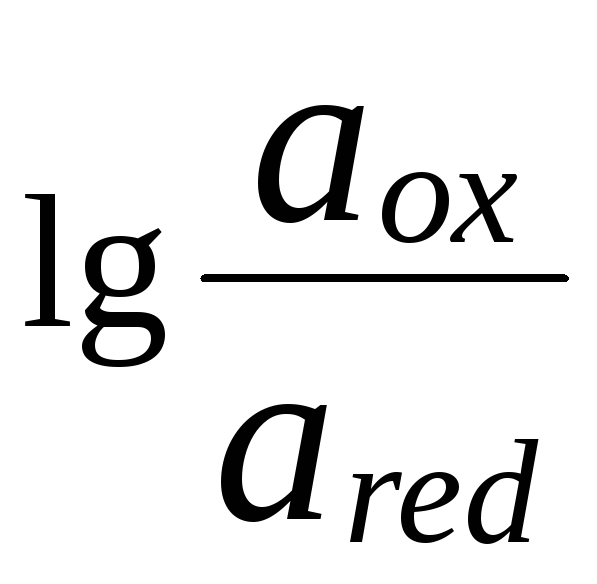 (при 298 К)
(при 298 К)
![]()
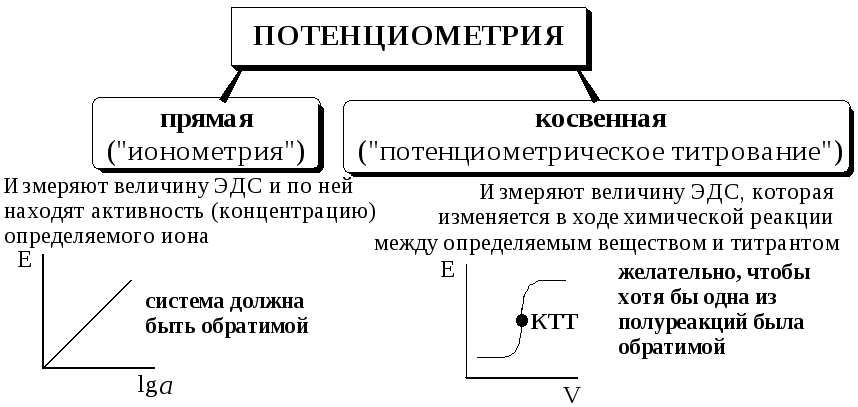
26.1.2. Условия измерения аналитического сигнала
Измерение ЭДС гальванического элемента проводят в условиях, которые близки к термодинамическим:
-
сила тока, протекающего через ячейку, должна быть равна 0;
-
время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия.
При
измерении ЭДС в таких условиях можно
считать, что величина соотношения
![]() у поверхности электрода равна величине
этого соотношения в растворе
у поверхности электрода равна величине
этого соотношения в растворе
Приборы, позволяющие определять величину рХ (отрицательного логарифма активности иона Х в растворе), в комплекте с соответствующими ионоселективными электродами, называются иономерами. Если прибор предназначен для измерения активности только катионов водорода, то его называют рН-метром.
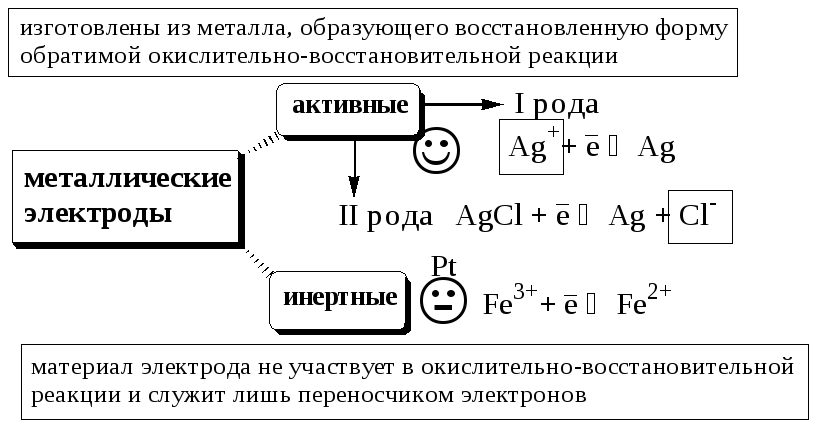
26.1.3. Индикаторные электроды

Металлические электроды могут быть
Ионоселективные электроды (согласно IUPAC) – это сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от lg активности определяемого иона в растворе.
В состав большинства ионоселективных электродов входит полупроницаемая мембрана, представляющая собой тонкую плёнку, отделяющую внутренний раствор (стандартный) от внешнего (анализируемого) и способную пропускать преимущественно ионы только одного вида (рис. 26.1)
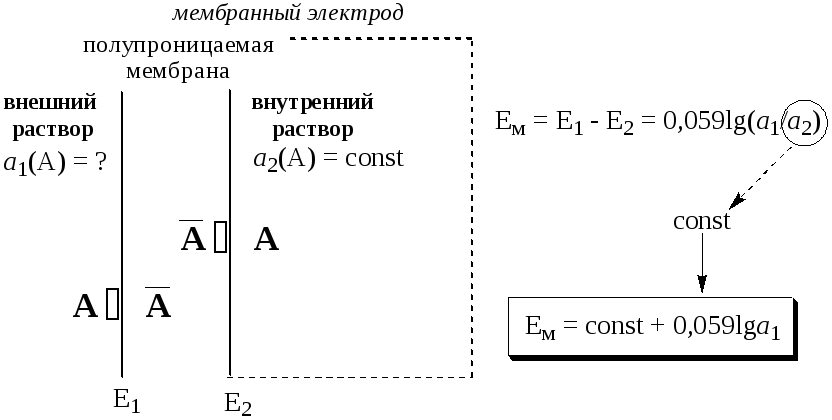
Рис. 26.1. Принцип работы мембранного электрода
К основным характеристикам ионоселективного электрода относят

Согласно рекомендациям IUPAC различают следующие виды ионоселективных электродов:
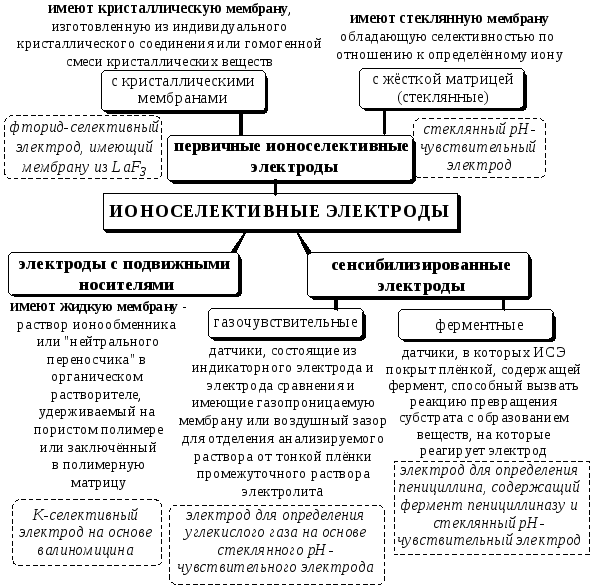
Стеклянный электрод для измерения рН (рис.26.2) имеет тонкую рН-чувствительную мембрану, изготовленную из специального стекла, содержащего 22% Na2O, 6% CaO и 72% SiO2. Внутри электрода находится 0,1 М HCl, насыщенный хлоридом серебра, и хлоридсеребряный электрод сравнения. Перед началом работы электрод, который хранился в сухом виде, вымачивают в 0,1 М HCl. Для того чтобы электрод работал, на внутренней и внешней сторонах мембраны должна образоваться тонкая плёнка гидратированного геля. Ионы водорода должны вытеснить ионы Na+ из пустот на поверхности стекла.
В основе работы стеклянного электрода для измерения рН лежит ионообменное равновесие
H+раствор H+стекло
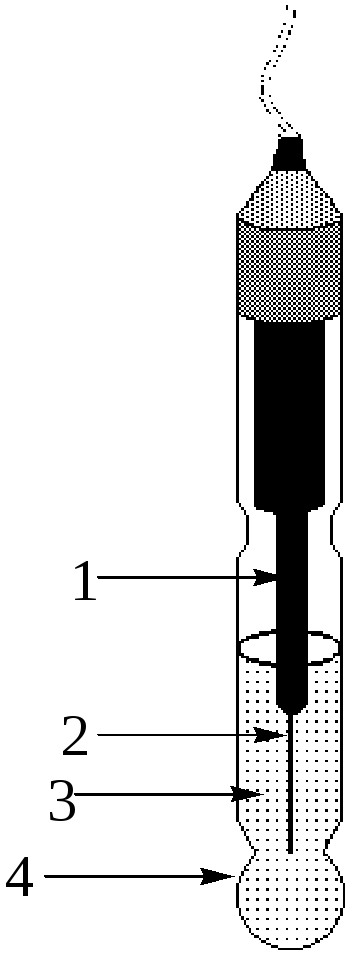
Рис.
26.2.
Стеклянный электрод
1 –
внутренний хлоридсеребряный электрод;
2 – серебряная проволочка; 3 – 0,1 М HCl,
насыщенный AgCl;
4 – стеклянная рН-чувствительная
мембрана)
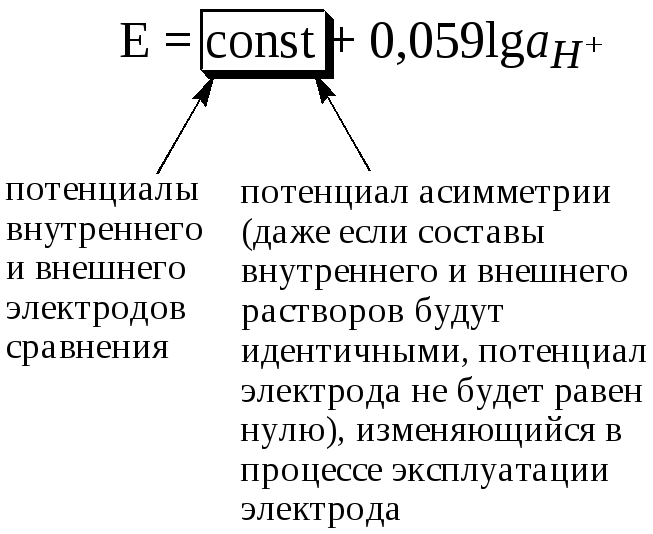
Из-за наличия потенциала асимметрии перед началом работы стеклянный электрод для измерения рН градуируют по стандартным буферным растворам (табл. 26.1).
Табл. 26.1.
Стандартные буферные растворы, используемые для
градуировки стеклянного электрода
|
Буферная система |
рН (20 С) |
|
0,05 М раствор тетраоксалата калия |
1,675 |
|
насыщенный (20 С) раствор гидротартрата калия |
3,557 |
|
0,05 М раствор гидрофталата калия |
4,002 |
|
0,025 M KH2PO4 / 0,025 М Na2HPO4 |
6,881 |
|
0,01 M раствор тетрабората натрия |
9,225 |
Стеклянный электрод может быть использован для измерения рН в ограниченном диапазоне рН, зависящем от сорта стекла, из которого изготовлена мембрана.