
Окислительно-восстановительные потенциалы. Направление овр
В каждой окислительно-восстановительной реакции, в том числе, в реакции
Zn + CuSO4 = ZnSO4 + Cu, (1)
участвуют две окислительно-восстановительные пары
-
восстановитель и его окисленная форма
Zn — Zn2+;
-
окислитель и его восстановленная форма
Cu2+ — Cu.
Каждая
пара имеет потенциальную возможность
принимать и отдавать электроны. Мерой
окислительно-восстановительной
способности данной пары является
окислительно-восстановительный или
электродный потенциал,
который обозначают
![]() ,
где Ок-окисленная форма, Вс-восстановленная
форма данной пары (например,
,
где Ок-окисленная форма, Вс-восстановленная
форма данной пары (например,
![]() ,
,
![]() ).
Размерность потенциала – Вольт.
Стандартные потенциалы большого числа
окислительно-восстановительных пар
измерены или рассчитаны и приведе-ны в
справочных таблицах. Следует отметить,
что за нуль принят
стандартный окислительно-восстановительный
потенциал пары Н+/Н2,
).
Размерность потенциала – Вольт.
Стандартные потенциалы большого числа
окислительно-восстановительных пар
измерены или рассчитаны и приведе-ны в
справочных таблицах. Следует отметить,
что за нуль принят
стандартный окислительно-восстановительный
потенциал пары Н+/Н2,
![]() .
.
-
Чем больше значение потенциала окислительно-восстановительной пары, тем более сильным окислителем является окисленная форма (Ок) данной пары. Чем меньше значение потенциала - тем более сильным восстановите-лем является восстановленная форма (Вс) окислительно-восстановительной пары. В частности, сильнейший окислитель – фтор,
 сильнейшие восстановители – щелочные
металлы,
сильнейшие восстановители – щелочные
металлы,
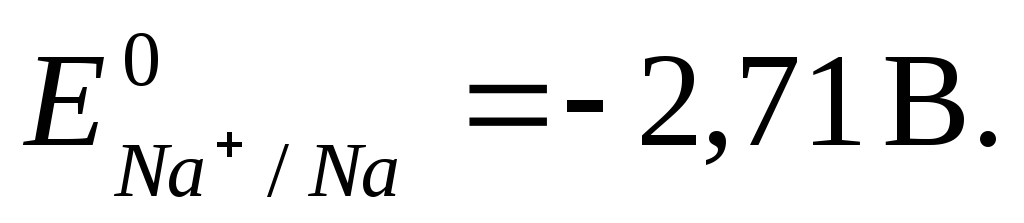
В ходе ОВР электроны всегда перемещаются от пары, содержащей восстановитель, к паре, содержащей окислитель. Обозначим
![]() - о.-в. потенциал пары,
содержащей окислитель;
- о.-в. потенциал пары,
содержащей окислитель;
![]() - о.-в. потенциал пары, содержащей
восстано-
- о.-в. потенциал пары, содержащей
восстано-
витель.
По
значениям о.-в. потенциалов можно
рассчитать ЭДС реакции:
![]()
![]() -
-
![]() .
.
Условие самопроизвольного прохождения ОВР:
![]() или
или
![]() >
>![]() .
.
Для предполагаемой ОВР:
если
![]() (
(![]() >
>![]() )
– реакция возможна,
)
– реакция возможна,
если
![]() (
(![]() <
<![]() )
- реакция невозможна
)
- реакция невозможна
(возможна обратная реакция).
Для рассмотренной ранее реакции (1):
![]()
![]()
![]()
т.е. реакция в стандартных условиях возможна.
Рассмотрим пример использования значений стандарт-ных окислительно-восстановительных потенциалов.
Пример. Возможна ли в стандартных условиях реакция:
SnCl4 + 2FeCl2 = SnCl2 + 2FeCl3 ?
ок-ль в-ль
Ионная схема реакции:
Sn4+ +2Fe2+ = Sn2+ + 2Fe3+,
ок-ль в-ль
Из справочных таблиц выпишем стандартные потен-циалы о.-в. пар:
![]() ,
,
![]() .
.
![]() реакция в стандартных
условиях невозможна, возможна обратная
реакция.
реакция в стандартных
условиях невозможна, возможна обратная
реакция.
Ионная схема обратной реакции:
Sn2+ +2Fe3+ = Sn4+ + 2Fe2+,
в-ль ок-ль
![]() ,
,
![]() .
.
![]() реакция в стандартных
условиях возможна.
реакция в стандартных
условиях возможна.
