
- •1.Кровь:определение понятие,клеточный состав,его содержание в %.Плазма и сыворотка крови:понятие,методы получения,функции крови.
- •4.Альбумины сыворотки крови:место биосинтеза,особенности состав,структуры,физико-химических свойств,функций.
- •5.Белки острой фазы воспаления:d1-антитрипсин,2d-макроглобулин,гаптоглобулин,с-реактивный белок-механизмы повышения их уровня в крови при воспалении,диагностическое значение.
- •6.Иммуноглобулины:классификация,общая структура,место биосинтеза,функции,диагностическое значение.Понятие о белках системы комплемента.
- •7.Остаточный азот:понятие,состав,физиологическая роль и клиннико-диагностическое значение.
- •9.Ферменты плазмы крови:классификация,использование в энзимдиагностике.
- •Биохимия форменных элементов крови.
- •2.Особенности метаболизма веществ в эритроците:обмен метгемоглобина,связь с гликолизом.
- •3.Механизмы свободно-радикального окисления(сро) и антиоксидантная защита в эритроцитах(аоз).Самый еб*утый вопрос,надеюсь он никому не попадется)
- •4.Гемоглобин строение,функции,типы.Талассемии.Миоглобин:строение,функции,отличие от гемоглобина.
- •5.Биосинтез гема в организме человека:локализация,субстраты,ферменты,этапы и регуляция.Порфирин.
- •6.Связывание гемоглобина с кислородом(тритерный механизм),кооператорный аллостерический эффект.Кривая насыщения гемоглобина и миоглобина кислородом.
- •7.Сродство гемоглобина к кислороду и его регуляции(эффект Бора,влияние 2,3-дифосфоглицерата).
- •8.Транспорт углекислого газа эритроцитом.
- •9.Лейкоцит:функции,химический состав,особенности обмена веществ.Биохимические аспекты фагоцитоза.
- •Свертывающие и противосвертывающие системы крови.Фибринолиз
- •2.Функции сосудистого эндотелия,субэндотелия и тромбоцитов.
- •3.Первичный сосудисто-тромбоцитарный гемостаз.Участие тромбоксана и простоциклина в регуляции первичного гемостаза.
- •4.Понятие о синдроме диссеминированного внутрисосудистого свертывания(двс-синдром):причины,стадии,биохимические аспекты лечения.
- •5.Вторичный плазменный (коагуляционный) гоместаз:внутрений и внешней механизм свертывания.Взаимодействия внешнего и внутренного механизма свертывания.
- •7.Наследственные гемофилии:причины,принципы лечения.
- •8.Такой же как и 4,хз почему 2 раза,ах да это же 7 этаж,пережить и сдать,забыть как страшный сон,но память все равно останется)
- •1.Системный гомеостаз железа в организме человека этапы обмена,основные клетки,принимающие участие в обмене железа,суточные нормы и источники железа.
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •2.Виды железа,поступающего с пищей и особенности его всасывания в тонком кишечнике.
- •3.Метаболизм железа в энтерецитах,характеристика основных белков и ферментных систем,судьба всосавшегося железа в энтерцитах в зависимости от концентрации железа в крови.
- •6.Контроль поступления железа в кровь из кишечника и макрофагов:роль гепсидина,факторы,влияющие на его синтез.
- •7.Регуляция обмена железа в организме человека:система ire/irPи ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
- •3. Ферритин и гемосидерин внутренних органов;
- •9.Нарушение обмена железа:биохимические основы развития жледезофицитной анемии и гемохроматоза.
Биохимия форменных элементов крови.
1.Эритроцит:особенности структуры,химического состава мембраны и цитозоля,функции.






2.Особенности метаболизма веществ в эритроците:обмен метгемоглобина,связь с гликолизом.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
В зрелых эритроцитах углеводы не синтезируются. Катаболизм углеводов происходит на 90% в анаэробном гликолизе и на 10% в ПФШ, основной субстрат – глюкоза. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Наряду с глюкозой эритроцит может использовать фруктозу, маннозу, галактозу, а также инозин, ксилит и сорбит.
В процессе гликолиза с участием фосфоглицераткиназыипируваткиназыобразуется АТФ, а с участием3-ФГА дегидрогеназывосстанавливается НАДН2. В окислительной стадии ПФШ с участиемглюкозо-6-фосфат дегидрогеназыи6-фосфоглюконат дегидрогеназы восстанавливается НАДФН2.
Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и направляется преимущественно в печень для глюконеогенеза.


3.Механизмы свободно-радикального окисления(сро) и антиоксидантная защита в эритроцитах(аоз).Самый еб*утый вопрос,надеюсь он никому не попадется)


В то же самое время в норме содержание продуктов свободнорадикального окисления невысоко, что достигается существованием постоянно функционирующего в организме комплекса биологических механизмов эндогенной системы антиоксидантной защиты (АОЗ). Эндогенная система антиоксидантной защиты ограничивает процесс свободнорадикального окисления липидов и белков практически во всех его звеньях и поддерживает эти реакции на относительно постоянном уровне. Строгая регламентация реакций свободнорадикального окисления обеспечивается согласованным функционированием ферментативных и неферментативных звеньев эндогенной системы антиоксидантной защиты, контролирующей уровень в организме активных форм кислорода (супероксидный анион-радикал, гидроксильный радикал, синглетный кислород), свободных радикалов и молекулярных продуктов СРО липидов и белков. Функционирующие в каждой клетке, органах, тканях и в организме в целом ферментативные и неферментативные звенья эндогенной системы антиоксидантной защиты играют исключительную роль в поддержании гомеостаза при взаимодействии организма с изменяющимися условиями внешней и внутренней среды для обеспечении его жизнедеятельности.

4.Гемоглобин строение,функции,типы.Талассемии.Миоглобин:строение,функции,отличие от гемоглобина.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
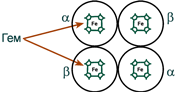
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком - контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидинакоординационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.



Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
-
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
-
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
-
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
-
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
-
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
-
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).


