
- •Тема 1. Законы термодинамики
- •§1. Предмет физической химии. Проблемы и методы физической химии.
- •§2. Первый закон термодинамики.
- •§3. Применение I закона термодинамики к простейшим процессам.
- •§4. Примеры решения задач.
- •§5. Термодинамические расчеты. Закон Гесса.
- •§ 6. Теплота образования.
- •§7. Теплота сгорания.
- •§8. Зависимость теплового эффекта реакции от температуры.
- •§9. Температурная зависимость теплоемкостей.
- •§10. Примеры решения задач.
- •Таким образом
- •§11. Второй закон термодинамики.
- •§12. Необратимые и обратимые процессы.
- •§13. Математическое выражение второго закона термодинамики.
- •§14. Цикл Карно.
- •§15. Вычисление изменения энтропии при различных процессах.
- •§16. Примеры решения задач.
- •§17. Термодинамические функции: энергия Гиббса и энергия Гельмгольца.
- •§18. Зависимость свободной энергии и энтропии от параметров состояния.
- •§19. Примеры решения задач.
- •§20. Уравнение Клаузиуса- Клайперона.
- •§21. Примеры решения задач:
- •§22. III закон термодинамики.
- •Тема 2. Химическое равновесие.
- •§1. Химическое равновесие в гомогенных системах.
- •§2. Различные формы констант равновесия.
- •§3. Расчет выхода реакции.
- •§4. Изотерма химической реакции.
- •§5. Зависимость константы равновесия от температуры.
- •§6. Гетерогенные химические реакции.
- •§7. Расчеты химического равновесия по таблицам стандартных термодинамических величин.
- •§8. Примеры решения задач.
- •Таким образом
- •Под величиной lnP подразумевается логарифм отношения исходных парциальных давлений продуктов реакции и исходных веществ в степенях соответствующих их стехиометрическим коэффициентам.
- •Тема 3. Фазовые равновесия.
- •§1. Основные определения. Условия равновесия в многофазных системах. Правило фаз Гиббса.
- •§2. Вывод правила фаз Гиббса
- •§3. Диаграммы равновесия двухкомпонентных систем.
- •§3.1. Первый тип диаграмм. Компоненты а и в неограниченно взаимно растворимы в жидком состоянии, а в твердом состоянии не образуют ни растворов, ни соединений.
- •§3.2. Правило рычага.
- •§3.3. Второй тип диаграмм. Компоненты а и в неограниченно растворимы друг в друге как в жидком, так и в твердом состоянии и не образуют между собой химических соединений.
- •§3.4. Третий тип диаграмм. Компоненты а и в имеют ограниченную взаимную растворимость в твердом состоянии и неограниченную взаимную растворимость в жидком состоянии.
- •§3.5. Четвертый тип диаграмм. Компоненты а и в образуют прочные химические соединения, устойчивые вплоть до температуры плавления.
- •§3.6. Пятый вид диаграмм. Компоненты а и в образуют непрочное соединение, разлагающееся ниже температуры плавления.
- •§3.7. Пример.
- •Тема 4. Термодинамическая теория растворов.
- •§1. Основные определения.
- •§2. Способы выражения концентраций растворов.
- •§3. Примеры решения задач.
- •§4. Парциальные мольные величины.
- •§5. Бесконечно-разбавленные растворы.
- •§6. Давление пара растворенного вещества.
- •§7. Давление пара растворителя.
- •Сколько олова нужно растворить в 50 г ртути, чтобы давление пара ртути понизилось от 709,9 до 700 мм.Рт.Ст.
- •§8. Температуры кипения и замерзания разбавленных растворов нелетучих веществ.
- •§9. Осмотическое давление.
- •§10. Закон действующих масс для разбавленных растворов.
- •§11. Закон распределения.
- •§12. Совершенные растворы.
- •§13. Давление пара.
- •§14. Закон действующих масс.
- •§15. Растворимость.
- •§15. Неидеальные растворы. Отклонения от идеальности.
- •§16. Термодинамическая активность.
- •§17. Выбор стандартного состояния.
- •§18. Закон действующих масс.
- •§19. Распределение компонентов между фазами.
- •§20. Связь между активностями компонентов.
- •§21. Методы определения активности.
- •Измерение давления пара.
- •Изучение химического равновесия.
- •Определение активности по закону распределения.
§8. Примеры решения задач.
Пример 1.
Константа равновесия реакции CO+H2O=CO2+H2 при 1080 К равна 1. Определить состав равновесной газовой смеси в мольных процентах, если до начала реакции было взято 2 моля СО и 3 моля H2O.
-
CO + H2O = CO2 + H2
исход.
2
3
0
0
равновесн.
2-z
3-z
z
z
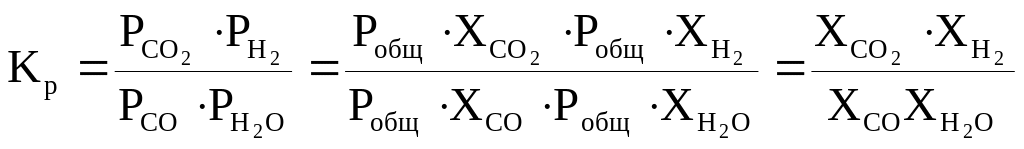
Поскольку реакция идет без изменения числа молей (n=1-1+1+1=0), то константу равновесия можно записать:
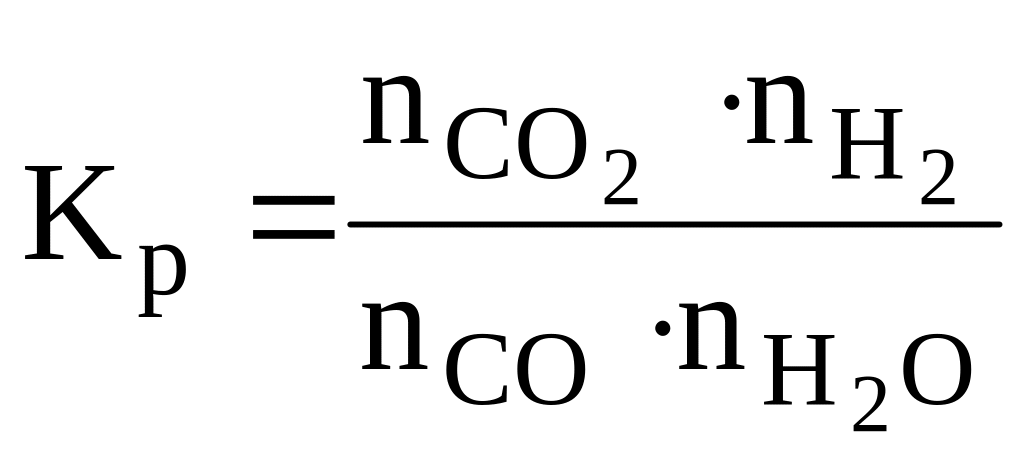
Таким образом
![]()
z2=6-5z+z2
5z=6
z=1,2
Для данного случая интервал значений для z может быть выбран как:
![]()
Полученное нами значение z удовлетворяет выбранному интервалу.
Состав равновесной газовой фазы обычно выражают в мольных долях или мольных процентах.
Рассчитаем мольные доли.
ni=2-z+3-z+z+z=5
![]()
мол%(H2)=![]() .100%=24%
.100%=24%
![]()
мол%(CO2)=![]() .100%=24%
.100%=24%
![]()
мол%(H2O)=![]() .100%=36%
.100%=36%
![]()
мол%(CO)=![]() .100%=16%
.100%=16%
Пример 2.
Для реакции 2Cu(тв)+2HCl=2CuCl(тв)+H2 стандартное изменение энергии Гиббса определяется по уравнению G(T)=43060+58,35.T (Дж/моль). Определить состав равновесной газовой фазы при P=0,5 атм и T=671 K, если в исходный момент смешали 2 моля H2 и 2 моля HCl.
-
2Cu(тв)+2HCl=2CuCl(тв)+H2
исход.
2
2
равновесн.
2-2z
2+z
![]()
ni=2-2.z+2+z=4-z
|
|
![]()
Для того, чтобы рассчитать состав равновесной газовой фазы необходимо найти численное значение Кр. Это можно сделать, зная G.
G=43060+58,35.T=43060+58,35.671=3907,15 Дж/моль
G=RTlnKp
![]()
Kp=2
![]()
5.z2-6.z-4=0
![]()
-
z1=1,68
z2=0,48
Интервал для z в данном случае: 2<z<1. Этому неравенству удовлетворяет корень уравнения z2=0,48.
-
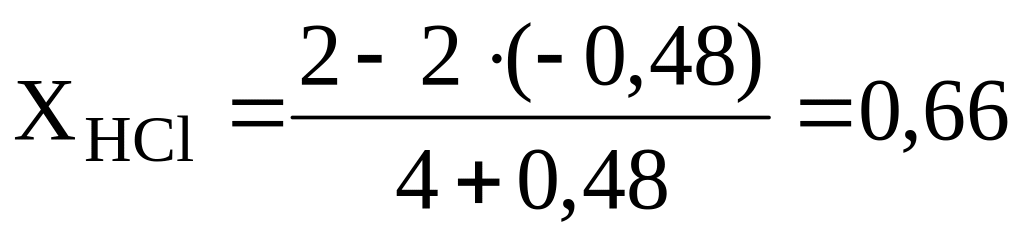
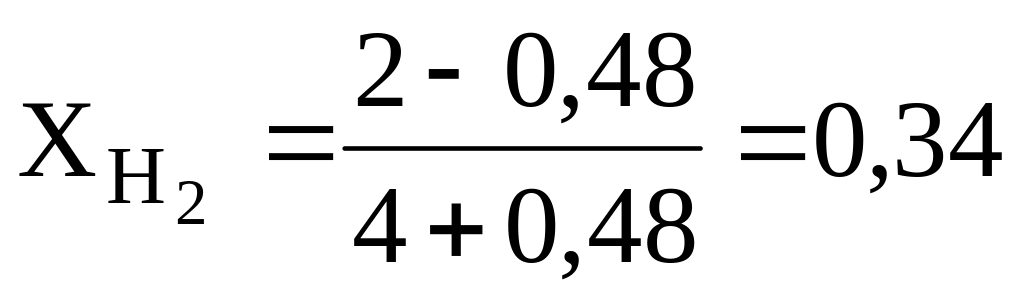
мол%(HCl)=0,66.100%=66%
мол%(H2)=0,34.100%=34%
Пример 3.
Для реакции FeOтв+H2=Feтв+H2O стандартное изменение энергии Гиббса определяется по уравнению G(Т)=162729,44.T Дж/моль. В каком направлении пойдет реакция при 1000 К и давлении 2 атм., если смешать 3 моля H2O и 7 молей H2?
Для того, чтобы определить направление, в котором пойдет реакция, воспользуемся уравнением изотермы Вант-Гоффа:
G=G+RTln P
Если рассчитанное значение G<0, реакция идет в сторону образования продуктов, если G>0 – в сторону образования исходных веществ, G=0, реакция находится в состоянии равновесия.
G(T)=162729,44.Т=162729,44.1000=6832 Дж/моль
