
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Получение алканов
- •2. Каталитическое гидрирование (Ni, Pd, Pt) ненасыщенных углеводородов при нагревании:
- •4. Гидролиз карбидов
- •5. Декарбоксилирование солей низших карбоновых кислот
- •Химические свойства алканов
- •2. Нитрование (реакция Коновалова)- реакция радикального замещения sr.
- •3. Реакции дегидрирования
- •5. Реакции горения
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Крекинг и пиролиз нефтепродуктов.
- •2. Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании :
- •Химические свойства алкенов.
- •2. Реакции полимеризации:
- •3. Реакции окисления
- •Решение:
- •1) Условию задачи отвечает следующее строение:
- •Задачи и упражнения для самостоятельного решения
- •97. Смесь этена с бутаном, с плотность по водороду 21,5, сожгли. Продукты сгорания 20 л этой смеси пропустили через избыток раствора гидроксида кальция. Определите массу выпавшего осадка.
- •Диеновые углеводороды
- •1. Галогенирование
- •4. Полимеризация.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Алкины.
- •2. Взаимодействие карбидов металлов с водой
- •4. Дегидрогалогенирование дигалогеналканов:
- •5. Из галогеналканов под действием цинка:
- •Химические свойства алкинов
- •1. Галогенирование
- •3. Гидратация.
- •4. Гидрирование.
- •6. Кислотные свойства алкинов
- •8. Горение
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Циклоалканы
- •Получение циклоалканов
- •2. Циклогексан и его производные получают гидрированием бензола:
- •Химические свойства циклоалканов
- •Примеры решения задач Пример 18.
- •Решение:
- •Пример 19.
- •Решение:
- •Пример 20.
- •Задачи и упражнения для самостоятельного решения
- •Получение аренов
- •Химические свойства аренов
- •1. Электрофильное замещение в бензольном кольце
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Гидролиз алкилгалогенидов в кислой или щелочной среде:
- •3. Гидролиз сложных эфиров:
- •4. Восстановление более высокоокисленных соединений
- •5. Биохимические методы.
- •1. Кислотные свойства.
- •3. Дегидратация(отщепление воды).
- •5. Окисление спиртов
- •1. Многие из химических свойств двухатомных и трёхатомных спиртов походят на таковые одноатомных спиртов. Отличия:
- •Задачи и упражнения для самостоятельного решения
- •1. Кислотные свойства
- •2. Реакции электрофильного замещения в бензольном кольце
- •3. Окислительно-восстановительные реакции
- •4. Реакции комплексообразования
- •Задачи и упражнения для самостоятельного решения
- •Карбонильные соединения
- •Получение карбонильных соединений
- •1. Окисление спиртов
- •4. Гидратация алкинов(реакция Кучерова).
- •5. Получение ацетона в промышленности
- •Химические свойства карбонильных соединений
- •1. Окисление
- •2. Восстановление.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Карбоновые кислоты
- •1. Растворимые кислоты диссоциируют в воде:
- •2. Карбоновые кислоты (особенно растворимые в воде)
- •9. Окисление
- •11. Реакции в бензольном ядре ароматических кислот
- •12. Реакции ненасыщенных кислот
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Сложные эфиры. Жиры.
- •2. Взаимодействие ангидрида карбоновой кислоты со спиртом
- •3. Взаимодействие хлорангидрида карбоновой кислоты со спиртом
- •Углеводы
- •1. Окисление
- •3. Алкилирование аминов:
- •4. Взаимодействие с ангидридами и хлорангидридами
- •7. Особенности ароматических аминов(анилина)
- •8. Окисление анилина
- •2. Обработка галогенсодержащих карбоновых кислот избытком аммиака:
- •3. Реакции, обусловленные наличием двух функциональных групп в
2. Гидролиз алкилгалогенидов в кислой или щелочной среде:
CH3-CH2-CH2-Br +NaOH(H2O) CH3-CH2-CH2-OH +NaBr
3. Гидролиз сложных эфиров:
а)в кислой среде
CH3COOC2H5 + H2O(H+) ↔ CH3COOH + C2H5OH
б) щелочной гидролиз(омыление)
CH3COOC2H5 + NaOH(H2O) CH3COONa + C2H5OH
4. Восстановление более высокоокисленных соединений
а) альдегиды:
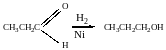
пропаналь пропанол-1
б) кетоны:
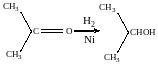
пропанон пропанол-2
в) кислоты:

уксусная кислота этанол
г) сложные эфиры:
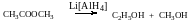
метилацетат этанол метанол
Восстановление по пути а) и б) можно провести с помощью многих восстановителей- амальгама натрия и вода, натрий в спирте, каталитическое восстановление водородом на тонкоизмельчённом никелевом или платиновым катализатором.
Восстановить карбоновые кислоты и их сложные эфиры можно только с помощью сильных восстановителей, таких как алюмогидрид лития LiAlH4.
5. Биохимические методы.
Например, этанол получается при ферментативном разложении глюкозы:
С6Н12О6 2С2Н5ОН + 2СО2
Химические свойства спиртов
1. Кислотные свойства.
Спирты – чрезвычайно слабые кислоты, они практически не реагируют водными растворами щелочей.Но водород в гидроксильной группе можно заместить путём прямого взаимодействия спирта со щелочными и щелочноземельными металлами, при этом образуются алкоголяты, например:
C2H5OH + Na C2H5ONa + 0,5H2
этилат натрия
Поскольку спирты – чрезвычайно слабые кислоты, их соли(алкоголяты) – очень сильные основания. Основность алкоголята зависит от типа исходного спирта. В растворе алкоголяты третичных спиртов – более сильные основания, чем алкоголяты вторичных спиртов, которые в свою очередь сильнее, чем алкоголяты первичных спиртов.
Алкоголяты представляют собой твёрдые вещества, растворимые в спирте. Они легко гидролизуются водой с образованием соответствующего спирта и щелочи:
C2H5ONa + H2O C2H5OH + NaOH
2. Реакции замещения гидроксильной группы(реакции нуклеофильного замещения).
Спирты реагируют с газообразными галогеноводородами( в отсутствие воды), например:
C2H5OH + HBr C2H5Br + H2O
3. Дегидратация(отщепление воды).
Нагревание спирта с концентрированной серной кислотой приводит к отщеплению воды и образованию алкена. Конкурирующим процессом является межмолекулярная дегидратация, в результате которой образуется простой эфир.
Прямая дегидратация спиртов под действием серной кислоты протекает с высоким выходом простого эфира только в случае первичных спиртов, например:
2С2Н5ОН С2Н5 – О – С2Н5 + Н2О
Вторичные и третичные спирты в этих условиях легко превращаются в алкены
Во многих случаях процесс дегидратации может привести к нескольким изомерам. Основной продукт образуется в соответствии с правилом Зайцева: в наибольшем количестве образуется алкен с наименьшим числом атомов водорода у двойной связи.
(CH3)2C(OH)CH2CH3 (CH3)2C = CHCH3 + H2O
2-метилбутанол-2 бутен-2
Внутримолекулярная дегидратация преобладает при большом избытке серной кислоты и более сильном нагревании(t> 140оС), а межмолекулярная – при нагревании избытка спирта с серной кислотой( t< 140оС)
4. Этерификация (образование сложных эфиров).
Сложные эфиры образуются при действии на спирты минеральных или органических кислот.
С органическими кислотами реакция протекает в присутствии минеральных кислот(катализатор), например:
СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О
