
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Получение алканов
- •2. Каталитическое гидрирование (Ni, Pd, Pt) ненасыщенных углеводородов при нагревании:
- •4. Гидролиз карбидов
- •5. Декарбоксилирование солей низших карбоновых кислот
- •Химические свойства алканов
- •2. Нитрование (реакция Коновалова)- реакция радикального замещения sr.
- •3. Реакции дегидрирования
- •5. Реакции горения
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Крекинг и пиролиз нефтепродуктов.
- •2. Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании :
- •Химические свойства алкенов.
- •2. Реакции полимеризации:
- •3. Реакции окисления
- •Решение:
- •1) Условию задачи отвечает следующее строение:
- •Задачи и упражнения для самостоятельного решения
- •97. Смесь этена с бутаном, с плотность по водороду 21,5, сожгли. Продукты сгорания 20 л этой смеси пропустили через избыток раствора гидроксида кальция. Определите массу выпавшего осадка.
- •Диеновые углеводороды
- •1. Галогенирование
- •4. Полимеризация.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Алкины.
- •2. Взаимодействие карбидов металлов с водой
- •4. Дегидрогалогенирование дигалогеналканов:
- •5. Из галогеналканов под действием цинка:
- •Химические свойства алкинов
- •1. Галогенирование
- •3. Гидратация.
- •4. Гидрирование.
- •6. Кислотные свойства алкинов
- •8. Горение
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Циклоалканы
- •Получение циклоалканов
- •2. Циклогексан и его производные получают гидрированием бензола:
- •Химические свойства циклоалканов
- •Примеры решения задач Пример 18.
- •Решение:
- •Пример 19.
- •Решение:
- •Пример 20.
- •Задачи и упражнения для самостоятельного решения
- •Получение аренов
- •Химические свойства аренов
- •1. Электрофильное замещение в бензольном кольце
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Гидролиз алкилгалогенидов в кислой или щелочной среде:
- •3. Гидролиз сложных эфиров:
- •4. Восстановление более высокоокисленных соединений
- •5. Биохимические методы.
- •1. Кислотные свойства.
- •3. Дегидратация(отщепление воды).
- •5. Окисление спиртов
- •1. Многие из химических свойств двухатомных и трёхатомных спиртов походят на таковые одноатомных спиртов. Отличия:
- •Задачи и упражнения для самостоятельного решения
- •1. Кислотные свойства
- •2. Реакции электрофильного замещения в бензольном кольце
- •3. Окислительно-восстановительные реакции
- •4. Реакции комплексообразования
- •Задачи и упражнения для самостоятельного решения
- •Карбонильные соединения
- •Получение карбонильных соединений
- •1. Окисление спиртов
- •4. Гидратация алкинов(реакция Кучерова).
- •5. Получение ацетона в промышленности
- •Химические свойства карбонильных соединений
- •1. Окисление
- •2. Восстановление.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Карбоновые кислоты
- •1. Растворимые кислоты диссоциируют в воде:
- •2. Карбоновые кислоты (особенно растворимые в воде)
- •9. Окисление
- •11. Реакции в бензольном ядре ароматических кислот
- •12. Реакции ненасыщенных кислот
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Сложные эфиры. Жиры.
- •2. Взаимодействие ангидрида карбоновой кислоты со спиртом
- •3. Взаимодействие хлорангидрида карбоновой кислоты со спиртом
- •Углеводы
- •1. Окисление
- •3. Алкилирование аминов:
- •4. Взаимодействие с ангидридами и хлорангидридами
- •7. Особенности ароматических аминов(анилина)
- •8. Окисление анилина
- •2. Обработка галогенсодержащих карбоновых кислот избытком аммиака:
- •3. Реакции, обусловленные наличием двух функциональных групп в
Углеводы
Углеводы- класс природных соединений, включающий простые углеводы (моносахариды) и сложные. Моносахариды являются гетерофункциональными соединениями, в молекулах которых одновременно содержатся карбонильная (альдегидная или кетонная) и несколько гидроксильных групп. Большинство этих веществ имеет состав, соответсвующей общей формуле CnH2nOn.Наиболее распространены в природе пентозы(5 углеродных атомов) и гексозы(6 углеродных атомов). Все моносахариды имеют один или несколько асимметрических атомов углерода и поэтому имеют стереоизомеры( D и L). Нумерация цепи в углеводах начинается от атома углерода карбонильной группы или от того атома углерода, к которому она ближе находится.
Примеры стереоизомеров глюкозы и фруктозы:
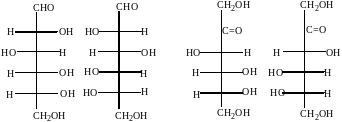
D-глюкоза L-глюкоза D-фруктоза L-фруктоза
Моносахариды в растворе присутствуют в основном не в открытой (линейной) форме, а в циклической, которая является продуктом взаимодействия спиртового гидроксила и карбонильной группы. Таким образом, моносахариды представляют собой циклические полуацетали- пяти или шестичленные. Например, циклические формы β-рибозы и β-дезоксирибозы , входящие в состав нуклеиновых кислот:

β - рибоза β - дезоксирибоза
Сложные углеводы – углеводы, способные гидролизоваться с образованием простых углеводов. Сложные углеводы подразделяются на олигосахариды и полисахариды. Олигосахариды при гидролизе дают несколько молекул моносахаридов, полисахариды-множество таких молекул. Важнейшими олигосахаридами являются дисахариды. Наибольшее значение из дисахаридов имеет сахароза – свекловичный или тростниковый сахар С12Н22О11, который при гидролизе даёт глюкозу и фруктозу. Полисахариды – это сложные сахара, каждая молекула которых при гидролизе распадается на большое число молекул моносахаридов(от 30 тысяч до 400 миллионов).Состав полисахаридов можно выразить формулой (С6Н10О5)n. Все они состоят из остатков молекул глюкозы, соединённых друг с другом. Наибольшее значение из полисахаридов имеют крахмал( полимер α– глюкозы) и целлюлоза( полимер β – глюкозы)
Химические свойства
Для глюкозы характерны многие реакции простых альдегидов.
1. Окисление
а) При окислении мягкими окислителями (бромная вода) получается глюконовая кислота
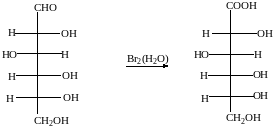
D- глюкоза D- глюконовая кислота
Подобно обычным альдегидам моносахариды, в частности, глюкоза, легко окисляются аммиачным раствором оксида серебра [Ag(NH3)2]OH , проявляя, таким образом, сильную восстанавливающую способность( реакция «серебряного зеркала»).
(C5H11O5)CH=O + 2[Ag(NH3)2]OH
(C5H11O5)COONH4 + 2Ag↓ + 3NH3 + H2O
б) С помощью сильного окислителя (разбавленной азотной кислотой) окисляется вместе с альдегидной группой спиртовая группа, которая находится в конце цепи. При этом образуется сахарная кислота
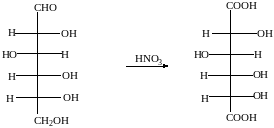
глюкоза сахарная кислота
2. Восстановление
При восстановлении с помощью водорода в присутствии катализаторов гидрирования(никель) образуется шестиатомный спирт глюцит(сорбит):
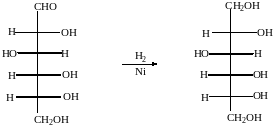
глюкоза сорбит
3. Алкилирование
При взаимодействия спиртовых групп моносахаридов алкилгалогенидами образуются простые эфиры:
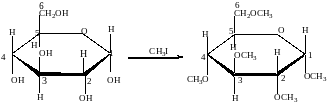
4. Ацилирование
При взаимодействии моносахаридов с уксусным ангидридом образуются сложные эфиры с участием всех гидроксильных групп,например:

5. Брожение гексоз
Брожение – сложный биохимический процесс под влиянием различных ферментов.
а) спиртовое
С6Н12О6 2С2Н5ОН + 2СО2
б) маслянокислое
С6Н12О6 СН3СН2СН2СООН + 2СО2 + 2Н2
в) молочнокислое
С6Н12О6 2СН3СН(ОН)СООН
6. Химические свойства целлюлозы определяются прежде
всего присутствием гидроксильных групп. За счёт этих групп целлюлоза даёт простые и сложные эфиры. Например:
[C6H7O2(OH)3]n + 3nHNO3(H2SO4) → [C6H7O2(ONO2)3] + 3nH2O
тринитроцеллюлоза
7. Реакция, характерная для многоатомных спиртов-комплексообразование с гидроксидом меди(II) на холоду(интенсивное синее окрашивание).
Примеры решения задач
Пример 34. При маслянокислом брожении глюкозы образовалось 13,44л(н.у.)
смеси газообразных веществ. Выход в реакции брожения составил 60%. Какая
масса глюкозы была взята для брожения?
Решение:
1)Напишем уравнение реакции
С6Н12О6 С3Н7СООН + 2СО2 + 2Н2
2)Определяем количество вещества газообразных продуктов
n = 13,44/22,4 = 0,6 моль
3) Для образования 0,6 моль газов(0,3 моль СО2 и 0,3 моль Н2)
В соответствии с уравнением реакции прореагировало 0,15 моль глюкозы.
4) С учётом выхода глюкозы необходимо 0,15/ 0,6 = 0,25 моль
Масса глюкозы m(глюкозы) = 0,25∙180 = 45 г
Ответ: 45 г
Пример 35. Целлюлозу обработали нитрующей смесью(HNO3 и H2SO4), в
результате был получен тринитрат целлюлозы. При этом масса нитрующей
смеси уменьшилась на 108 г. Определите массу полученной
тринитроцеллюлозы (выход 100%).
Решение:
Напишем уравнение реакции
[C6H7O2(OH)3]n + 3nHNO3 [C6H7O2(ONO2)3]n + 3nH2O
х 3х х 3х
2) Пусть прореагирует х моль целлюлозы
Тогда в соответствии с уравнением реакции масса нитрующей смеси
уменьшится на 3х∙63 и увеличится на 3х∙18.
3) Итого общий баланс 3х∙63 – 3х∙18 = 3х(63-18) = 135х, что составляет в
соответствии с условием 108 г.
Тогда 108 = 135х. Откуда х= 0,8(моль)
4) Масса тринитроцеллюлозы равна
0,8∙М(C6H7O2(ONO2)3 = 0.8∙297 = 237,6 г
Ответ: 237,6 г
Задачи и упражнения для самостоятельного решения
410. Какие функциональные группы входят в состав молекулы глюкозы?
411. Какие из следующих углеводов подвергаются гидролизу:
а) глюкоза; б) фруктоза; в) крахмал; г)сахароза?
412. Для каких углеводов характерна реакция «серебряного зеркала»:
а) целлюлоза; б) глюкоза; в) фруктоза?
413. Напишите уравнения реакций молочно-кислого, спиртового и
масляно- кислого брожения глюкозы.
414. .Полученное из глюкозы соединение состава С3Н6О3 при взаимодействии
с натрием образует соединение С3Н4Na2О3; с СаСО3 – С6Н10СаО6, а с
этиловым спиртом в присутствии серной кислоты - С5Н10О3.
Напишите уравнения соответствующих реакций и назовите полученные
соединения
415. Полученное из глюкозы соединение состава С6Н14О6 при взаимодействии
с натрием образует соединение C6H8Na6O6, с Cu(OH)2 - соединение синего
цвета, а с избытком уксусной кислоты в кислой среде - С18Н26О12.
Напишите уравнения соответствующих реакций и назовите
полученные соединения.
416. Идентифицируйте растворы:
а) глюкозы и натриевой соли глюконовой кислоты;
б) 2.3-дихлорпропаналя и рибозы;
в) раствора муравьиной кислоты и раствора смеси уксусной кислоты и
глюкозы;
г) водного раствора рибозы и раствора смеси этиленгликоля и формальдегида;
д) фруктозы, рибозы, пропанола и уксусного альдегида.
417. Напишите уравнения реакций, при помощи которых можно осуществить
следующие превращения:
глюкоза молочная кислота гидроксипропионат натрия
этанол этаналь уксусная кислота ацетат натрия
метан углерод.
418. .Осуществите цепочку превращений, используя два различных
ферментативных брожений глюкозы:
глюкоза-брожение) А-(дегидратация) В-(HCl)
С-(NaOHводн) D-(окисление) E-(хлорирование) F
419. .Осуществите превращения:
а) этан метиловый эфир глюконовой кислоты;
б) глюкоза 2-хлорбутират натрия;
в) глюкоза этилбензол; г) уксусная кислота сорбит.
420. Используя только неорганические вещества и ферменты, получите из
глюкозы эфиры пяти кислот и бутанола-2.
421. Смесь больших количеств
а) рибозы и фруктозы подвергли полному восстановлению, а полученные
продукты обработали малым количеством нитрата натрия и серной кислоты.
б) смесь рибозы и дезоксирибозы обработали малым количеством бромида
натрия и серной кислоты
в ) смесь глюкозы и рибозы обработали малым количеством смеси нитрата
калия и серной кислоты.
Какие продукты реакции, не содержащие серу, присутствовали в конечной
смеси?
422. При спиртовом брожении глюкозы было получено 115 г этанола. Какой
объём углекислого газа образовался при этом?
423. При молочнокислом брожении 450 г глюкозы было получено
400 г молочной кислоты.
Вычислите выход продукта реакции в %% от теоретического.
424. Рассчитайте массу глюкозы, при спиртовом брожении которой было
получено 414 мл 96% этанола (плотность 0,8 г/мл), и это составило 80%
от теоретического выхода.
425. Рассчитайте массу глюкозы, которая потребуется для получения из неё
этилового спирта брожением, если известно, что при нагревании полученного
спирта с концентрированной серной кислотой образуется 100 мл диэтилового
эфира (плотность 0925 г/мл), что составляет 50% от теоретически возможного
выхода.
426. В результате спиртового брожения виноградного сахара содержащего 20%
несахаристых примесей было получено 600 мл 96% спирта. Какая масса
виноградного сахара была подвергнута брожению? Какой объём (н.у.)
углекислого газа выделился при этом?
427. Рассчитайте массу 80% уксусной кислоты, которую можно получить из
спирта образующегося при брожении 100 кг глюкозы.
428. Рассчитайте массу сахарозы, которая при гидролизе образует столько
глюкозы, что при брожении последней получается 180 г молочной кислоты.
429. Рассчитайте массу сахарозы, которая подверглась гидролизу, если при
взаимодействии продуктов гидролиза с аммиачным раствором оксида серебра
было получено 43,2 г серебра.
430. Масса осадка, образовавшегося при нагревании раствора моносахарида с
избытком аммиачного раствора оксида серебра, была в 1,2 раза больше массы
углевода. Определите формулу углевода.
431. Образец моносахарида разделили на две равные части. Одну часть сожгли в
избытке кислорода, а другую подвергли полному гидрированию. Масса
образовавшегося углекислого газа была в 132 раза больше массы
водорода, пошедшего на гидрирование. Определите формулу углевода.
432. Определите формулу моносахарида, если для полного сгорания его
потребовался кислород, масса которого в 1,313 раз больше массы исходного
углевода.
433. Образец глюкозы разделили на две равные части. Одну часть сожгли, а
другую подвергли спиртовому брожению. Продукты обеих реакций объединили и
обработали раствором гидроксида калия, масса которого в 1,4 раз больше массы
исходного образца глюкозы. Определите выход реакции брожения глюкозы, если
в конечном растворе содержались две соли в молярном соотношении 1:3.
434. Определите массу 10%-ного раствора глюкозы, подвергшегося
маслянокислому брожению, если при этом выделилось столько же газа, сколько
его образуется при сгорании 34,5 мл этанола (плотность=0,8 г/мл). ( Ответ: 540 г)
435. Газ, выделившийся при спиртовом брожении 100 г глюкозы, пропустили
через 661 мл 8% раствора гидроксида кальция ( плотность раствора 1,05 г/мл).
Осадок отделили и прокалили. Определите массовые доли веществ в полученном
растворе и массу остатка после прокаливания. Выход брожения глюкозы 90%.
436. Смесь глюкозы с сахарозой обработали избытком аммиачного раствора
оксида серебра, при этом выделилось 4,32 г осадка. В результате сгорания такого
же количества смеси выделился газ, при пропускании которого через 61 мл
20% раствора КОН ( плотность раствора 1,1 г/мл). Получили раствор, в котором
массовая доля кислой соли составила 30%. Определите массу смеси углеводов.
437. Смесь глюкозы и сахарозы обработали избытком аммиачного раствора оксида
серебра, при этом выделилось 21,6 г осадка. Такое же количество смеси
обработали при нагревании водой в присутствии серной кислоты, а затем
избытком аммиачного раствора оксида серебра в результате получили 32,4 г
осадка. Определите состав смеси углеводов в массовых долях.
438. Образец целлюлозы массой 3,2436г подвергли полному гидролизу.
Полученный раствор обработали избытком аммиачного раствора оксида серебра и
получили 0,0432г осадка. Определите число мономерных звеньев в целлюлозе.
439.Образец целлюлозы массой 97,2 г обработали раствором нитрующей смеси,
масса нитрующего раствора 252 г. В реакцию нитрования вступила азотная кислота, составляющая 40% от массы исходной нитрующей смеси. Определите массы полученных ди- и тринитратов целлюлозы.
АМИНЫ
Амины – производные аммиака , органические основания.
Классификация
1.Амины могут быть первичными – R-NH2, вторичными – R-NH-R и третичными – R3N.
2.В зависимости от строения углеводородного радикала различают амины: предельные, непредельные, алициклическме, ароматические, гетероциклические и смешанные.
3.По количеству аминогрупп в молекуле могут быть моноамины, диамины и т.д.
Номенклатура
Для аминов используют номенклатуру IUPAC, радикало-функциональную или тривиальную номенклатуры. Например: C2H5NH2 – этанамин (этиламин); C2H5-NH-CH3 – метилэтиламин; C6H5NH2– фениламин (анилин).
Получение аминов
1. Алкилирование аммиака и аминов:
NH3 + CH3Cl CH3NH2 + HCl и т.д.
(см. алкилирование аминов).
2. Восстановление нитросоединений
(на никелевом катализаторе при нагревании или атомарным водородом в
момент выделения):
C2H5NO2 + 3 H2(t,Ni) C2H5NH2 + 2H2O
3 Восстановление амидов
(с помощью LiAlH4)
CH3- CO-NH2 C2H5NH2
4. Восстановление нитробензола
C6H5NO2 +2Al + 2NaOH + 4H2O C6H5NH2 + 2NaAl(OH)4
C6H5NO2 + 3H2(t,Ni) C6H5NH2 + 2H2O
Химические свойства аминов
1. Основность аминов
а) В водных растворах амины, как и аммиак, присоединяют протон, образуя аммонийные соединения. Эти растворы имеют щелочную реакцию, так как содержат ионы ОН-. Поэтому амины, как и аммиак, проявляют основные свойства.
NH3 + H-OH = [NH4]+ + OH-
R-NH2 + H-OH = [R-NH3]+ + OH-
Все амины – слабые основания. Их основность зависит от природы и числа углеводородных радикалов, связанных с атомом азота. В общем случае, основность аминов убывает в следующем ряду:
алифатические амины > NH3 > ароматические амины. Среди алифатических аминов (в случае одинаковых радикалов):
вторичные амины > первичные амины > третичные амины.
б) Взаимодействие со щелочами. Щёлочи, являясь более сильными основаниями, вытесняют аммиак и амины из их солей.
NH4Cl + NaOH NH3↑ + NaCl + H2O
[RNH3]Cl + NaOH RNH2 + NaCl + H2O
в) Реакции с неорганическими кислотами с образованием аммонийных солей: CH3NH2 + HCl CH3NH3Cl (хлорид метиламмония)
г) Взаимодействие с органическими кислотами:
Без нагревания – образование аммонийных солей:
CH3COOH + CH3NH2 CH3COONH3CH3 (ацетат метиламмония)
При нагревании – образование амидов:
СH3COOH + CH3NH2 CH3CO-NHCH3 + H2O
д) Взаимодействие с солями более слабых нерастворимых оснований (реакция обмена):
AlCl3 + 3 CH3NH2 + 3 H2O Al(OH)3↓ + 3 CH3NH3Cl
2. Взаимодействие с азотистой кислотой (качественная реакция , позволяющая различить первичные, вторичные и третичные амины):
а) первичные амины: СH3NH2 + HNO2 CH3OH + N2 + H2O
б) вторичные амины: (СH3)2NH +HNO2 (CH3)2N-N=O +H2O
в) третичные амины с HNO2 не реагируют.
