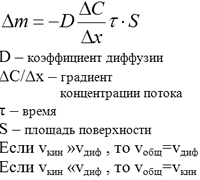- •1. Понятие об электродном потенциале. Равновесный электродный потенциал.
- •2. Гальванический элемент Якоби-Даниэля.
- •3. Газовые электроды: водородный, кислородный
- •4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
- •5. Водородный электрод. Стандартные потенциалы металлов.
- •6. Ряд напряжений металлов. Уравнение Нернста.
- •7. Концентрационный гальванический элемент.
- •8. Окислительно-восстановительные г.Э.
- •9. Поляризация электродов в г.Э.
- •10. Понятие об электролизе. Электролиз расплавов солей.
- •11. Электролиз водных растворов солей.
- •12. Поляризация электродов при электролизе. Потенциал разложения.
- •13. Электролиз с растворимыми анодами.
- •14. Электрохимическое рафинирование металлов.
- •15. Практическое применение электролиза.
- •16. Влияние кислотности среды на процесс коррозии.
- •17. Устройство и принцип действия свинцового аккумулятора.
- •18. Устройство и принцип действия сухого марганцево-цинкового элемента.
- •19. Устройство и принцип действия щелочных аккумуляторов.
- •20. Химическая и электрохимическая коррозия металлов.
- •21. Коррозия металлов в кислой и нейтральной среде.
- •22. Коррозия технического железа.
- •23. Электрохимическая коррозия при контакте двух металлов.
- •27. Диэлектрики и полупроводники.
- •28. Полупроводники примесного типа.
- •29. Собственные полупроводники.
- •30. Закон сохранения энергии. Энтальпия системы.
- •31. Закон Гесса. Термодинамические уравнения.
- •32. Энтропия и её изменение при химических процессах.
- •33. Энергия Гиббса и энергия Гельмгольца.
- •34. Связь между различными термодинамическими функциями.
- •35. Скорость гомогенных химических реакций.
- •36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
- •37. Скорость гетерогенных химических реакций.
- •38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
- •39. Энергия активации химических реакций.
- •40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
- •41. Смещение химического равновесия. Принцип Ле-Шателье.
- •42. Зонная теория кристаллов.
- •43. Типы и свойства кристаллов.
- •44. Строение кинофотоматериалов.
- •45. Химизм основных стадий фотографического процесса.
- •46. Связь между различными термодинамическими функциями.
- •47. Структура и свойства полимеров.
- •48. Химические свойства полимеров.
- •49. Материалы на основе полимеров.
- •50. Методы получения полимеров.
34. Связь между различными термодинамическими функциями.

35. Скорость гомогенных химических реакций.
Гомогенной называется реакция, протекающая в одной фазе (жидкость, газ).
Скорость химической реакции – изменение концентрации исходных или конечных продуктов за определенный промежуток времени.

Скорость химической реакции зависит от концентрации и количественную зависимость в XIX веке предложили Гульдберг и Вааге закон действия масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам aA+bB→mM+nN a, b, m, n – стехиометрические коэффициенты A, B, N, M – концентрации.
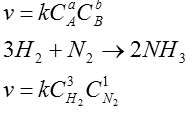
k – константа скорости химической реакции к имеет физический смысл: при концентрации реагирующих веществ равной 1 М она равна скорости химической реакции k зависит от температуры, природы реагирующих веществ, присутствия катализаторов, но не зависит от концентрации реагирующих веществ.
36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
Молекулярность реакции определяется числом элементарных молекул, одновременно вступающих в акт химического взаимодействия.
![]()
Порядок реакции зависит от концентрации реагирующих веществ и определяется из закона действия масс. Порядок может быть определен, как по отдельным компонентам реагирующих веществ, так и суммарный порядок. Порядок по отдельному компоненту равен показателю степени при концентрации данного вещества в уравнении закона действия масс. Суммарный порядок реакции равен сумме степеней при концентрациях в уравнении закона действия масс. Порядок определяется для элементарных стадий процесса. И обычно записываемые реакции представляют собой сумму нескольких элементарных реакций. Для определения общего порядка реакции необходимо определить порядок наиболее медленной элементарной реакции, т. к. она определяет скорость всего процесса. Реакции 1го, 2го, дробного порядка. Если какой либо компонент находится в большом избытке по отношению к другим компонентам, то его концентрация не учитывается при расчете суммарного порядка реакции.
Скорость реакции 1го порядка

37. Скорость гетерогенных химических реакций.
Гетерогенными называются реакции, протекающие на границе раздела 2х фаз (жидкость/жидкость, жидкость/твердое тело, жидкость/газ, газ/твердое тело).
Скорость химической реакции – изменение концентрации исходных или конечных продуктов за определенный промежуток времени.
Скорость гетерогенных химических реакций зависит от площади поверхности раздела фаз. В гетерогенных реакциях важное значение имеют процессы диффузии, т. е. скорость подхода (подвода) реагентов к поверхности раздела и скорость отвода продуктов реакции.
![]() S
- площать поверхности.
S
- площать поверхности.
Концентрацию твердых веществ, вступающих в реакцию, принимают равной 1 М и не вводят в уравнение закона действия масс. Общая скорость гетерогенной химической реакции (Vобщ = vкин+vдиф) складывается из скорости кинетической части и скорости диффузии. vкин определяется из уравнения закона действия масс, vдиф вычисляется по одному из уравнений диффузии.