
- •1. Понятие об электродном потенциале. Равновесный электродный потенциал.
- •2. Гальванический элемент Якоби-Даниэля.
- •3. Газовые электроды: водородный, кислородный
- •4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
- •5. Водородный электрод. Стандартные потенциалы металлов.
- •6. Ряд напряжений металлов. Уравнение Нернста.
- •7. Концентрационный гальванический элемент.
- •8. Окислительно-восстановительные г.Э.
- •9. Поляризация электродов в г.Э.
- •10. Понятие об электролизе. Электролиз расплавов солей.
- •11. Электролиз водных растворов солей.
- •12. Поляризация электродов при электролизе. Потенциал разложения.
- •13. Электролиз с растворимыми анодами.
- •14. Электрохимическое рафинирование металлов.
- •15. Практическое применение электролиза.
- •16. Влияние кислотности среды на процесс коррозии.
- •17. Устройство и принцип действия свинцового аккумулятора.
- •18. Устройство и принцип действия сухого марганцево-цинкового элемента.
- •19. Устройство и принцип действия щелочных аккумуляторов.
- •20. Химическая и электрохимическая коррозия металлов.
- •21. Коррозия металлов в кислой и нейтральной среде.
- •22. Коррозия технического железа.
- •23. Электрохимическая коррозия при контакте двух металлов.
- •27. Диэлектрики и полупроводники.
- •28. Полупроводники примесного типа.
- •29. Собственные полупроводники.
- •30. Закон сохранения энергии. Энтальпия системы.
- •31. Закон Гесса. Термодинамические уравнения.
- •32. Энтропия и её изменение при химических процессах.
- •33. Энергия Гиббса и энергия Гельмгольца.
- •34. Связь между различными термодинамическими функциями.
- •35. Скорость гомогенных химических реакций.
- •36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
- •37. Скорость гетерогенных химических реакций.
- •38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
- •39. Энергия активации химических реакций.
- •40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
- •41. Смещение химического равновесия. Принцип Ле-Шателье.
- •42. Зонная теория кристаллов.
- •43. Типы и свойства кристаллов.
- •44. Строение кинофотоматериалов.
- •45. Химизм основных стадий фотографического процесса.
- •46. Связь между различными термодинамическими функциями.
- •47. Структура и свойства полимеров.
- •48. Химические свойства полимеров.
- •49. Материалы на основе полимеров.
- •50. Методы получения полимеров.
12. Поляризация электродов при электролизе. Потенциал разложения.
При электролизе наблюдается поляризация электродов, что связано с замедленностью стадий электрохимического процесса. При электролизе наблюдается образование внутреннего Г. Э. если на клеммы электролизера приложить небольшое напряжение и в системе будет протекать небольшой ток, то будут протекать следующие реакции:
![]()
В результате один из электродов покроется слоем никеля, превратится в никелевый электрод. А другой адсорбирует молекулы хлора – хлорный электрод. В результате в системе возникает внутренний Г. Э., в котором напряжение тока противоположно приложенному, в результате электролиз прекратится.
![]()
Для того, чтобы электролиз протекал устойчиво необходимо приложить напряжение большее, чем ЭДС внутреннего Г. Э, - потенциал разложения.
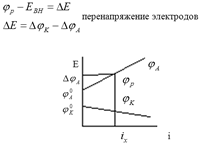
Явление перенапряжения с одной стороны нежелательное, т.к. приводит к расходу лишней энергии, а с другой стороны это явление позволяет при электролизе на катоде получать активные металлы (от алюминия до водорода) перенапряжению в большей степени подвергаются водородный и кислородный электроды, и в меньшей – металлические.
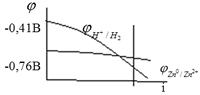
При
малой плотности тока ![]() электрода,
в результате на катоде выделяется
водород. Однако поляризация водородного
электрода значительно больше поляризации
цинкового, по этому при повышении
плотности тока оказывается, что
электрода,
в результате на катоде выделяется
водород. Однако поляризация водородного
электрода значительно больше поляризации
цинкового, по этому при повышении
плотности тока оказывается, что ![]() ,
на катоде образуется цинк.
,
на катоде образуется цинк.
Аналогично картина наблюдается и для других металлов в ряду напряжений от алюминия до водорода. При решении задач всегда учитывать перенапряжение выделения водорода на различных металлах.
13. Электролиз с растворимыми анодами.
Активным (растворимым) называется анод, материал которого может окисляться в ходе электролиза. В случае активного анода число конкурирующих окислительных процессов возрастает до трёх: электрохимическое окисление воды с выделением кислорода, разряд аниона (т.е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона. (см. табл.)

14. Электрохимическое рафинирование металлов.
Электрохимическое рафинирование металлов Брусок сплава металлов, содержащий основной металл (Сu) и примеси с большим значением φ (Au, Ag), а так же примеси с меньшим значением φ(Ni, Co) подключаются к аноду. В системе создается определенная кислотность среды и плотность тока с тем, чтобы на аноде происходило окисление основного металла и примесей, имеющих меньшее значение φ. В результате Сu, Ni, Co на аноде окисляются и переходят в раствор, а примеси с большим значением φ (Au, Ag) оседают на дне электролитической ванны в виде шлага. На катоде происходит конкуренция между ионами Cu2+, Ni2+, Co2+, но т. к. φCu<φNi, Co, то на катоде выделяется чистая медь. Рафинирование используется при отчистке следующих металлов: Ni, Cu, Ag, Co, Cd.
