
- •Ход работы:
- •Методами электролитических флотации-флокуляции-коагуляции» в общем пользовании:
- •Оборудование рабочего места:
- •Ход работы:
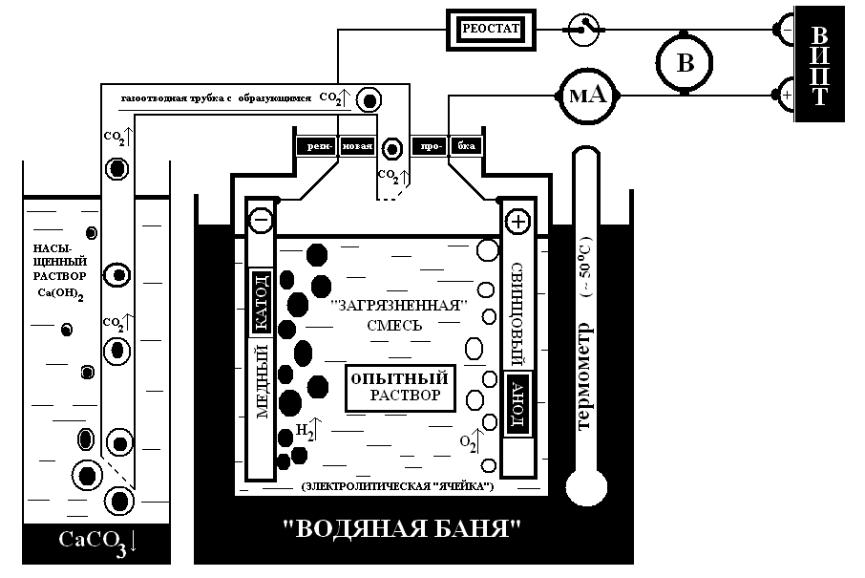
- •Лпз №3: «Электролитическое удаление н2s из газового потока методом непрямого окисления» в общем пользовании:
- •Оборудование рабочего места:
- •Полуреакции восстановления газа-«загрязнителя»:
- •Полуреакции окисления газа-«загрязнителя»:
- •Реакция клауса:
- •Ход работы:
- •Раствор иода ( i3- )снова готов к повторному окислению сульфида ( s2- ).
- •В общем пользовании:
- •Оборудование рабочего места:
- •Ход работы:
- •Ход работы:
- •Оборудование рабочего места:
- •Ход работы:
Министерство сельского хозяйства Российской Федерации
Санкт-Петербургский государственный аграрный университет
Кафедра неорганической химии
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ РЕГЕНЕРАЦИИ
ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ.
ЖУРНАЛ ЛАБОРАТОРНЫХ РАБОТ
для самостоятельной работы
студентов V курса факультета
АГРОЭКОЛОГИИ И ПОЧВОВЕДЕНИЯ
( теоретические аспекты всех ЛПЗ изучать по лекциям Д.Ю.Ступина, в методуказаниях )
Составители:
профессор Ступин Д.Ю.
доцент Зонов В.А.
завлабораторией
Ергенова З.Н.
лаборант Рудь Е.В.
Санкт-Петербург
2012
ЛПЗ №1: «НЕПРЯМОЕ ОКИСЛЕНИЕ ЗАГРЯЗНИТЕЛЕЙ»
В общем пользовании:
Закрепленная в штативе БЮРЕТКА на 25мл для смеси «МЕДИАТОРА»,
Прозрачный насыщенный раствор Ва(ОН)2,
Пипетки для растворов глицерина ( или уксусной кислоты ),
Тубус с дистиллированной водой.
Оборудование РАБОЧЕГО МЕСТА:
Внешний источник постоянного тока ( ВИПТ ) на 9В,
Прибор для проведения электрохимического эксперимента,
Миниэлектролизер 10мл,
Резиновая пробка с электродами и газоотводной трубкой,
Штатив с пробиркой и с термометром,
Химический стакан с ГОРЯЧЕЙ водой ( можно не готовить, если не используется термостат ).
УРАВНЕНИЯ РЕАКЦИЙ:
МЕДИАТОР = С:
С+ + ē - С
ЗАГРЯЗНИТЕЛЬ «водной среды» = «Red»:
«Ox+» + ē - «Red»
EoC+/C Eo«Ox+»/«Red»
С+ + «Red» C + «Ox+»
C3H8O3 + 7 Co2(SO4)3 + 3 H2O = 14 CoSO4 + 3 CO2 + 7H2SO4
Со3+ + 1 ē Со2+ EoCo3+/Co2+ = +1,81B
C3H8O3 + 3 H2O - 14 ē 3 СО2 + 14 Н+ EoCО2, Н+ / C3Н8О3, Н2О -0,2B
_____________________________________________________________________________________
C3H8O3 + 3 H2O + 14 Со3+ 3 СО2 + 14 Co2+ + 14 Н+
Наряду с «объемными» ОВ-реакциями в растворе смеси на поверхностях электродов протекают сопутствующие взаимодействия:
КАТОД: 2 H2O(ж) + 2 ē H2(г) + 2 OH-(aq)
АНОД: 2 H2O(ж) - 4 ē О2(г) + 4 H+(aq) ).
Масса объема смеси ( при плотности раствора 1г/мл ) в микроячейке «сосуда-электролизера» 10мл . 2/3 = 6,7мл 6,7г
В двух каплях «загрязнителя»-глицерина ( С3Н8О3 ) в этом «растворе» содержится его масса 1,22.10-3г,
Концентрация «загрязнителя» в водной смеси составляет:
1,22.10-3г / 6,7г = 0,182. 10-3 = 182.10-6 182ppm
Установка электрохимического окисления органического«ЗАГРЯЗНИТЕЛЯ» воды ионами Со3+.
Ход работы:
1. В стеклянный сосуд-электролизер поместить 5-6мл раствора МЕДИАТОРА =→
смесь 0,1М СoSO4 и 2M H2SO4.
2. 2 капли ВОДНО-ОРГАНИЧЕСКОЙ смеси добавить к смеси МЕДИАТОРА «1».
3. Плотно закрыть сосуд-«электролизер» резиновой пробкой со вставленными в нее газоотводной трубкой и МЕТАЛЛИЧЕСКИМИ электродами – медным и свинцовым.
4. «Спай» свинцового электрода с медным проводником НЕ ДОЛЖЕН соприкасаться с «рабочей смесью растворов» - в противном случае ВЫНУТЬ пробку и промыть водой.
5. Нагреть сложную СМЕСЬ РАСТВОРОВ сосуда-«электролизера» до 50оС в горячей воде «водяной бани» ( если она в настоящем опыте применяется! ).
6. Закрепленную в штативе пробирку на 1/3 объема заполнить прозрачным насыщенным раствором Ва(ОН)2.
7. Установить ТЕПЛЫЙ сосуд-«электролизер» в специальное ОСНОВАНИЕ « прибора » с ГАЛЬВАНОМЕТРОМ и тумблерами переключения режимов.
8. Погрузить в раствор-анализатор свободный конец газоотводной трубки.
9. При обязательно ВЫКЛЮЧЕННОМ выпрямителе, с помощью зажимов-крокодилов соединить МЕДНЫЙ электрод с ( - )-ВИПТ, второй электрод из СВИНЦОВОЙ пластинки соединить с ( + )-ВИПТ.
10. ПЕРЕКЛЮЧАТЕЛЬ «прибора» тумблером установить в режим АМПЕРМЕТРА – ( I )и повернуть его рукоятку в положение «ВЫКЛЮЧЕНО».
11. ВКЛЮЧИТЬ прибор - загорелась лампочка световой индикации.
12. Повернуть рукоятку реостата АМПЕРМЕТРА в крайнее ЛЕВОЕ положение – «выключено».
13. Плавно поворачивая рукоятку реостата АМПЕРМЕТРА вправо, увеличить СИЛУ ТОКА в «растворе» электролизера до начала выделения газов в реакционном сосуде и ПРОХОЖДЕНИЯ их пузырьков в раствор-анализатора - Ва(ОН)2, которым почти полностью заполнена пробирка.
I = А
14. Прозрачный раствор-анализатора пробирки быстро МУТНЕЕТ вследствие образования в его объеме осадка ВаСО3 по вторичной реакции:
Ва(ОН)2 + СО2 = ВаСО3 + Н2О
15. ПЕРЕКЛЮЧАТЕЛЬ «прибора» тумблером установить в режим ВОЛЬТМЕТРА: U = В
16. Через 30-40 минут органическое «ЗАГРЯЗНЕНИЕ» исходной смеси (при заметном ее разогревании!) в ходе ЭЛЕКТРОЛИЗА полностью разрушается после приобретения «раствором» СВЕТЛО-СЕРОКРАСНОГО цвета. τ(электролиза) = с
17. ВЫКЛЮЧИТЬ прибор - лампочка световой индикации погасла.
18. Вынуть резиновую пробку из сосуда-«электролизера» ( при необходимости! перелить еще ГОРЯЧУЮ окрашенную СМЕСЬ в другой стаканчик на ≈50мл ).
19. Добавить в смесь дополнительно 2 капли исходного раствора « ЗАГРЯЗНИТЕЛЯ -глицерина » - она немедленно приобретает НАЧАЛЬНЫЙ розовый цвет.
20. Добавить к осадку ВаСО3 в пробирку 5 капель разбавленной H2SO4 ( или СН3СООН ) до ВСПЕНИВАНИЯ образующегося раствора согласно реакции:
ВаСО3 + H2SO4 = ВaSO4 + H2O + CO2
Дата: Подпись студента: Подпись преподавателя:
Пример расчетов:
М(C3H8O3) = 92г/моль, Мэ(C3H8O3) = 92 / 14 = 6,57г/моль, Мэ(CO2) = 44 / 4 = 11г/моль.
I = 1,6А; U = 3,6В. (вблизи электродов образуются: H2(г) и О2(г)). τ = 33 . 60 = 1980с
Массу газообразного СО2, образуемого в ходе «непрямого» электролиза, рассчитывать по закону Фарадея так: m(CO2) = Мэ(CO2) . I . τ / 96500 = 11 . 1,6 . 1980 / 96500 = 3,6 . 10-1г
m(CO2)опытная = ( 11 / 96500 ) . . = г
V(СО2)опытная = ( 22,4 / m(CO2)опытная ) . 44 = л
1.
|
2.
|
3.
|
4.
|
5.
|
6.
|
7.
|
8.
|
ЛПЗ №2: «ОЧИЩЕНИЕ растворов с КРАСИТЕЛЕМ
