
- •Федеральное агентство по образованию
- •Пермский государственный университет химческий факультет
- •Оглавление.
- •Раздел 1. Общие методы синтеза и «именные» реакции в химии гетероциклов. 5
- •Введение.
- •Раздел 1. Общие методы синтеза и «именные» реакции в химии гетероциклов.
- •Окислительная циклизация.
- •Реакция Негиши.
- •Реакция Сузуки.
- •Реакция Стилла.
- •Реакция Стилла-Келли.
- •Реакция Кумады.
- •Реакция Хиямы.
- •Реакция Соногаширы.
- •Реакция Хека.
- •Реакции карбонилирования.
- •Образование связи углерод-фосфор.
- •Реакция Буxвальда-Хартвига. Образование связей c-n, c-o.
- •Реакция Тсуи-Троста.
- •Реакция Джефри.
- •Получение индолов по Мори-Бану, Хегедусу и Лароку.
- •Раздел 2. Палладиевый катализ в химии пирролов.
- •Раздел 3. Палладиевый катализ в химии индолов.
- •Раздел 4. Палладиевый катализ в химии пиридинов.
- •Раздел 5. Палладиевый катализ в химии тиофенов и бенз[b]тиофенов.
- •Раздел 6. Палладиевый катализ в химии фуранов и бенз[b]фуранов.
- •Раздел 7. Палладиевый катализ в химии тиазолов и бензтиазолов.
- •Раздел 8. Палладиевый катализ в химии оксазолов и бензоксазолов.
- •Раздел 9. Палладиевый катализ в химии имидазолов.
- •Раздел 10. Палладиевый катализ в химии пиразинов и хиноксалинов.
- •Раздел 11. Палладиевый катализ в химии пиримидинов.
- •Заключение и выводы.
Раздел 2. Палладиевый катализ в химии пирролов.
Производные пиррола широко представлены в природе. Они входят в состав как растений, так и живых организмов. Необычная реакционная способность в реакциях электрофильного замещения объясняет присутствие более чем в 100 встречающихся в природе галогепроизводных пиррола.

Галогенпроизводные пиррола и их свойства широко известны. Вследствие высокой реакционной способности π-избыточного гетероциклического кольца галогенирование пирролов происходит сравнительно легко в любое положения. Функциональные группы, карбонильные, кетонные и прочие, как правило не представляют препятствия для галогенирования.
Производные пиррола вступают в реакции каталитического окислительного присоединения со α-алкенилами, бензолом, 1,4-нафтохиноном, а также димеризации и внутримолекулярной циклизации.
Для производных пиррола характерны реакции с металлорганическими производными - алкилирование реакцией Кумада, арилирование по Негиши, реакции Сузуки, Стилла и Соногаширы.
Для пирролов, как и для остальных описываемых гетероциклических соединений, описано поистине огромное количество примеров реакций Хека, дающих в некоторых случаях смесь продуктов замещения.
Карбонилирование соединений монооксидом углерода, протекающее при н.у. на палладиевом катализаторе, открывает новые пути к синтезу производных пирролов. С высокими выходами удается получить сложные эфиры различных типов, а также продукты циклизации.
Каталитическое образование связей углерод-азот реакцией алкенов с азотистыми нуклеофилами позволяет непосредственно получать производные пиррола.
Раздел 3. Палладиевый катализ в химии индолов.
Индол, возможно, наиболее значимый гетероцикл в химии. Он входит в состав миллионов природных соединений, алкалоидов, медицинских препаратов и растущего числа органических полимеров. Серотонин и аминотриптофан в организмах животных и человека, и тысячи их синтезированных аналогов, также являются производными индола.

Подобно пирролу, π-избыточная гетероциклическая система энергично реагирует с галогенами и другими электрофилами в некаталитических условиях образованием галогенидов индола.
Использование каталитических окислительных взаимодействий –циклизации и сочетания – позволяют получать недоступные ранее конденсированные гетероциклические системы индола.
Структуры производных индола подвергаются модификации в условиях реакций Кумады, Негиши, Сузуки, Стилла и Соногаширы.
Взаимодействие по Хеку представляет собой мощный, универсальный инструмент для синтеза новых производных индола.
Каталитическое карбонилирование аминов и спиртов, а также внутримолекулярное аминирование алкенов приводит к образованию индолов.
Раздел 4. Палладиевый катализ в химии пиридинов.
Производные пиридина проявляют биологические и фармакологические свойства. Среди наиболее известных соединений этого типа можно выделить эпибатидин, проявляющий сильновыраженные анальгетические свойства, и никотин, известный алкалоид. Кроме того существуют тысячи искусственно синтезированных пирролов, являющихся лекарствами, гербицидами и пестицидами.
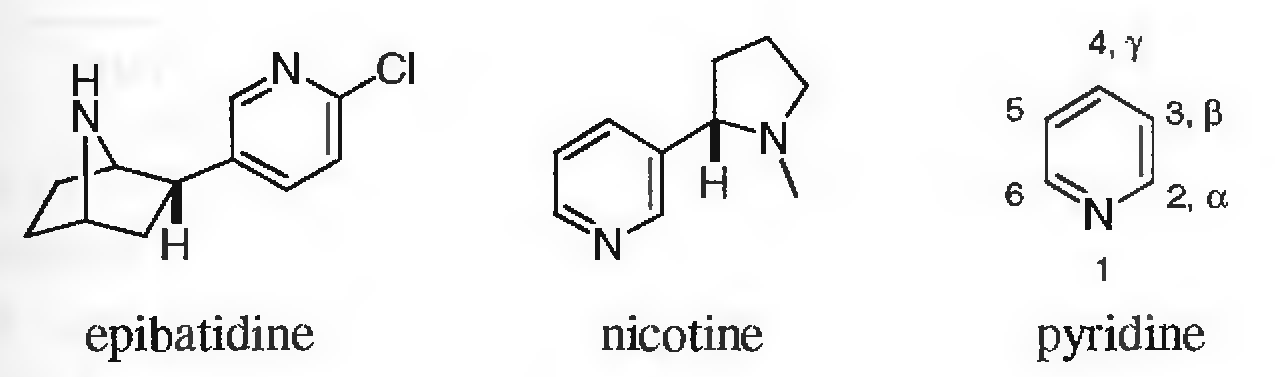
Некаталитический синтез пиридинов ведется двумя основными путями: α-металлированием π-недостаточной системы индола либо непосредственно галогенированием в подходящих условиях.
Палладий каталитические реакции удобный метод синтеза симметричных и несимметричных полициклических неконденсированных структур, содержащих индольный фрагмент.
Использование сочетания Стилла в синтезе промежуточных продуктов открывает возможность синтеза недоступных ранее природных конденсированных ароматических соединений.
Реакций Кумады, Негиши, Сузуки, Соногаширы и Хека открывают новые пути модификации и получения производных пиридина.
Карбонилирование монооксидом углерода на катализаторе удается циклизовать N-фениламинопиридины, получать сложные эфиры и сшивать пиридины с циклическими, ароматическими и алициклическими аминами.
