
- •Ю.С. Рыбаков процессы и аппараты защиты окружающей среды
- •280202 – Инженерная защита окружающей среды Екатеринбург
- •Оглавление
- •Глава 1. Научные основы технологических процессов . . . 10
- •1.2.1. Теплопроводность . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
- •1.4. Процессы разделения неоднородных и гетерогенных систем . . . . . . . . . 35
- •Глава 2. Защита атмосферного воздуха от загрязнения . . . 61
- •Глава 3. Защита водного бассейна от загрязнения . . . . . . . . . 102
- •Глава 4. Утилизация и ликвидация бытовых
- •Глава 5. Защита окружающей среды от энергетического
- •Предисловие
- •Введение
- •Глава 1. Научные основы технологических процессов
- •1.1. Основные понятия и законы природоохранных технологий
- •1.1.1. Два вида переноса вещества и энергии
- •Это уравнение будем называть материальным балансом. Из уравнения (1.1) видно, что в процессе производства происходит перенос массы из одних компонентов, входящих в аппарат, в другие.
- •1.1.2. Движущая сила технологического процесса
- •1.1.3. Закономерности переноса массы и энергии
- •1.1.4. Классификация и принципы оптимизации основных
- •Классификация основных процессов природоохранных технологий
- •1.2. Теплообменные процессы
- •1.2.1. Теплопроводность
- •1.2.2. Конвекция
- •1.2.3. Тепловое излучение
- •1.2.4. Теплоносители и их свойства
- •1.2.5. Теплоотдача при конденсации пара
- •1.2.6. Теплопередача при кипении жидкостей
- •1.2.7. Процессы выпаривания
- •1.3. Массообменные процессы
- •1.3.1. Массопередача, массоотдача и массопроводность
- •1.3.2. Абсорбция
- •1.3.3. Ректификация
- •1.3.4. Адсорбция
- •1.3.5. Ионный обмен
- •1.3.6. Экстракция
- •1.3.7. Сушка
- •1.3.8. Кристаллизация
- •1.4. Процессы разделения неоднородных и гетерогенных систем
- •1.4.1. Классификация неоднородных и гетерогенных систем
- •Классификация неоднородных и гетерогенных систем
- •1.4.2. Процессы осаждения под действием силы тяжести
- •1.4.3. Фильтрование
- •1.4.4. Коагуляция и флокуляция
- •1.4.5. Флотация
- •1.5. Химические и биохимические процессы, протекающие при очистке вод
- •1.5.1. Химические процессы
- •1.5.2. Сущность отдельных химических процессов и их роль
- •1.5.3. Биохимические процессы
- •1.6. Воздействие транспорта на окружающую среду
- •1.6.1. Влияние предприятий железнодорожного транспорта
- •1.6.2. Основные процессы, протекающие при воздействии
- •1.6.3. Характеристика топлив, используемых на объектах транспорта
- •1.6.4. Характеристика основных токсичных веществ, содержащихся
- •Глава 2. Защита атмосферного воздуха от загрязнения
- •2.1. Общие вопросы защиты атмосферы от загрязнения
- •2.1.1. Источники загрязнения атмосферы
- •2.1.2. Нормирование качества атмосферного воздуха
- •Предельно допустимые концентрации некоторых веществ в воздухе, мг/м3
- •2.1.3. Классификация источников загрязнения
- •2.2. Пассивные методы защиты атмосферы от загрязнения
- •2.2.1. Стадия проектирования предприятия
- •2.2.2. Инвентаризация и расчет предельно допустимых выбросов
- •2.2.3. Установление санитарно-защитной зоны вокруг предприятия
- •2.2.4. Расчет высоты трубы для рассеивания газовоздушных выбросов
- •2.3. Методы очистки отходящих газов от аэрозолей
- •2.3.1. Сухие пылеуловители
- •2.3.2. Мокрые пылеуловители
- •2.3.3. Электрофильтры
- •2.3.4. Фильтры
- •3.6. Туманоуловители
- •2.4. Очистка промышленных выбросов от токсичных газовых примесей
- •2.4.1. Метод абсорбции
- •2.4.2. Метод хемосорбции
- •2.4.3. Адсорбционные методы
- •2.4.4. Методы каталитической очистки газов
- •2.4.5. Метод термической очистки газов
- •2.5. Методы и устройства для очистки выхлопных газов карбюраторных и дизельных двигателей
- •2.5.1. Нейтрализаторы отработавших газов
- •2.5.2. Фильтры для улавливания дисперсных частиц
- •2.5.3. Использование новых рабочих процессов и видов энергоресурсов
- •2.5.4. Очистка отработавших газов при реостатных
- •Глава 3. Защита водного бассейна от загрязнения
- •3.1. Общие вопросы защиты водных объектов от загрязнения
- •3.1.1. Характеристика водопользования и водопотребления
- •3.1.2. Критерии качества воды
- •Критерии оценки загрязненности воды по пдк вредных веществ
- •3.1.3. Качество вод, используемых в промышленности
- •3.2. Пассивные методы защиты гидросферы от загрязнения
- •3.2.1. Особенности канализования сточных вод
- •3.2.2. Условия выпуска производственных сточных вод
- •3.2.3. Расчет предельно допустимого сброса вредных веществ
- •3.2.4. Установление водоохранных зон и прибрежных защитных полос
- •3.3. Классификация сточных вод
- •3.3.1. Классификация по принципу допустимости
- •3.3.2. Классификация сточных вод по дисперсному составу примесей
- •3.3.3. Классификация сточных вод в зависимости
- •4. Механические (физические) методы очистки сточных вод
- •3.4.1. Процеживание и отстаивание примесей
- •4.2. Осветление сточных вод, улавливание жиров и нефтепродуктов
- •4.3. Фильтрование
- •4.4. Гидроциклонирование
- •3.5. Химические, физико-химические и биологические методы очистки и обезвреживания сточных вод
- •3.5.1. Химическая очистка сточных вод
- •3.5.2. Физико-химические методы очистки
- •3.5.3. Методы биологической очистки сточных вод
- •3.5.4. Методы биологической очистки сточных вод
- •3.5.5. Доочистка сточных вод
- •Глава 4. Утилизация и ликвидация твердых отходов
- •4.1. Опасность отходов для окружающей природной среды
- •4.1.1. Источники возникновения твердых отходов
- •4.1.2. Классификация отходов
- •4.1.3. Нормирование допустимого количества отходов
- •Классификация опасности отходов производства
- •4.2. Основные технологические принципы утилизации, обезвреживания и захоронения отходов
- •2.1. Размещение отходов
- •4.2.2. Переработка отходов на месте складирования
- •4.2.3. Переработка отходов пластических масс
- •4.2.4. Сжигание отходов
- •4.2.5. Обезвреживание и захоронение радиоактивных отходов
- •4.3. Утилизация и ликвидация осадков сточных вод
- •4.3.1. Технологический цикл обработки осадков сточных вод
- •4.3.2. Уплотнение, стабилизация и кондиционирование осадков
- •4.3.3. Обезвоживание и ликвидация осадков сточных вод
- •Глава 5. Защита окружающей среды от энергетического воздействия
- •5.1. Защита окружающей среды от шума и вибраций
- •5.1.1. Шум и его характеристики
- •5.1.2. Нормирование шума
- •5.1.3. Расчет шумовых характеристик
- •5.1.4. Меры борьбы с шумовым загрязнением
- •5.2. Защита от электромагнитного загрязнения
- •5.2.1. Электромагнитное загрязнение среды и его источники
- •5.2.2. Предельно допустимые уровни электромагнитных полей
- •5.2.3. Защита от электромагнитных полей
- •Заключение
- •Библиографический список
- •620034, Екатеринбург, ул. Колмогорова, 66 УрГупс
- •Ю.С. Рыбаков
- •Процессы и аппараты защиты
- •Окружающей среды
- •Екатеринбург
1.3. Массообменные процессы
1.3.1. Массопередача, массоотдача и массопроводность
Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы), называются массообменными. К массообменным процессам относятся: абсорбция, адсорбция, ионный обмен, перегонка и ректификация, растворение и кристаллизиция, сушка, экстрагирование и экстракция, мембранные процессы [1].
Движущей силой массообменных процессов является разность концентраций. В результате растворения вещества в воде оно переходит из твердой фазы в жидкую. При очистке жидкостей или газов с помощью активированного угля вещество переводится из жидкой или газовой фазы в твердую. Разбавление растворов приводит к переходу вещества из одной жидкой фазы в другую.
Массообменные процессы принято классифицировать по агрегатному состоянию и характеру взаимодействия фаз. Переход вещества из одной фазы в другую в направлении достижения равновесия называется массопередачей. Значит, в основе представлений о массопередаче лежит понятие равновесия фаз. Массоперенос начинается, если концентрация вещества во взаимодействующих фазах отличается от равновесной. Достижение равновесия системы подчиняется принципу Ле-Шателье: реакция системы против внешнего воздействия направлена на уменьшение этого воздействия. При этом скорость перехода распределяемого вещества из одной фазы в другую пропорциональна разности между его фактической концентрацией в данной фазе и равновесной концентрацией. Это и есть истинная движущая сила этого процесса.
Состояние равновесия подчиняется правилу фаз Гиббса, которое гласит: для равновесной термодинамической системы, на которую из внешних факторов действуют только температура и давление, число степеней свободы С равно числу компонентов К минус число фаз Ф плюс два:
С = К – Ф + 2. (1.28)
Число степеней свободы – это число независимых переменных (температура, давление и концентрация вещества в фазах). Если однокомпонентная система состоит из двух фаз, находящихся в равновесии, число степеней свободы в этом случае равно 1. Это значит, что для нее произвольно выбирать можно только один параметр, с помощью которого эту систему можно будет вывести из равновесия и начать технологический процесс. Например, для однокомпонентной системы вода-пар от изменения давления изменяются температура смеси и количество воды, обращенной в пар.
Основной закон массопередачи формулируется исходя из общих кинетических закономерностей физико-химических процессов: скорость процесса прямо пропорциональна движущей силе и обратно пропорциональна сопротивлению:
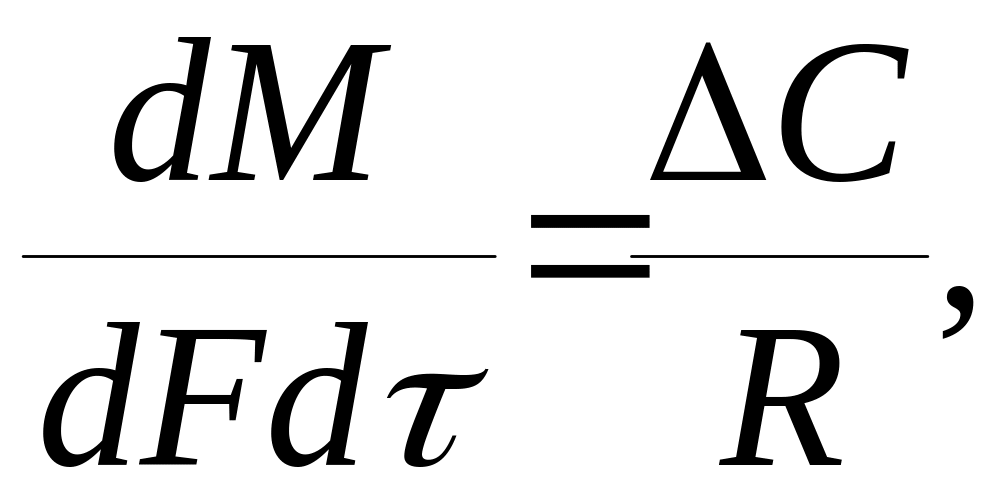 (1.29)
(1.29)
где dM – количество вещества, перешедшего из одной фазы в другую,
dF – площадь поверхности фазового контакта;
dτ – продолжительность процесса массопередачи;
ΔC – движущая сила массообменного процесса;
R – сопротивление массопереносу.
Заменив сопротивление R в уравнении (1.29) на коэффициент массопередачи kм = 1/R и проинтегрировав его по времени, получим для установившихся процессов основное уравнение массопередачи:
М = kм ΔC F. (1.30)
В процессах переноса распределяемого вещества из одной фазы в другую следует различать два случая: перенос из потока жидкости в поток жидкости; перенос из твердого тела в поток жидкости или в обратном направлении. Этот перенос подчиняется законам молекулярной диффузии, массоотдачи и массопроводности [1].
Закон молекулярной диффузии (первый закон Фика). Молекулярная диффузия в газах и растворах жидкостей происходит в результате хаотического движения молекул, не связанного с движением потока жидкости. Благодаря этому осуществляется перенос вещества из области с высокой концентрацией в область с низкой концентрацией, который подчиняется первому закону Фика: количество диффундирующего вещества пропорционально градиенту концентрации, площади, перпендикулярной к направлению диффузного потока, через которую осуществляется перенос, и времени:
 (1.31)
(1.31)
где D – коэффициент диффузии; ðC/ðx – градиент концентрации в направлении диффузии; dF – площадь поверхности, через которую диффундирует вещество; dτ – продолжительность диффузии.
Коэффициент диффузии показывает, какое количество вещества переходит через поверхность равную 1 м2 за 1 с при разности концентраций на расстоянии 1 м, равной единице.
Знак минус в уравнении (1.31) показывает, что перенос вещества осуществляется навстречу градиенту концентраций. Размерность коэффициента диффузии зависит от размерности концентрации, но в системе СИ она имеет следующий вид [м2/с]. Эти коэффициенты измеряются опытным путем, и для большинства веществ эти данные приводятся в справочной литературе.
Заметим, что первый закон Фика является аналогом закона теплопроводности Фурье, а явления переноса теплоты и массы во многом схожи. Это обстоятельство и аналогичность в описании других законов тепло- и массопереноса используются при расчетах массопередачи.
Второй закон Фика – дифференциальное уравнение молекулярной диффузии. Аналогично дифференциальному уравнению теплопроводности Фурье дифференциальное уравнение молекулярной диффузии имеет следующий вид:
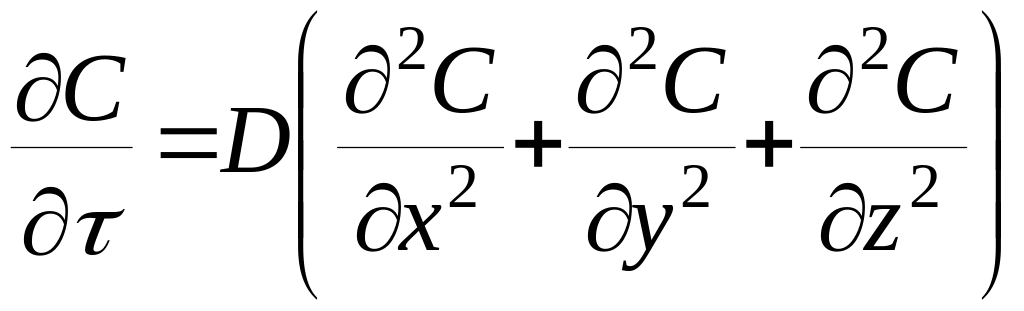 или
или
 (1.32)
(1.32)
Закон массоотдачи Щукарева. Этот закон является аналогом закона теплоотдачи (закона охлаждения) твердого тела Ньютона. Он был сформулирован русским ученым А.Н.Щукаревым при изучении кинетики растворения твердых тел: количество вещества, переносимого из одной фазы в другую, пропорционально разности концентраций у поверхности раздела фаз и в ядре потока воспринимающей фазы, площади поверхности фазового контакта и времени:
dM= β (Cr – Сf) dFdτ, (1.33)
где Cr и Сf – концентрации вещества у поверхности раздела и в ядре потока воспринимающей фазы;
β – коэффициент массоотдачи, имеющий размерность м/с.
Коэффициент массоотдачи показывает, какое количества вещества переносится из одной фазы в другую через 1 м2 поверхности фазового контакта за 1 с, если разность концентраций на границе раздела фаз и в ядре потока равна единице.
Для установившихся процессов и неизменности коэффициента теплоотдачи закон Щукарева принимает форму
M= β (Cr – Сf) F. (1.34)
Закон массопроводности. Массопередача в системе с твердой фазой представляет особо сложный процесс, в котором, кроме массопередачи от поверхности раздела фаз в поток жидкости, имеет место и перемещение вещества в твердой фазе – массопроводность. К указанным процессам можно отнести процессы адсорбции, сушки и выщелачивания (извлечение вещества растворителем из пор твердого тела). Закон массопроводности заключается в следующем: количество вещества, переместившегося в твердой фазе за счет массопроводности, пропорционально градиенту концентраций, площади перпендикулярной направлению потока вещества, и времени:
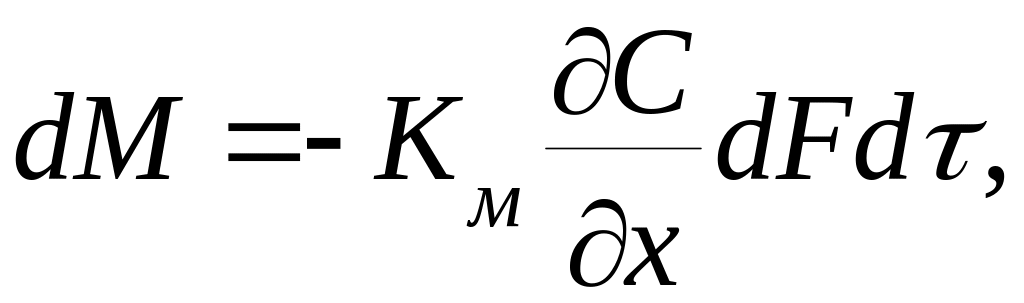 (1.35)
(1.35)
где Км – коэффициент массопроводности, по другому называемый коэффициентом «стесненной» диффузии, который можно определить по формуле Кади и Виьямса
 (1.36)
(1.36)
где D – коэффициент молекулярной диффузии,
r – размер диффундирующих молекул;
R – поперечный размер пор твердого тела;
m – числовой коэффициент.
