
- •Література
- •1. Теорія горіння газових сумішей. Визначення основних понять
- •Концентраційні межі поширення полум’я. Оцінка ступеню пожежо- та вибухонебезпечності парогазових систем
- •3. Механізм горіння деревини і пластмас
- •4. Поширення полум’я по поверхні твердих матеріалів. Вигоряння твердого матеріалу
- •Запитання для закріплення матеріалу.
Тема лекції 5 (заняття № 1.9):
Розділ 1. Математична теорія виникнення і розвитку горіння та вибуху
Тема: Теорії дефлаграційного та детонаційного поширення полум’я
Лекцію розробив професор Єлагін Георгій Іванович
План лекції
Теорія горіння газових сумішей. Визначення основних понять
Концентраційні межі поширення полум’я.
Оцінка ступеню пожежо- та вибухонебезпечності
парогазових систем
3. Механізм горіння деревини і пластмас
4. Поширення полум’я по поверхні твердих матеріалів. Вигоряння твердого матеріалу
Література
Єлагін Г.І., Шкарабура М.Г., Кришталь М.А., Тищенко О.М. Основи теорії розвитку і припинення горіння. - Черкаси: ЧІПБ, 2001. – 448 с.
Демидов П.Г., Шандыба В.А., Щеглов П.П. Горение и свойства горючих веществ, ст. 42 - 68. ст. 225 - 238.
Абдурагимов И.М., Андросов А.С., Исаева Л.К., Крылов Е.В. Процессы горения, ст. 120 - 144. 164 - 194.
Специальная химия. Задания и методические указания, cт. 36 - 45. 56 - 61.
Пожаро-взрывоопасность веществ и материалов. Справочник. 1990 г., ст. 28 - 33, 56 - 63, 79 - 84.
Монахов В.Т. Методы исследования пожарной опасности веществ, cт. 89 - 105, 118 - 125, 210 – 213, 253-259, 307-310.
1. Теорія горіння газових сумішей. Визначення основних понять
В залежності від динаміки горіння теорія поділяє його на дефлаграцiйне i детонаційне.
В свою чергу, в дефлаграцiйному горінні розрізняють кінетичне i дифузійне.
Кінетичне горіння являє собою взаємодію попередньо перемішаних кількостей горючого матеріалу i окислювача.
Теорія доводить, що навіть кінетичне горіння, не говорячи вже про дифузійне, - явище не миттєве.
На межі суміші, що вже горить, і рештою середовища виникає фронт полум'я. Фронт - це вузенька смуга, що світиться і відокремлює вихідну суміш від продуктів горіння.
Саме у цій смузі, у цьому шарі і починається i завершується хімічна реакція взаємодії горючої речовини з окисником. Тут виділяється уся потенційна енергія, хімічна енергія. Виділяється вона в-основному у вигляді тепла, тому температура тут піднімається до максимального значення - температури горіння. По горючій суміші полум'я поширюється у бік свіжих компонентів.
Полум'я має вигляд сфери. Товщина зони полум'я як правило не перевищує часток міліметру.
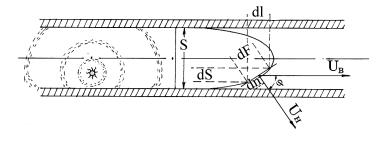
При виникненні полум'я в якійсь точці далі воно поширюється сферично. Прискорення йде до того моменту, поки полум'я не торкнеться стінок труби. Біля стінки поширення гальмується, полум'я все більше витягується в довжину і просувається по трубі з певною швидкістю.
Розрізняють нормальну, видиму i масову швидкість горіння.
Нормальна, або фундаментальна, швидкість - це швидкість поширення фронту полум'я відносно свіжої суміші в напрямку по нормалі до поверхні фронту. Оцей перпендикуляр до дотичної поверхні фронту (Uн).
Видима швидкість - це швидкість переміщення фронту полум'я відносно стінок труби (Uв).
Масова швидкість - це кількість речовини, що прореагувала в одиницю часу на одиниці поверхні фронту полум'я (Uм).
![]()
![]()
![]()
![]()
![]() -
питома маса суміші при початкових
умовах.
-
питома маса суміші при початкових
умовах.
Нормальна і видима швидкість пов’язані між собою співвідношенням, що називається законом косинусу:
![]()
![]() -
кут між векторами видимої і нормальної
швидкості.
-
кут між векторами видимої і нормальної
швидкості.
Існують дві теорії, які пояснюють природу поширення полум'я по горючій суміші: дифузійна i теплова.
Згідно з першою з них, переміщення зони хімічної реакції в просторі пов'язано з дифузією активних частинок – радикалів.
Згідно з тепловою теорією, головним є розігрів передфронтової смуги свіжої суміші за рахунок теплопровідності, потоку тепла.
Розігріваючись до температури самоспалахування, суміш займається i розігріває наступні передфронтовi смуги.
В дійсності важливі обидва механізми: i теплопотiк і ланцюгова реакція, започаткована активними частинками - вільними радикалами; але як теорія більше розроблена теплова.
Теплова теорія доводить, що швидкість поширення полум'я залежить від тих самих факторів, що і швидкість будь-якої хімічної реакції: від температури, енергії активації і концентрації реагуючих речовин.
Якщо температура збільшується, то збільшуються і швидкість реакції горіння і швидкість поширення полум’я. Щоб зменшити швидкість поширення полум’я (uн), достатньо зменшити початкову температуру горючої суміші.
Із залежністю від температури пов’язана залежність від діаметру труби. Біля стінки суміш охолоджується: температура знижується і швидкість падає. При зменшенні діаметру труби швидкість поширення полум’я знижується. Для кожної суміші існує діаметр, при якому полум’я вже не поширюється. Такий діаметр називають критичним гасильним діаметром.
