
Предмет “Теоретичні основи пожежовибухонебезпечності”
(цикл магістерський)
Лекція № 4
Розділ 1. Математична теорія виникнення і розвитку горіння та вибуху
Тема лекції 4 (заняття № 1.7):
Умови ініціювання теплового та ланцюгового вибуху
Лекцію розробив професор Єлагін Георгій Іванович
Література:
-
Єлагін Г. І., Шкарабура М. Г., Кришталь М. А., Тищенко О. М. Основи теорії розвитку і припинення горіння, ч. I. – Черкаси: ЧІПБ, 2005. – 276 с.
-
Єлагін Г. І., Шкарабура М. Г., Тищенко О. М. Методичні вказівки до виконання контрольних робіт з дисциплін «Теорія розвитку і припинення горіння» та «Теоретичні основи пожежовибухонебезпечності» для слухачів заочної форми навчання. – – Черкаси: ЧІПБ, 2006. – 63 с.
-
Демидов П.Г., Шандыба В.А., Щеглов П.П. Горение и свойства горючих веществ.
-
Кінетика хімічних реакцій
-
Теплова теорія самоспалахування
3. Самонагрівання, самозаймання і
температура самонагрівання
4. Примусове спалахування. Джерела запалювання
1. Кінетика хімічних реакцій
Швидкість хімічної реакції вивчає хімічна кінетика.
Відносять швидкість реакції до молю реагуючих речовин.
Швидкість будь-якої хімічної реакції вимірюють зміною концентрації в часі.
Швидкістю гомогенної реакції називається кількість речовини, що вступає в реакцію, або речовини, що утворюється внаслідок реакції, за одиницю часу в одиниці об'єму системи.
Швидкістю гетерогенної реакції називається кількість речовини, що вступає в реакцію, або речовини, що утворюється внаслідок реакції, за одиницю часу, на одиниці площі поверхні розділу фаз.
Швидкість реакції залежить від природи речовин, їх концентрації і від температури.
Реакція відбувається, якщо в результаті її виділяється енергія; якщо енергія, що вивільнюється при утворенні нових зв’язків, більша за ту, що поглинається для розриву старих.
Реакції, що вимагають для свого здійснення великих енергій активації, більших 120 кДж/моль, при звичайних умовах ідуть дуже повільно; роками або й десятиріччями.
Реакції, енергія активації яких дуже мала, менша 40 кДж/моль, протікають практично миттєво.
Реакції горіння мають ЕА = 60-80 кДж/моль.
Обумовлюється енергія активації природою речовини.
Залежність швидкості реакції від концентрації реагуючих речовин підкоряється закону діючих мас:
При постійній температурі швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин.
A + B = L + M,
в концентраціях відповідно А та В , то
v = k [А] [В] , де
v - швидкість реакції;
k - коефіцієнт пропорційності, що називається
константою швидкості реакції, він відображає
вплив природи речовини i температури реакції.
mA + nB = C v = k [А]m [В]n .
Зміна температури викликає адекватну зміну константи швидкості реакції. За рівнянням Аренiуса
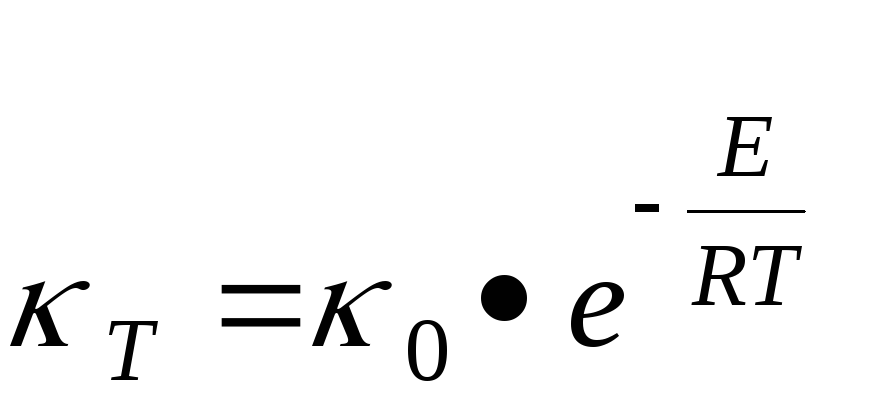 , де
, де
k0 - це константа швидкості реакції при початковій температурі;
kТ - константа швидкості реакції при даній температурі;
E - енергія активації;
е - основа натурального логарифму;
R - універсальна газова стала;
T - температура за шкалою Кельвіна.
Повне рівняння швидкості хімічної реакції:
![]()
Каталізатором називається речовина, що змінює швидкість хімічної реакції, але в результаті реакції залишається без змін.
В ланцюгових реакціях швидкість з часом збільшується, не зважаючи на зменшення концентрацій вихідних речовин. Продовжується ланцюг до того часу, поки не обірветься. Обривається ланцюг найчастіше внаслідок зустрічі двох активних радикалів, або внаслідок зустрічі з інгібітором. Інгібітор - це молекула, яка дає вільний радикал, але не такий активний, щоб розвивати ланцюг.
Висновок з питання 1.
Швидкість хімічних реакцій вивчає хімічна кінетика, яка визначає залежність зміни концентрації речовини в часі від природи речовини, початкової концентрації і температури. В ланцюгових реакціях, до яких відноситься реакція горіння, швидкість реакції з часом збільшується, не зважаючи на зменшення концентрації.
