
- •1. Предмет, задачи и основные понятия химической кинетики: система, фаза, процесс, механизм реакции, скорость реакции, средняя и истинная скорость химической реакции.
- •4. Влияние температуры на скорость процессов. Правило Вант-Гоффа. Температурный коэффициент реакции (γ). Уравнение Аррениуса.
- •5. Энергия активации процесса. Уравнение Аррениуса. Анализ уравнения Аррениуса.
- •6. Энергетические диаграммы реакций, активированный комплекс. Влияние катализаторов на скорость химических реакций.
- •9. Кинетическое условие наступления равновесия в системе, условия его сохранения и смещения. Принцип Ле-Шателье.
- •Реакции. Обосновать на конкретных примерах с использованием здм.
- •12. Основные понятия и определения химической термодинамики (термодинамические системы, параметры, функции).
4. Влияние температуры на скорость процессов. Правило Вант-Гоффа. Температурный коэффициент реакции (γ). Уравнение Аррениуса.
Увеличение скорости химической реакции с повышением температуры связано с возрастанием числа молекул, обладающих избыточной энергией. Для того, чтобы произошла реакция, т.е. чтобы образовались новые молекулы необходимо вначале разорвать или ослабить связи между атомами исходных веществ. На это необходимо затратить определенную энергию. Если сталкивающиеся частицы будут обладать такой энергией, что столкновение их может привести к перестройке атомов и к образованию молекул нового вещества. Зависимость скорости физико-химического процесса от температуры приближенно выражается правилом Вант-Гоффа: при увеличении температуры на каждые 10°С скорость химической реакции возрастает примерно в 2 – 4 раза. Математически эта зависимость выражается соотношением:
![]() Темп. коэфф.
ɣ показывает, во сколько раз возр.
скорость реакции при пов. темп. на 10 С
(физич. смысл). Зависит от прир. вещ-в и
присутствия катализатора.
Темп. коэфф.
ɣ показывает, во сколько раз возр.
скорость реакции при пов. темп. на 10 С
(физич. смысл). Зависит от прир. вещ-в и
присутствия катализатора.
Точная
зависимость скорости реакции от
температуры задается ур-нием Аррениуса:

где k — константа скорости;
Еa — энергия активации, кДж/моль;
R — универсальная газовая постоянная, 8,314 Дж/моль⋅ К;
Т — абсолютная температура, К;
е — основание натурального логарифма;
А — предэкспоненциальный множитель (постоянная величина для данной реакции).
5. Энергия активации процесса. Уравнение Аррениуса. Анализ уравнения Аррениуса.
Избыточная
энергия, которой должны обладать
молекулы, чтобы столкновение было
эффективным, называется энергией
активации (Ea),
а частицы, обладающей такой энергией,
называются активными. С повышением
температуры по
экспоненциальному закону возрастает
доля активных частиц
(![]() ).
Числовое
значение множителя
определяет отношение фактической
скорости реакции при заданной темп. и
ед. конц. к макс. возможной (физический
смысл). Чем больше Ea,
тем меньше скорость реакции, но при
этом, с увеличением T,
в большей степени возрастает скорость
тех реакций, Ea
которых больше. Величина Ea
определяет высоту энергетического
барьера реакции, а ее уменьшение с
помощью катализатора является одним
из способов увеличения скорости реакции.
).
Числовое
значение множителя
определяет отношение фактической
скорости реакции при заданной темп. и
ед. конц. к макс. возможной (физический
смысл). Чем больше Ea,
тем меньше скорость реакции, но при
этом, с увеличением T,
в большей степени возрастает скорость
тех реакций, Ea
которых больше. Величина Ea
определяет высоту энергетического
барьера реакции, а ее уменьшение с
помощью катализатора является одним
из способов увеличения скорости реакции.
Ур-ние Аррениуса позволяет рассчитать:
как изменится v реакции при известном ΔT и Ea;
Ea, зная v и ΔT;
6. Энергетические диаграммы реакций, активированный комплекс. Влияние катализаторов на скорость химических реакций.
Величина Ea определяет высоту энергетического барьера реакции. Преодоление этого барьера частицами исходных вещ-в связано с образованием акт. комплекса. Акт. комп. – группа взаимод. ч-ц в момент соударения: старые связи ослабли, а новые еще не образовались. Эн. диагр. реакции – опис. хода реакции через изменение эн-гии исх. вещ-в. На рис. эн. диагр. экзотерм. реакции:
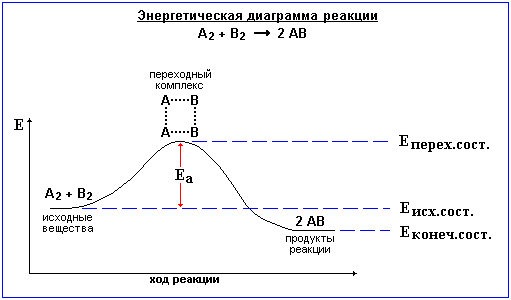
![]()
Катализаторы — вещества, которые, участвуя в реакции и влияя на её скорость, сами к концу её остаются химически неизменными. Могут как ускорять, так и замедлять реакцию (ингибиторы). Введение в систему катализатора разбивает процесс на несколько промежуточных стадий, Ea которых меньше, чем Ea всего процесса.



7. Обратимые процессы. Химическое равновесие (кинетическое условие равновесия и факторы, влияющие на его состояние). Вывод константы равновесия.
О![]() братимые
процессы
– процессы, протекающие при данных
условиях одновременно в двух противоположных
направлениях, при этом ни одно из
реагирующих вещ-в не расходуется
полностью. В закрытых системах при
T=p=const
обратимые реакции протекают до состояния
равновесия. Хим.
равновесие
– состояние обр. процесса, при котором
vпр=vобр.
Х.Р. нарушается при изменении p,
T,
C.
Вывод KC:
братимые
процессы
– процессы, протекающие при данных
условиях одновременно в двух противоположных
направлениях, при этом ни одно из
реагирующих вещ-в не расходуется
полностью. В закрытых системах при
T=p=const
обратимые реакции протекают до состояния
равновесия. Хим.
равновесие
– состояние обр. процесса, при котором
vпр=vобр.
Х.Р. нарушается при изменении p,
T,
C.
Вывод KC:
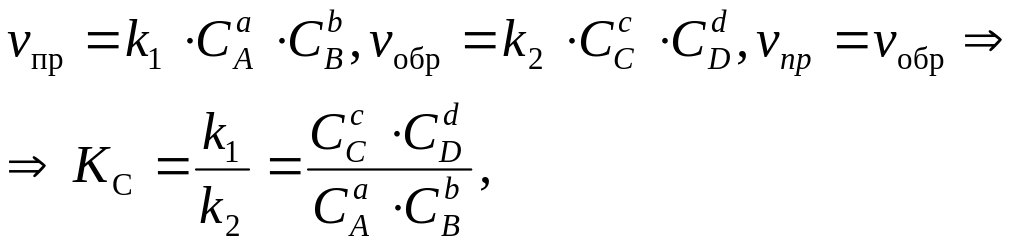
где - равновесная концентрация вещ-ва, моль/л.
8. Константа химического равновесия (КC и КP , их взаимосвязь). Физический смысл. Факторы, влияющие на численное значение. Зависимость КC и КP от температуры.
Для газообразных систем вместо концентраций можно использовать равновесные парциальные давления газов:
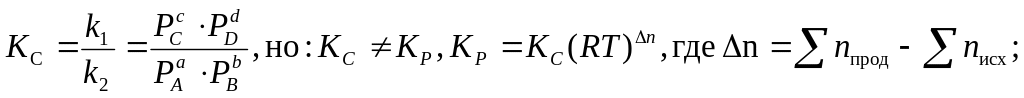
Физический
смысл КC
(КP
) : константа равновесия определяет
предел (глубину) протекания процесса
в выбранном направлении, показывая,
какие вещества (исходные или продукты
реакции) преобладают в равновесной
системе. Если К>1, равновесие смещено
вправо, т. е. в равновесной системе
преобладают продукты реакции, и наоборот,
при К<1 — равновесие смещено влево,
преобладают исходные вещества. Численное
значение КC
(КP
) зависит от природы реагирующих
веществ, температуры и не зависит от
концентраций (парциальных давлений) и
присутствия катализатора. Зависимость
константы равновесия от температуры
выражается уравнением изобары (для Р,
Т = const):
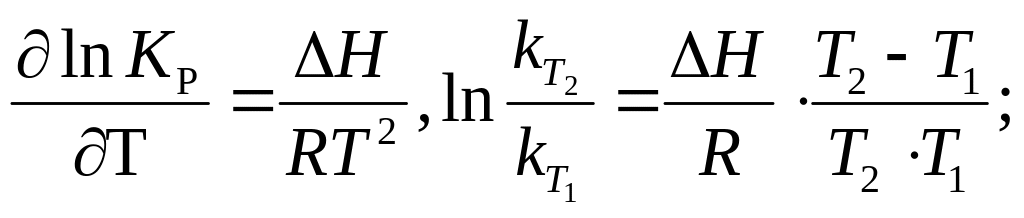
С повышением температуры константа равновесия увеличивается в эндотермических реакциях и уменьшается в экзотермических реакциях.
