
Тема 1. Основы химической термодинамики.
Первый закон термодинамики. Термохимия.
Теоретический минимум, необходимый для решения задачи №1:
Основные понятия химической термодинамики, функции состояния и функции процесса.
Первый закон термодинамики. Внутренняя энергия, теплота и работа. Виды работы.
Теплота и работа в различных процессах. Энтальпия.
Тепловой эффект химической реакции. Закон Гесса и следствия из него. Стандартные состояния и стандартные величины.
Первый закон термодинамики – по сути закон сохранения энергии, согласно которому внутренняя энергия изолированной системы постоянна. В неизолированной системе энергия может изменяться за счет теплообмена с окружающей средой и совершения работы.
Математическая запись первого начала термодинамики:
dU = δQ – δA (дифференциальная форма),
∆U = Q – A (интегральная форма).
Из первого закона термодинамики следует, что при постоянном объеме теплота равна изменению внутренней энергии:
δQV = dU, QV = ∆U,
а при постоянном давлении – изменению энтальпии:
δQP = dH, QP = ∆H.
Под тепловым эффектом реакции понимают, соответственно, величину ∆H или ∆U в зависимости от условий протекания процесса.
Для реакций в растворах или в твердой фазе, где изменение объема незначительно принимают, что:
∆H = ∆U + ∆ (pV) ≈ ∆U.
Если в изотермической реакции участвуют газы:
∆H = ∆U + ∆ (pV) = ∆U + ∆nRT, где ∆n – изменение числа моль газообразных веществ в реакции.
Например, для химической реакции νAA + νBB =νCC + νDD, протекающей в газовой фазе:
∆n = νC + νD – (νA + νB).
Тепловой эффект реакции рассчитывают по следствию из закона Гесса как разность стандартных энтальпий образования реагентов и продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции:
![]()
Для рассматриваемой реакции:
![]() .
.
ЗАДАЧА № 1
Вычислите тепловой эффект реакции А при 298 К: а) в изобарном процессе, б) в изохорном процессе. Энтальпии образования веществ при стандартных условиях возьмите из справочника /1, табл. 44/.
Таблица 1
№ в-та |
Реакция А |
№ в-та |
Реакция А |
1 |
2 H2 + CO = CH3OH (ж) |
14 |
SO2 + Cl2 = SO2Cl2 |
2 |
4HCl + O2 = 2H2O (ж) + 2Cl2 |
15 |
CO + 3H2 = CH4 + H2O (ж) |
3 |
ß-NH4Cl (тв) = NH3 + HCl |
16 |
2CO + SO2 = Sромб + 2 CO2 |
4 |
2N2 +6 H2O (ж) = 4NH3 + 3O2 |
17 |
CO + Cl2 = COCl2 |
5 |
4NO + 6H2O (ж) = 4NH3 + 5O2 |
18 |
CO2 + H2 = CO + H2O (ж) |
6 |
2NO2 = 2NO + O2 |
19 |
CO2 + 4H2 = CH4 + 2 H2O (ж) |
7 |
N2O4 = 2NO2 |
20 |
2CO2 = 2CO + O2 |
8 |
Mg(OH)2 = MgO + H2O (газ) |
21 |
CH4 + CO2 = 2CO + 2H2 |
9 |
CaCO3 = CaO + CO2 |
22 |
C2H6 = C2H4 + H2 |
10 |
Ca(OH)2 = CaO + H2O (газ) |
23 |
C2H5OH (ж) = C2H4 + H2O (ж) |
11 |
Sромб + 2 H2O (ж) = SO2 + H2 |
24 |
C2H3OН(ж)+H2 = C2H5OH (ж) |
12 |
Sромб + 2 CO2 = SO2 + 2CO |
25 |
C6H6 (ж) + 3H2 = C6H12 |
13 |
2SO2 + O2 = 2SO3 |
|
|
Теоретический минимум, необходимый для решения задачи № 2:
Теплоемкость (истинная и средняя, изобарная и изохорная), ее зависимость от температуры.
Зависимость тепловых эффектов реакций от температуры. Уравнение Кирхгофа, способы его интегрирования.
Большинство термохимических данных в справочной литературе приведено при стандартной температуре 298 К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
![]() (дифференциальная
форма),
(дифференциальная
форма),
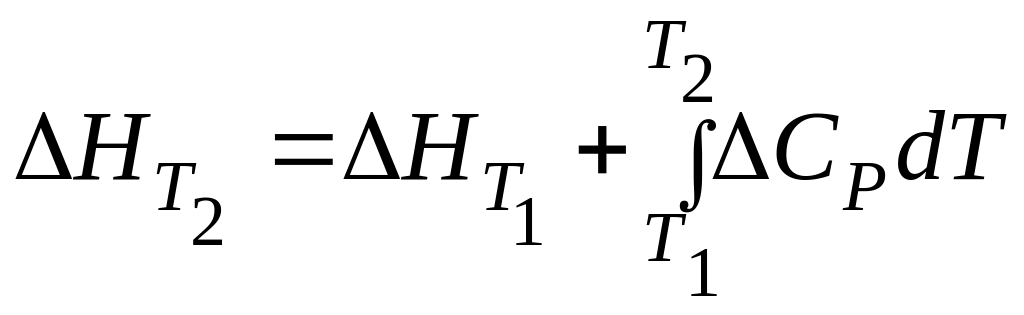 (интегральная
форма),
(интегральная
форма),
где ∆СР – изменение теплоемкости при протекании реакции.
Интегрирование проводят в интервале температур от 298 К до Т, при которой протекает реакция. Если разность (Т-298) невелика, то можно принять ∆СР = const:
![]() .
.
В этом случае величина ∆СР может быть рассчитана как разность изобарных теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических множителей при 298 К:
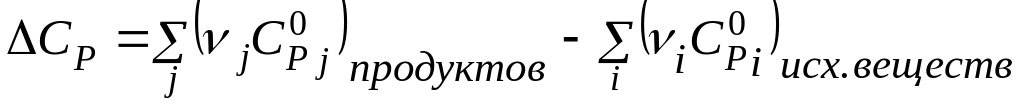
В случае значительной разности температур при интегрировании необходимо учитывать температурную зависимость теплоемкости ∆CP = f(T), для чего используют интерполяционные уравнения:
∆CP = ∆a + ∆bT + ∆cT2 + ∆cT–2, (1)
где эмпирические коэффициенты a, b, c, c для индивидуальных веществ приведены в справочниках /1, табл. 44/, а знак ∆ обозначает разность между продуктами и исходными веществами (с учетом стехиометрических коэффициентов в уравнении реакции).
В результате интегрирования получим уравнение:
![]() .
(2)
.
(2)
Или с учетом теплового эффекта при абсолютном нуле температуры:
![]() ,
(3)
,
(3)
где величина
![]() рассчитывается
следующим образом:
рассчитывается
следующим образом:
![]() .
(4)
.
(4)
ЗАДАЧА № 2
Выведите аналитическую
зависимость теплового эффекта
![]() реакции
А от температуры, если известен тепловой
эффект этой реакции при 298 К. Уравнения
зависимости
реакции
А от температуры, если известен тепловой
эффект этой реакции при 298 К. Уравнения
зависимости
![]() возьмите из справочника /1, табл. 44/.
Вычислите тепловой эффект реакции в
интервале температур от 298 К до Т.
Определите графически
возьмите из справочника /1, табл. 44/.
Вычислите тепловой эффект реакции в
интервале температур от 298 К до Т.
Определите графически
![]() при
температуре Т1. Рассчитайте
при
температуре Т1. Рассчитайте
![]() реакции А при этой температуре.
реакции А при этой температуре.
Постройте графики
зависимостей
![]() ,
,
![]() и
и
![]() в том интервале температур, для которого
справедливо выведенное уравнение
зависимости
.
Определите графически
в том интервале температур, для которого
справедливо выведенное уравнение
зависимости
.
Определите графически
![]() реакции А при температуре Т1.
реакции А при температуре Т1.
Таблица 2
№ вар-та |
Реакция А |
Т, К |
Т1, К |
1 |
2 H2 + CO = CH3OH (газ) |
800 |
350 |
2 |
4HCl + O2 = 2H2O (газ) + 2Cl2 |
750 |
650 |
3 |
ß-NH4Cl = NH3 + HCl |
455 |
450 |
4 |
2N2 +6 H2O (газ) = 4NH3 + 3O2 |
1300 |
1000 |
5 |
4NO + 6H2O (газ) = 4NH3 + 5O2 |
1000 |
900 |
6 |
2NO2 = 2NO + O2 |
700 |
500 |
7 |
N2O4 = 2NO2 |
400 |
350 |
8 |
Mg(OH)2 = MgO + H2O (газ) |
500 |
350 |
9 |
CaCO3 = CaO + CO2 |
1000 |
700 |
10 |
Ca(OH)2 = CaO + H2O (газ) |
500 |
340 |
11 |
1/2S2 (газ) + 2 H2O (газ) = SO2 + H2 |
1000 |
900 |
12 |
1/2S2 (газ) + 2 CO2 = SO2 + 2CO |
900 |
850 |
13 |
2SO2 + O2 = 2SO3 |
700 |
600 |
14 |
SO2 + Cl2 = SO2Cl2 (газ) |
400 |
300 |
15 |
CO + 3H2 = CH4 + H2O (газ) |
1000 |
900 |
16 |
2CO + SO2 = 1/2S2 (газ) + 2 CO2 |
900 |
700 |
17 |
CO + Cl2 = COCl2 |
400 |
350 |
18 |
CO2 + H2 = CO + H2O (газ) |
1200 |
1000 |
19 |
CO2 + 4H2 = CH4 + 2 H2O (газ) |
1000 |
900 |
20 |
2CO2 = 2CO + O2 |
700 |
500 |
21 |
CH4 + CO2 = 2CO + 2H2 |
900 |
400 |
22 |
C2H6 = C2H4 + H2 |
400 |
350 |
23 |
C2H5OH (газ) = C2H4 + H2O (газ) |
400 |
350 |
24 |
CH3CHO (газ) + H2 = C2H5OH (газ) |
500 |
450 |
25 |
C6H6 (газ) + 3H2 = C6H12 (газ) |
600 |
500 |
Приступая к решению
задачи №2, рационально все справочные
термодинамические величины /1, табл. 44/
для заданной реакции и результаты
расчета стандартных величин (![]() ,
Δa, Δb, Δc,
Δc)
по следствию из закона Гесса представить
в виде таблицы.
,
Δa, Δb, Δc,
Δc)
по следствию из закона Гесса представить
в виде таблицы.
Например, составим таблицу при следующих исходных данных:
Таблица 3
№ варианта |
Реакция А |
Т, К |
Т1, К |
1 |
CO2 + 4H2 = CH4 + 2 H2O (газ) |
1000 |
500 |
Таблица 4
Вещество |
νi |
|
Коэффициенты уравнения
|
|||
a |
b·103 |
c·10-5 |
c·106 |
|||
CH4(газ) |
1 |
-74,85 |
14,32 |
74,66 |
- |
-17,43 |
H2O(газ) |
2 |
-241,81 |
30,00 |
10,71 |
0,33 |
- |
|
|
-558,47 |
∆aпрод = = 74,32 |
∆bпрод = = 96,08 |
∆cпрод = = 0,66 |
∆cпрод= = -17,43 |
CO2(газ) |
1 |
-393,51 |
44,14 |
9,04 |
-8,54 |
- |
H2(газ) |
4 |
0 |
27,28 |
3,26 |
0,50 |
- |
|
|
-393,51 |
∆aисх. = = 153,26 |
∆bисх. = = 22,08 |
∆cисх. = = -6,54 |
- |
∑∆rФ |
|
|
∆а = = -78,94 |
∆b =74,00 |
∆c= 7,20 |
∆c = 17,43 |
Функция ∆rФ рассчитывается исходя из соотношения:
![]() .
.
В задаче рассматриваются три метода расчета изменения теплоемкости в химической реакции как функции температуры, которые при правильном решении должны приводить к сопоставимым результатам.
1. Аналитический. ΔСР0 реакции рассчитывают по уравнению (1) при температуре Т1 (см. условие задачи). Обратите внимание, что абсолютные величины коэффициентов уравнения имеют порядок величины, обратный указанному в таблице:
ΔСР = ∆a + ∆b·10–3 T+ ∆c·10–6 T2 + ∆c·105 T–2 . (5)
Для рассматриваемой реакции уравнение (5) примет вид:
∆CP
= -78,94 + 74,00·10–3 T–17,43·10–6
T2 + 7,20·105 T–2
,
![]() .
.
2. Графический. По уравнению (5) рассчитывают отдельно ΔСР0 продуктов реакции и исходных веществ в интервале температур от 298 К до (Т+100) К с шагом 100, 50 или 20 градусов в зависимости от варианта задания. На графике должно быть не менее 6-8 точек, и температура Т1 должна находиться внутри выбранного интервала температур. Используйте соответствующие ∆a, ∆b, ∆c, ∆c для продуктов реакции и исходных веществ.
Таким образом, изменение изобарной теплоемкости продуктов реакции в соответствии с данными табл. 4 будет выражаться уравнением:
![]() ,
,
а исходных веществ:
![]() .
.
В рассматриваемом варианте интервал температур разбивают с шагом 100 К. Полученные значения теплоемкостей продуктов и исходных веществ заносят в таблицу.
Зависимость изменения теплоемкости продуктов и исходных веществ
Таблица 5
Т, К |
|
|
300 |
|
|
400 |
|
|
500 |
|
|
600 |
|
|
700 |
|
|
800 |
|
|
900 |
|
|
1000 |
|
|
На основании данных
табл. 5 строят график зависимости
![]() ,
,
![]() (рис. 1). Сечение зависимостей
,
,
при температуре Т1 позволяет
определить ΔСР0 реакции при
этой температуре. Оно должно быть равно:
(рис. 1). Сечение зависимостей
,
,
при температуре Т1 позволяет
определить ΔСР0 реакции при
этой температуре. Оно должно быть равно:
![]() .
.
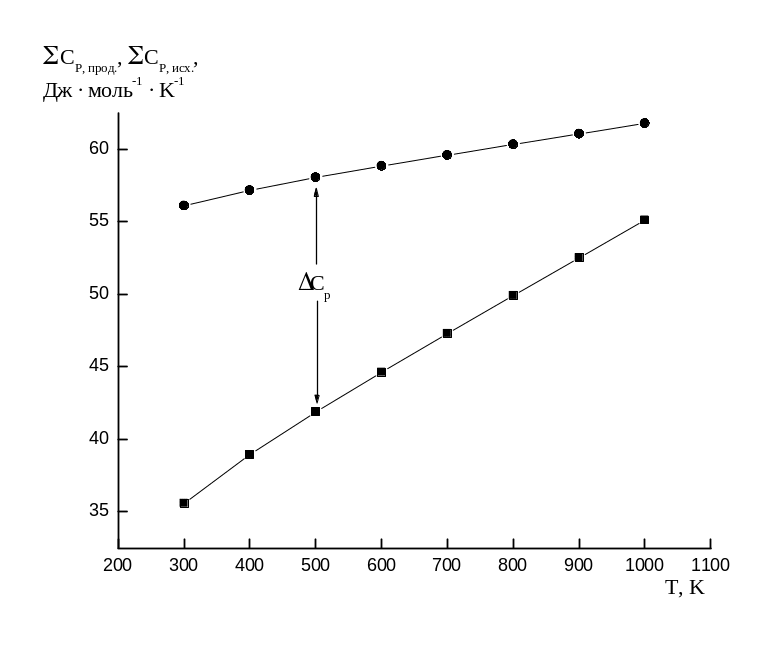
Рис.
1. Зависимость
![]() .
.
3. Графический. Базируется на законе Кирхгофа. По уравнению (2) или (что менее трудоемко) по уравнениям (3) и (4) рассчитывают тепловой эффект реакции ΔН0Т при тех же температурах, что и в пункте 2, результаты расчета сводят в таблицу.
Расчетные данные зависимости ΔН0Т = f (Т)
Таблица 6
Т,К |
300 |
400 |
500 |
600 |
700 |
800 |
900 |
1000 |
|
|
|
|
|
|
|
|
|
Построение
касательной к зависимости ΔН0Т=f
(Т) в точке, отвечающей Т1 (рис. 2),
дает возможность определить ΔСР0
реакции графическим дифференцированием
как угол наклона касательной :
![]() .
.

Рис. 2. Зависимость ΔН0Т = f (Т)
Угловой коэффициент касательной (tgα) рассчитывают из соотношения длин катетов прямоугольного треугольника в выбранном Вами масштабе.
