
Цель: изучить основные закономерности процесса кристаллизации и формирования структуры отливок при кристаллизации.
Общие положения
Нужно твердо усвоить, что любое вещество, в том числе и металл, может находиться в трех агрегатных состояниях: газообразном, жидком, твердом. Расположение атомов в газообразной среде хаотично, в жидком металле существует ближний порядок в расположении атомов (небольшие группы атомов имеют внутри группы расположение атомов как в кристалле твердого тела) и, наконец, в твердых кристаллических телах наблюдается дальний порядок в расположении атомов, т.е. упорядоченное регулярное распределение их по всему объему кристалла. Это приводит к тому, что кристаллы характеризуются анизотропией свойств, т.е. механические и физические свойства в кристалле различны по различным направлениям, в то время как в аморфных телах (например, в стекле), которые являются изотропными, свойства не зависят от направления. При изменении внешних условий (температура, давление) агрегатные состояния вещества могут меняться: твердое состояние сменяется жидким при температуре плавления, а жидкое - газообразным - при температуре кипения. Переход металла из жидкого состояния в твердое (кристаллическое) называется кристаллизацией.
Процесс кристаллизации
Чем объясняется существование при одних температурах жидкого, а при других температурах - твердого состояния? В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии.
Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией F, называемой свободной энергией Гиббса. Если превращение происходит с небольшим изменением объема, то
F=U-TS,
где U - полная энергия (внутренняя энергия системы);
T - абсолютная температура;
S - энтропия.
На рис. 1 приведены кривые, показывающие изменение свободной энергии жидкого и твердого металла в зависимости от температуры. Из рис. 1 видно, что выше температуры То устойчиво жидкое состояние металла, имеющее меньший запас свободной энергии ( Т2>То и F2ж< F2тв.), а ниже этой температуры устойчиво твердое состояние металла ( Т1<То и F1тв.< F1ж. ). При температуре То значения свободной энергии металла в жидком и твердом состояниях равны, металл в обоих состояниях находится в равновесии. Эта температура То и есть равновесная, или теоретическая температура кристаллизации.
Однако при То не может происходить процесс кристаллизации (плавления), так как при данной температуре Fж.= Fтв. и это не будет сопровождаться уменьшением свободной энергии. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии. Из кривых, приведенных на рис. 1 , видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки То. Температура T1, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации.
Следовательно, процесс кристаллизации может протекать только при переохлаждении металла ниже равновесной температуры - То. Разность между температурами - То и Т1 носит название степени переохлаждения:
∆T= То - Т1.
У металлов и сплавов способность к переохлаждению невелика. Она обычно не превышает 10-20°С. Процесс кристаллизации можно характеризовать кривыми в координатах температура - время. На рис. 2 приведены кривые кристаллизации металла при охлаждении с разной скоростью υ. Проследим ход кристаллизации металла по кривой охлаждения.
Сначала, когда металл находится в жидком состоянии, температура понижается до температуры кристаллизации Ткр, лежащей ниже температуры То. При этой температуре на кривой охлаждения появляется горизонтальная площадка, так как отвод тепла в окружающую среду компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. После окончания кристаллизации температура опять начинает
понижаться. Чем больше скорость охлаждения υ, тем больше степень переохлаждения ∆T и тем при более низкой температуре происходит процесс кристаллизации.
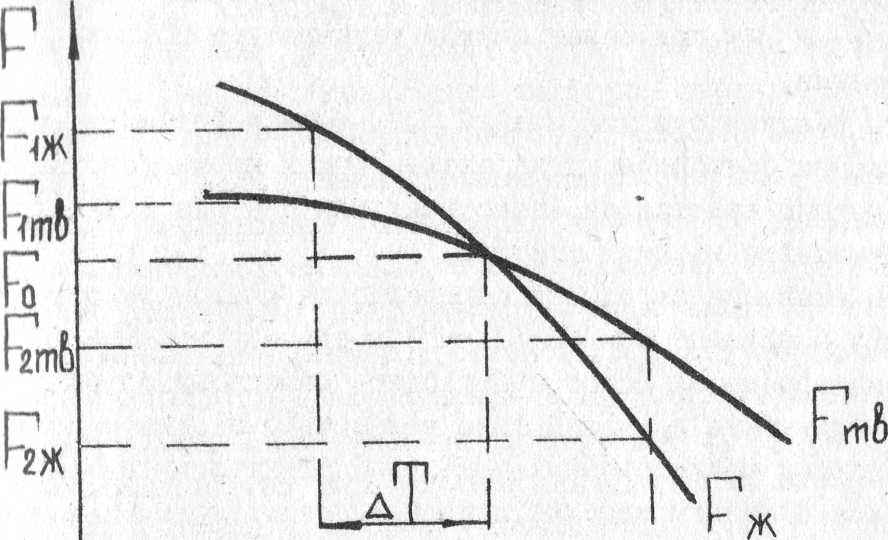
Рис 1. Изменение свободной энергии металла в жидком (Fж.) и твердом (Fтв.) состояниях с температурой: То - температура равновесия; ∆T - степень переохлаждения.
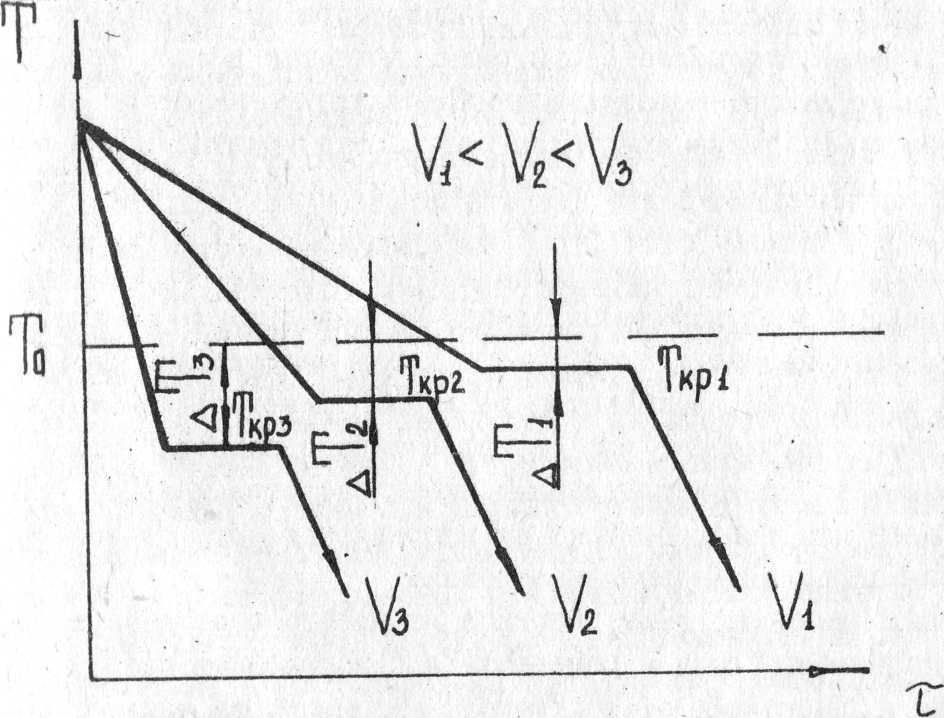
Рис. 2. Кривые кристаллизации металл
Еще в 1878 г. великий русский ученый Д.К. Чернов установил, что процесс кристаллизации состоит из двух элементарных процессов: зарождения мельчайших частиц кристаллов (зародышей или центров кристаллизации) и роста кристаллов из этих центров.
Скорость возникновения зародышей определяется числом зародышей (ч.з.), возникающих в единице объема (I мм^3 ) в единицу времени (1с). Образование зародышей может происходить самопроизвольно (спонтанно) непосредственно в жидкой фазе вследствие неоднородностей в распределении энергии между атомами и наличия флюктуации плотности, а также на имеющихся в жидком металле или умышленно вводимых мельчайших твердых частиц (неметаллические включения, оксиды и т.п.). Использование специально вводимых в жидкий металл примесей (модификаторов) получило название модифицирования.
Скорость роста кристаллов (с.р.) - это линейное перемещение растущей грани кристалла в миллиметрах в единицу времени. Рост кристаллов заключается в том, что к их зародышам присоединяются все новые атомы жидкого металла. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму, но это происходит только до момента встречи растущих кристаллов. В месте соприкосновения кристаллов рост отдельных их граней прекращается, и развиваются не все, а только некоторые грани кристаллов, в результате кристаллы не имеют правильной геометрической формы. Такие кристаллы называются кристаллитами или зернами. Зерна, как правило, разориентированы, повернуты друг относительно друга. Мы знаем, что все кристаллы анизотропны, т.е. свойства отдельно взятого кристалла (монокристалла) по данному направлению отличаются от свойств в другом направлении. Произвольность ориентировки каждого кристалла приводит к тому, что в любом направлении располагается примерно одинаковое количество различно ориентированных кристаллов. В результате получается, что свойства такого поликристаллического тела одинаковы во всех направлениях, хотя свойства каждого кристалла, составляющего это тело, зависят от направления. Это явление называется квазиизотропией (ложная изотропия).
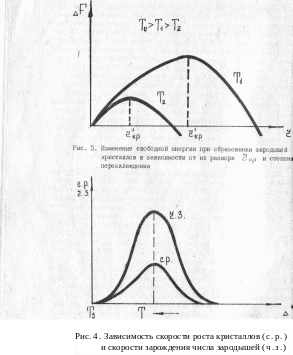
Как уже было выяснено выше, переход из одного состояния в другое, более устойчивое, должен совершаться с понижением свободной энергии системы. Однако сам этот переход, например, из жидкого состояния в твердое, требует затраты энергии на образование поверхности раздела жидкость – кристалл. Это превращение энергетически выгодно, а следовательно, идет, когда выигрыш в энергии от перехода в более устойчивое состояние будет больше затрат энергии, идущей на образование поверхности раздела. Увеличение размеров зарождающихся кристаллов сначала ведет к росту свободной энергии, как это показано на рис. 3, так как объем его мал, а площадь поверхности относительно велика. Но по достижении зародышем критического размера его дальнейший рост ведет к снижению свободной энергии. Отсюда следует, что устойчивые, т.е. способные к дальнейшему росту зародыши кристаллов имеют размер больший rкр (минимальный размер способного к росту зародыша). Зародыши с размером меньше rкр растворяются в жидкости, так как являются неустойчивыми. Каждой фактической температуре кристаллизации (степени переохлаждения) соответствует свой определенный критический размер зародыша. При увеличении скорости охлаждения, т.е. при понижении температуры кристаллизации (увеличение степени переохлаждения), критический размер зародыша уменьшается и будет меньше работа, необходимая для его образования. В связи с этим с увеличением степени переохлаждения, когда становятся способными к росту зародыши меньшего размера, сильно возрастают число зародышей (центров кристаллизации) и скорость образования этих зародышей.
Чем больше скорость образования зародышей и их роста, тем быстрее протекает процесс кристаллизации. При равновесной температуре число зародышей и скорость их роста равны нулю, так как из-за равенства свободной энергии жидкой и твердой фаз отсутствует движущая сила процесса, и поэтому кристаллизация не происходит. При увеличении степени переохлаждения скорость образования зародышей и скорость их роста возрастают, при определенной степени переохлаждения достигают максимума, после чего снижаются (рис. 4). Такой характер изменения ч.з. и с.р. в зависимости от степени переохлаждения объясняется следующим. С повышением степени переохлаждения разность свободных энергий жидкого и твердого металлов возрастает (рис. 1), что способствует повышению скорости образования зародышей и их роста. Однако для образования и роста зародышей требуется диффузионное перемещение атомов в жидком металле. В связи с этим при больших степенях переохлаждения (низких температурах) вследствие уменьшения скорости диффузии образование зародышей и их рост затруднены. При очень низких температурах (большой степени переохлаждения) диффузионная подвижность атомов столь мала, что образование и рост зародышей оказываются невозможными. В этом случае после затвердевания должно быть достигнуто аморфное состояние.
Аморфное тело находится с термодинамической точки зрения в неустойчивом (так называемом метастабильном) состоянии и является сильно загустевшей жидкостью. Для аморфного тела характерна изотропия свойств (одинаковые свойства по разным направления), а также отсутствие точки плавления, т.е. при повышении температуры аморфное тело размягчается. Эти особенности вызваны отсутствием у аморфного тела дальнего порядка в расположении атомов, однако ближний порядок имеется.
Для металлов долгое время считалось, что получение аморфного состояния невозможно, так как они мало склонны к переохлаждению ввиду быстрого роста обоих параметров кристаллизации. Однако в последние годы научились получать большую скорость охлаждения, охлаждая тонкие струи металла или распыляя мелкие капли на металлическую подложку. Достигаемые при этом скорости оцениваются величиной 10^6 -10^7 °С/с. Считается, что если будут найдены способы охлаждения со скоростью 10^9 -10^10 °С/с, то любой металл можно будет получить в аморфном состоянии, т.е., получить металлические стекла, обладающие специфическими физико-механическими свойствами.
При кристаллизации больших масс металла с увеличением скорости охлаждения, т.е. при увеличении степени переохлаждения жидкости в ней возникает большое число зародышей, и образуются мелкие зерна. При меньшем переохлаждений ч.з. уменьшается и вырастают крупные зерна. Однако следует отметить, что возможность регулирования скорости охлаждения в процессе кристаллизации, при затвердевании весьма ограничена. С целью регулирования размеров зерен широко используется искусственное введение в расплавленный металл веществ, создающих центры кристаллизации. Искусственное введение в жидкий металл тугоплавких мелких частичек (модификаторов), служащих дополнительными центрами кристаллизации, является наиболее прогрессивным, действенным методом регулирования размеров зерен, а следовательно, и свойств металлов и сплавов, так как размер зерен влияет на механические свойства металлов.
Скорость охлаждения, т.е. степень переохлаждения, влияет не только на размеры кристаллов, но и на их форму. При условии очень медленного охлаждения и при отсутствии в жидкости атомов примесей рост кристалла из своего зародыша происходит равномерно во всех направлениях. При ускоренном охлаждении в большинстве случаев при кристаллизации металлов, механизм образования кристаллов (зерен) носит дендритный характер (дендрит - от греческого слова "дендрон" - дерево).
Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет главным образом в тех направлениях, в которых скорость роста максимальна. В этих направлениях образуются длинные ветви будущего кристалла - оси первого порядка. Увеличение размеров осей первого порядка идет не только в длину, одновременно они разрастаются и в стороны. В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси которые называются осями второго порядка, от осей второго порядка растут оси третьего порядка и т.д.
По мере роста ветвей более высокого порядка постепенно заполняются все промежутки, ранее занятые жидким металлом. Когда все промежутки дендрита заполнены, наблюдать дендритное строение трудно. Только в условиях, при которых не хватает жидкого металла для заполнения пространства между осями, например, в поверхностных слоях кристаллизующегося металла, так как жидкий металл уходит на заполнение пространства между осями кристаллов, образующихся в нижележащих слоях (т.е. отступает от растущих в поверхностных слоях кристаллов), дендритное строение выявляется весьма отчетливо. Аналогичные условия создаются в процессе кристаллизации слитка в усадочной раковине, где также не хватает металла. Если условия благоприятны, то могут вырасти огромного размера дендриты. В усадочной раковине 100 – т. слитка один из учеников Д.К. Чернова нашел дендрит длиной в 39 см.
Рост кристаллов дендритной формы обусловливают примеси, посторние атомы в жидкости. Поэтому реальные сплавы преимущественно затвердевают, образуя дендритные кристаллы. Дендритное строение зерен, не различимое при визуальном осмотре, хорошо видно при наблюдении под микроскопом.
Очень удобно наблюдать образование и рост кристаллов в прозрачных материалах, в частности, в растворах солей. В данном случае изучается вызванная испарением растворителя кристаллизация из раствора солей, легко осуществляемая при наличии несложной аппаратуры.
Рис.
8. Распределение температуры по сечению
отливки
(τ1
<
τ2
< τ3
< τ4
< τ5
< τ6
< τ7):
а
- малая охлаждающая способность стенок
формы;
б
- большая охлаждающая способность
стенок формы.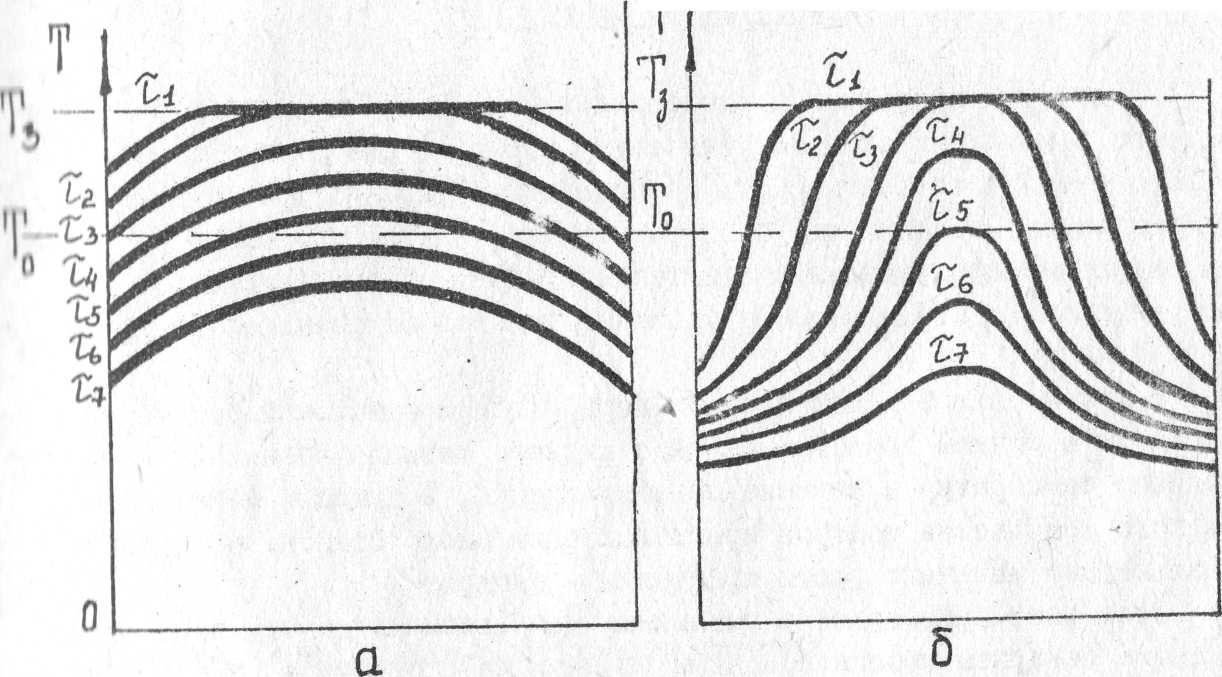
Процесс кристаллизации солей изучается с помощью биологического микроскопа. Наблюдение под микроскопом ведут при увеличении не более 100 раз.
На предметный столик микроскопа помещают плоское стекло, на которое нанесена капля почти насыщенного раствора соли. Наиболее удовлетворяющей нашим целям является соль азотнокислого свинца Pb(NO3)2.
Процесс кристаллизации изучаемой капли раствора соли можно условно разделить на три периода.
