
- •Мутации.
- •Индуцированные мутации
- •Генетические взаимодействия между вирусами
- •Генетическая рекомбинация
- •Генетическая реактивация
- •Комплементация.
- •Негенетические взаимодействия между вирусами
- •Картирование вирусных геномов Генетическое картирование
- •Рестрикционные карты
- •Физические карты
- •Генная инженерия
Лекция 5. Генетика вирусов.
Величайшие достижения середины XX века — открытие дискретных единиц наследственности (генов), разработка хромосомной теории наследственности,' развитие биохимической генетики микроорганизмов и установление принципа «один ген — один белок», открытие регуляции активности генов прокариотов Ф. Жакобом и Ж. Моно, открытие двойной спирали ДНК Дж. Уотсоном и Ф. Криком и др. создали основу для превращения генетики классической в генетику молекулярную, где законы наследственности и изменчивости изучаются на молекулярном и субмолекулярном уровнях.
За последние несколько лет наблюдался взрывообразный рост числа опубликованных сообщений по различным аспектам генетики эукариотических систем вообще, и системы клетка — вирус животных в частности.
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 106 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у sv40, настолько сходна с таковой генов эукариотической клетки, что пблучила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГЕНОМА КЛЕТКИ
В составе генома имеются структурные гены, кодирующие определенные* биополимеры (белки или РНК), и регуляторные гены, которые контролируют функцию структурных генов. Регуляция происходит с помощью белковых продуктов регуляторных генов — репрессоров, подавляющих активность структурных генов. Регуляторными участками генов, контролирующих транскрипцию, являются усилитель транскрипции (enhancer) и промотор — область, предшествующая структурным генам и определяющая место специфического связывания РНК-полимеразы.
Характерной особенностью генов эукариотической клетки является их мозаичная структура, т. е. прерывистость гена. В составе гена, кодирующего один белок, кодирующие участки прерываются вставочными последовательностями, которые не несут никакой кодирующей информации и не транслируются. Кодирующие участки гена называются экзонами, а вставки — нитронами (рис. 25).
При транскрипции считывается весь ген, включая экзоны и интроны. Впоследствии происходит созревание (процессинг) иРНК: из образовавшегося длинного первичного транскрипта удаляются участки, соответствующие интронам, а участки, соответствующие экзонам, «сшиваются». В результате подобной модификации из первичного транскрипта образуется зрелая иРНК. Этот процесс вырезания интронов и сшивания экзонов называется сплайсингом (от английского слова splice — соединять, сращивать концы каната). Сплайсинг был впервые описан на модели ДНК-со-держащих вирусов животных — 8У40 и аденовирусов.
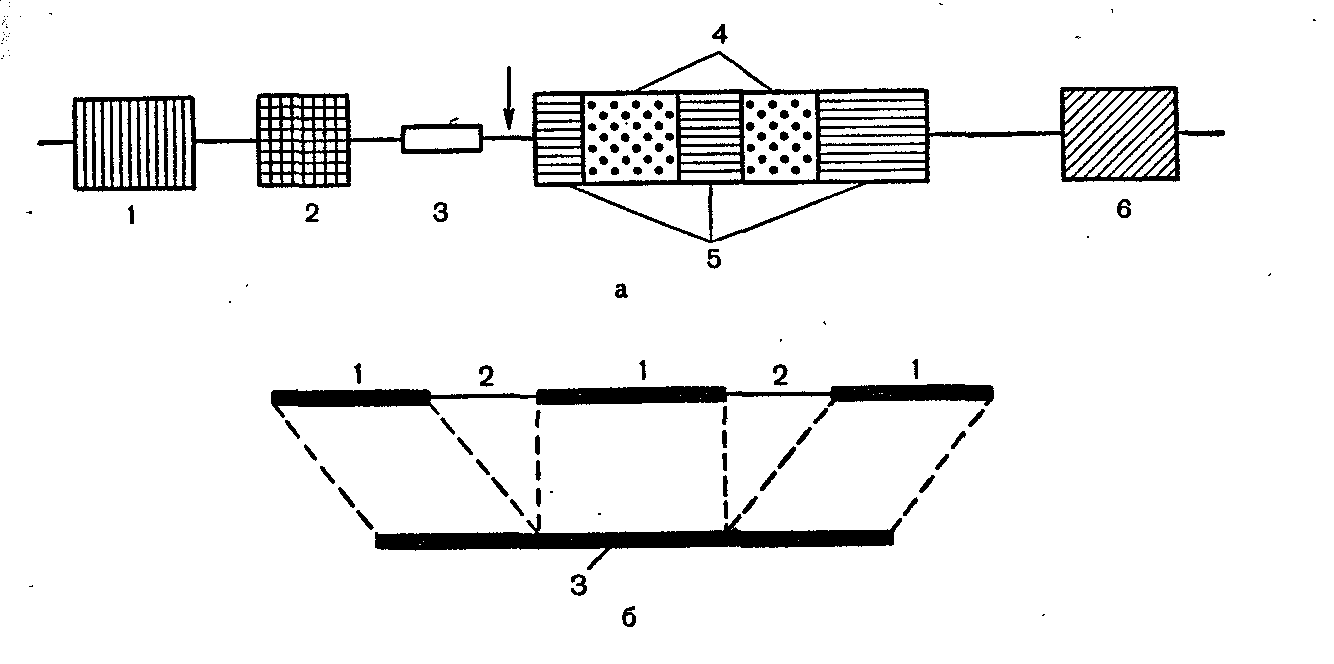
Строение эукариотического гена и его транскрипция.
а строение эукариотического гена 8У40: 1—усилитель транскрипции; 2—
промотор; 3— инициация репликации ДНК вируса (origin); 4— интроны; 5— экзоны (кодирующие области гена); 6— терминирующая последовательность ААТААА; стрелка обозначает участок начала транскрипции, б — схема сплайсинга при созревании иРНК: 1—экзоны, 2—интроны, 3—зрелая иРНК.
Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. У вирусов, принадлежащих к родам Poxvirus и Hepadnavirus геном представлен двумя цепочками ДНК разной длины. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным (представители родов Retrovirus , Orthomyxovirus , Arenavirus и Reovirus ) или несегментированным.
Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы. К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК и обозначают как +РНК (позитивный геном). Они имеют характерные окончания (`шапочки') для специфического распознавания рибосом.
У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза -РНК. Такой тип РНК определяют как минус-нить и обозначают -РНК (негативный геном). У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Молекулы +РНК проявляют инфекционность, а -РНК не проявляют инфекционные свойства и для воспроизведения должны транскрибироваться в +РНК.
Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующийся в клеточный геном.
СПОСОБЫ УВЕЛИЧЕНИЯ
ИНФОРМАЦИОННОЙ ЕМКОСТИ ВИРУСНОГО ГЕНОМА
В отличие от полицистронных иРНК прокариотов, иРНК эукариотов являются моноцистронными, т. е. реализуется принцип «один ген — одна молекула иРНК — один белок». Однако у некоторых клеточных иРНК и часто у вирусных иРНК этот принцип нарушается, и иРНК может направлять синтез двух белков.
У многих вирусов молекулярная масса синтезирующихся белков превышает теоретически рассчитанную. Этот феномен объясняется наличием у вирусов механизмов, позволяющих получить развернутую генетическую информацию при максимальной экономии генетического материала; подобные механизмы выработаны в процессе эволюции вирусов как генетических паразитов.
Способами увеличения генетической информации являются: 1) двукратное считывание одной и той же иРНК, но с другого инициирующего кодона; 2) сдвиг рамки трансляции; 3) сплайсинг; 4) транскрипция с перекрывающихся областей ДНК и др.
1) В составе иРНК обычно встречается несколько инициирующих кодонов. В соответствии с принятой в настоящее время гипотезой «сканирующей модели» Малая рибосомальная субъединица связывается с иРНК около 5'-конца и скользит вниз до встречи с инициирующим кодоном. Однако инициация в большинстве случаев происходит не с первого инициирующего кодона, а с последующих АУГ-кодонов. «Правильный» функционирующий АУГ-кодон узнается рибосомой благодаря окружающим его последовательностям («фланкирующим нуклеотидам»). В том случае, если первый инициирующий кодон находится в менее благоприятном окружении, чем последующие АУГ-кодоны, большинство малых рибосо-мальных, субъединиц пройдут этот кодон и начнут инициацию трансляции с последующих АУГ-кодонов, однако некоторые субъединицы начнут инициацию с первого АУГ-кодона. В этом случае одна иРНК может направить синтез двух белков разной длины. Такие иРНК имеются у многих вирусов: SV40, герпеса, аденовирусов, буньявирусов, реовирусов и др.
2) Трансляция может происходить без сдвига рамки и со сдвигом рамки. Генетический код является триплетным, это означает, что три нуклеотида, составляющих триплет, или кодон, кодируют одну аминокислоту. В том-случае, если триплеты сохранены и генетический код не изменился, то при трансляции с двух разных инициирующих кодонов будут синтезироваться полипептиды, представляющие собой укороченную копию первого полипептида (трансляция без сдвига рамки).
В том случае, если произошел сдвиг на один или два нуклеотида, образуются новые триплеты (кодоны) и появляется новый генетический код. В этом случае одна молекула иРНК может транслироваться с образованием двух уникальных белков, т. е. таких белков, у которых нет идентичных аминокислотных последовательностей.
3) Сплайсинг со сдвигом рамки широко используется у ряда вирусов (вирусы гриппа, парамиксовирусы, буньяви-русы, аденовирусы, паповавирусы, парвовирусы и др.). Один и тот же ген парамиксовирусов (вирус Сендай) кодирует два уникальных белка: структурный белок Р и неструктурный белок С.
Одним из способов экономии генетического материала является нарезание полипептида-предшественника на участки разной длины, в результате чего образуются разные полипептиды с перекрывающимися аминокислотными последовательностями. Таким образом, число реальных генов превосходит молекулярную массу генома. Основанный на длине генома расчет числа генов неизменно приведет к ошибочным результатам. Более точные представления о числе генов можно получить путем биохимического и генетического анализов.
В результате перекрывания генов и сдвига рамки трансляции «размываются» границы генов, и понятие «ген» в известном смысле утрачивает первоначальное значение как дискретный фрагмент генома и приобретает скорее функциональное значение.
Конечная цель генетического изучения вирусов животных — понимание деталей структуры и функции вирусного генома и каждого из генных продуктов вируса.
Методы исследования генетики вирусов.
На раннем этапе генетические исследования вирусов животных сдерживались из-за отсутствия подходящих методов исследования индивидуального потомства при смешанном заражении. Решение этой проблемы было найдено Дульбекко [32, 33], который разработал метод бляшек для цитоцидных вирусов. Использование метода бляшек позволило точно определять количество потомства, получать чистые клональные штаммы вируса и очищать вирусы от других примесных вирусов и дефектных интерферирующих частиц того же типа вируса. С помощью этого метода была получена система, пригодная для анализа условно-летальных мутаций. Таким образом, в значительной степени генетика вирусов животных началась с введения в практику метода бляшек. В настоящее время применимость метода бляшек рассматривают как необходимое условие для начала исследований генетики новой группы вирусов подобно тому, как разработка метода фокусов трансформации для нецитолитических, трансформирующих вирусов [151] послужила ключом к развитию генетических исследований этих вирусов.
При изучении регуляции синтеза вирусных нуклеиновых кислот и белков во многих системах, например у герпесвирусов, с успехом использовали ингибиторы белкового синтеза, такие как пуромицин или циклогексимид, а также ингибиторы синтеза РНК, например актиномицин Е) Разработка электрофоретических систем с высоким разрешением для анализа белков и нуклеиновых кислот позволила провести генетические исследования вирусов с сегментированным РНК-геномом, используя в качестве маркеров полиморфизм электрофоретической подвижности РНК-сегментов и белков Применение рестрикционных эндонуклеаз сыграло аналогичную роль для ДНК-содержащих вирусов с использованием в качестве генетических маркеров полиморфизма подвижности фрагментов ДНК и белков.
Методы исследования транскрипции и трансляции in vitro вирусов доказали свою эффективность при построении физических карт, особенно в системах, где отсутствует генетическая рекомбинация. В последнее время генетические приемы используют для изучения вирусного патогенеза и иммунного ответа хозяина на вирусную инфекцию, если хотят сопоставить специфические свойства вируса с индивидуальными вирусными генами и генными продуктами. Иными словами, современный генетик, изучающий вирусы животных, охотно заимствует методы у биохимика и применяет их в генетическом анализе. Наряду с этим генетики и другие специалисты используют генетический анализ для ответа на вопросы, которым традиционно не уделялось должного внимания. Такое слияние дисциплин очень помогло генетикам и в значительной мере определило быстрый прогресс этой науки в последние несколько лет.
Мутации.
Вирусам, как и всем живым организмам, свойственны наследственность и изменчивость. На раннем этапе исследования генетики вирусов животных в основном заключались в сборе и последующей генетической и физиологической характеризации вирусных мутантов. В последнее время вирусные мутанты стали использовать в качестве специфических инструментов для исследования генетических и биохимических событий, происходящих в зараженной клетке. Работы такого рода с вирусами животных в целом запаздывали по сравнению с аналогичными работами на прокариотических системах.
Спонтанная мутация
Некоторые вирусы дают значительную долю мутантов при пассировании в отсутствие каких-либо известных мутагенов. Эти спонтанные мутации накапливаются в геномах вирусов и приводят к изменчивости фенотипа, которая является объектом селективного давления в ходе эволюции вируса.
Скорость спонтанного мутагенеза в ДНК-геномах значительно ниже (10 -8 - 10 -11 на каждый включенный нуклеотид), чем у РНК-геномных (10 -3 - 10 -4 на каждый включенный нуклеотид). Более высокая частота спонтанных мутаций связана с низкой точностью репликации РНК-геномов, которая вероятно связана с отсутствием у РНК-репликаз корректирующей активности, свойственной ферментам, реплицирующим ДНК. Наиболее часто спонтанные мутации наблюдаются у ретровирусов, что связано с более высокой частотой сбоев в обратной транскрипции, не способных к самокоррекции.
Таким образом, в то время как геномы ДНК-содержащих вирусов относительно стабильны, этого нельзя сказать об РНК-содержащих вирусах, К сожалению для генетиков, ряд факторов стимулирует неравновесие в популяции геномов, и эти факторы часто способствуют накоплению мутантов в популяции. Из-за спонтанного мутагенеза трудно поддерживать гомогенность популяции вируса. Для того чтобы обойти эту трудность, вирусы периодически реклонируют, однако мутанты часто возникают и в ходе образования бляшки, и в ходе роста вируса, поэтому бывает трудно получить генетически однородные препараты вируса с высоким титром.
Индуцированные мутации
Индуцированные мутации у вирусов получают при действии различных химических и физических мутагенов, которые подразделяют на действующие in vivo и in vitro .
Большая часть мутантов, выделенных в ходе исследования вирусов животных, получена из популяций дикого типа, обработанных мутагенами. Мутагены обычно применяют для того, чтобы увеличить частоту мутаций в популяции, после чего мутанты подвергают скринингу с помощью подходящего селективного давления. Основной проблемой, связанной с использованием мутагенов, является подбор подходящей дозы. Как правило, желательно получить мутанты, которые отличаются от дикого типа только одной мутацией. Для этого отбор ведут при наиболее низкой дозе мутагена, дающей достаточную частоту мутаций с желаемым фенотипом.
В системах с вирусами животных было использовано множество различных мутагенов, но все они входят в небольшое число классов, определяемых по механизму мутагенеза.
Мутагены одного класса, обычно называемые мутагенами in vitro, действуют путем химической модификации нуклеиновой кислоты, содержащейся в вирусной частице. Азотистая кислота дезаминирует основания, в первую очередь аденин, с образованием гипоксантина, который при последующей репликации спаривается с цитозином. В результате действия азотистой кислоты на аденин происходит транзиция от АТ-пары к GС-паре. Азотистая кислота дезаминирует также цитозин, приводя к транзиции CG—>-ТА. Другим мутагеном in vitro является гидроксиламин; он реагирует специфически только с цитозином и вызывает транзицию СG—>-ТА. Большой класс мутагенов in vitro представлен алкилирующими агентами, которые действуют на многие позиции в основаниях. Алкилирующие агенты — нитрозогуанидин, этанметансульфонат и ме-тилметансульфонат —являются мощными мутагенами.
Во второй класс входят мутагены in vivo, которые требуют для своего действия метаболически активной нуклеиновой кислоты.
Одна группа мутагенов in vivo содержит аналоги оснований, которые включаются в нуклеиновую кислоту в ходе синтеза по правилам нормального спаривания. Включившись, эти аналоги способны претерпевать таутомерные переходы, которые приводят их к спариванию с различными основаниями, вызывая таким образом транзиции и трансверсии. Часто используют аналоги: 2-аминопу-рин, 5-бромдезоксиуридин и 5-азацитидин.
В другую группу мутагенов in vivo включены интеркалирующие агенты, которые внедряются в стопку оснований, что при последующей репликации нуклеиновой кислоты приводит к вставкам или делециям.
Примерами интеркалирующих агентов являются акридиновые красители, такие как профлавин.
Ультрафиолет также иногда используют в качестве мутагена. Основным продуктом действия ультрафиолета являются димеры пиримидинов. В ДНК пиримидиновые димеры вырезаются. Для РНК механизм ультрафиолетового мутагенеза неизвестен.
Большинству мутаций присуще свойство возврата (реверсии) к дикому типу. Каждая мутация имеет характерную частоту реверсий, которую можно точно измерить.
Классификация вирусных мутаций.
Вирусные мутации классифицируют по изменениям фенотипа и генотипа. По фенотипическим проявлениям мутации вирусов разделяют на четыре группы:
Мутации, не имеющие фенотипического проявления.
Летальные мутации, т.е. полностью нарушающие синтез или функцию жизненно важных белков и приводящие к утрате способности к репродукции. Мутация является летальной, если вследствие ее нарушается, например, синтез или функция жизненно важного вирусспецифического белка, например вирусной полимеразы.
Условно летальные мутации, т.е. мутации с потерей способности синтезировать определенный белок или с нарушением его функции только в определенных условиях. В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции в определенных, оптимальных для него, условиях и теряет эту способность в неразрешающих (непермиссивных) условиях. Типичным примером таких мутаций являются температурно-чувствительные (temperature sensitive) – ts-мутации, при которых вирус теряет способность размножения при повышенных температурах (39—42° С), сохраняя эту способность при обычных температурах выращивания (36—37° С).
Мутации, имеющие фенотипическое проявление, например изменение размеров бляшек под агаровым покрытием или термостабильности, по изменению спектра хозяев, устойчивости к ингибиторам и химиопрепаратам.
