
- •Общие представления о химическом превращении
- •Зависимость экстенсивных свойств системы от глубины химической реакции
- •3. Расчет стандартной мольной энергии Гиббса реакции, стандартной мольной энтальпии и стандартной мольной энтропии реакции при температуре 298 к
- •Расчет стандартных мольных изменений свойств системы в ходе химического превращения по справочным данным при любой температуре
- •4.1. Общие сведения
- •4.2. Расчет стандартных мольных изменений экстенсивных свойств системы в ходе химического превращения при любой температуре
- •4.2.3. Расчет температурной зависимости стандартной мольной
- •4.2.5.1. Расчёт состава равновесной системы при температуре 900 к и давлении 1 атм. При стехиометрическом начальном составе и отсутствии продуктов реакции в начальный момент в системе
- •Заключение
- •Используемая литература
3. Расчет стандартной мольной энергии Гиббса реакции, стандартной мольной энтальпии и стандартной мольной энтропии реакции при температуре 298 к
Рассмотрим в качестве примера газовую реакцию, протекающую при 298 К
2H2O(г) + 2Cl2 = 4HCl(г) + O2 (26)
Найти при этой температуре стандартное мольное изменение функции Гиббса, стандартные мольные изменения энтальпии и энтропии за счет протекания этой реакции.
Из справочника выписываем необходимую информацию, дополняя ее информацией, полученной из стехиометрического уравнения (таблица 2) и проводим расчеты.
Таблица 2
Вещество k |
Стехиометрический коэффициент νk |
стандартная мольная энтальпия образования вещества k |
стандартная мольная энтропия образования вещества k |
стандартная мольная функция Гиббса образования вещества k |
кДж/моль |
Дж/моль |
кДж/моль |
||
H2O(г) |
-2 |
-241,81 |
188,72 |
-228,61 |
Cl2 |
-2 |
0 |
223 |
0 |
HCl(г) |
4 |
-92,3 |
186,7 |
-95.29 |
O2 |
1 |
0 |
205,04 |
0 |
Δr
![]() =
=
![]() (298)=(-2)*(-241,81)+4*(-92,3)=114.42
кДж/моль
(298)=(-2)*(-241,81)+4*(-92,3)=114.42
кДж/моль
Δr
![]() =
=
![]() (298)
=(-2)*188,72+(-2)*223+4*186,7+1*205,04=128.4
Дж/(моль*К)
(298)
=(-2)*188,72+(-2)*223+4*186,7+1*205,04=128.4
Дж/(моль*К)
Δr
![]() =
=
![]() (298)
=(-2)*(-228,61)+4*(-95,29)=76.06
кДж/моль
(298)
=(-2)*(-228,61)+4*(-95,29)=76.06
кДж/моль
Расчет стандартных мольных изменений свойств системы в ходе химического превращения по справочным данным при любой температуре
4.1. Общие сведения
Для решения многих
задач, в частности для нахождения
значения констант равновесия химических
реакций, для исследования влияния
температуры и давления на химическое
равновесие необходимо уметь вычислить
стандартные мольные изменения энтропии
![]() ,
энтальпии
,
энтальпии
![]() и энергии
Гиббса
и энергии
Гиббса![]() для системы
с той или иной химической реакцией, а
также константу равновесия данной
реакции
для системы
с той или иной химической реакцией, а
также константу равновесия данной
реакции
![]() при произвольной
температуре. Часто используют такое
понятие, как тепловой эффект реакции.
Если реакцию проводить необратимо при
постоянном давлении и температуре, то
тепловой эффект реакции (то есть
выделяемое или поглощаемое в таких
условиях проведения реакции количество
теплоты) будет равен изменению энтальпии
и может быть обозначен
при произвольной
температуре. Часто используют такое
понятие, как тепловой эффект реакции.
Если реакцию проводить необратимо при
постоянном давлении и температуре, то
тепловой эффект реакции (то есть
выделяемое или поглощаемое в таких
условиях проведения реакции количество
теплоты) будет равен изменению энтальпии
и может быть обозначен
![]() . Известны
соотношения, связывающие между собой
данные свойства системы:
. Известны
соотношения, связывающие между собой
данные свойства системы:
![]() (30)
(30)
![]() (31)
(31)
Кроме того, известно,
что мольную изобарную теплоемкость
можно выразить как температурный
коэффициент мольной энтальпии в условиях
постоянства давления в системе, то
есть ![]() (32)
(32)
а также как произведение изобарного температурного коэффициента мольной энтропии на температуру:
![]() (33)
(33)
Из этих соотношений (30-33) следует, что для расчета каждого из этих свойств при произвольной температуре необходимо знать температурную зависимость этого свойства, а для этого - температурную зависимость теплоемкости каждого компонента - участника реакции.
Зависимость стандартной мольной изобарной теплоемкости вещества k от температуры принято выражать степенными рядами, справедливыми в определенном (всегда указываемом в справочниках) интервале температур. Для удобства расчетов реакций, включающих вещества разной природы - органические и неорганические, удобно применять общую формулу температурного ряда теплоемкости следующего вида:
![]() (34),
(34),
где
![]() - мольная изобарная теплоемкость чистого
вещества k
при температуре
Т;
- мольная изобарная теплоемкость чистого
вещества k
при температуре
Т;
![]() - эмпирические
коэффициенты температурного ряда
теплоемкости чистого вещества k.
- эмпирические
коэффициенты температурного ряда
теплоемкости чистого вещества k.
Изменение мольной
изобарной теплоемкости системы в
результате протекания реакции
![]() при любой
температуре Т находится из выражения:
при любой
температуре Т находится из выражения:
![]() (35),
(35),
где ![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Следует отметить, что знаки стехиометрических коэффициентов принято учитывать с минусом у исходных веществ, с плюсом - у продуктов реакции.
Уравнение для расчета стандартного мольного изменения энтальпии в ходе химического превращения называется уравнением Кирхгофа:
![]() (36)
(36)
Согласно этому
уравнению влияние температуры на
тепловой эффект реакции обусловливается
знаком величины стандартной мольной
изобарной теплоемкости реакции
![]() .
При
> 0 , величина
температурного коэффициента энтальпии
.
При
> 0 , величина
температурного коэффициента энтальпии
![]() положительна, то есть с повышением
температуры осуществления процесса
тепловой эффект реакции возрастает.
При
< 0,
температурный коэффициент энтальпии
отрицателен, то есть тепловой эффект
реакции при повышении температуры
проведения процесса уменьшается. И,
наконец, если
= 0 , то при
какой бы температуре мы ни проводили
процесс, его тепловой эффект будет
постоянным.
положительна, то есть с повышением
температуры осуществления процесса
тепловой эффект реакции возрастает.
При
< 0,
температурный коэффициент энтальпии
отрицателен, то есть тепловой эффект
реакции при повышении температуры
проведения процесса уменьшается. И,
наконец, если
= 0 , то при
какой бы температуре мы ни проводили
процесс, его тепловой эффект будет
постоянным.
Разделяя переменные в уравнении (36) и проводя интегрирование, получим:
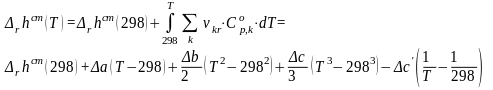 (37)
(37)
При выполнении
расчетов может встретиться необходимость
вычисления тепловых эффектов реакции
при нескольких температурах. Для
упрощения расчета в этом случае удобно
объединить в уравнении (37)
![]() и все
слагаемые, содержащие множитель 298, в
одно:
и все
слагаемые, содержащие множитель 298, в
одно:
![]() (38)
(38)
где
![]() эмпирическая
постоянная для данной реакции, размерность
которой совпадает с размерностью
теплового эффекта. Иногда
рассматривают
как интерполяционную константу, имеющую
смысл теплового эффекта при абсолютном
нуле. С учетом (38) преобразуем уравнение
(37):
эмпирическая
постоянная для данной реакции, размерность
которой совпадает с размерностью
теплового эффекта. Иногда
рассматривают
как интерполяционную константу, имеющую
смысл теплового эффекта при абсолютном
нуле. С учетом (38) преобразуем уравнение
(37):
![]() (39).
(39).
Уравнение (39) можно также назвать уравнением температурной зависимости теплового эффекта реакции или уравнением температурной зависимости энтальпии реакции. Расположение линии, отображающей температурную зависимость теплового эффекта химической реакции зависит от природы реакции и от величины интервала температур. В узком температурном интервале - это прямая линия, если же рассматривать достаточно широкий интервал температур - то это кривая, иногда с максимумом или минимумом.
Если вычисленное по уравнению (39) значение теплового эффекта реакции положительно, то такая реакция называется эндотермической. Если тепловой эффект отрицателен, то реакция относится к экзотермическим. Величина и знак теплового эффекта обусловливает влияние температуры на константу химического равновесия реакции. Это следует из анализа уравнения изобары химической реакции (или уравнения Вант-Гоффа). Для рассматриваемых нами газовых реакций константу равновесия выражают через парциальные давления, принимая свойства реальных газов близкими к свойствам идеальных газов.
![]() (40)
(40)
Из уравнения (40)
видно, что для эндотермических реакций
(![]() )
повышение температуры должно вызывать
увеличение константы равновесия, то
есть смещение равновесия в сторону
продуктов реакции. Если рассматриваемая
реакция относится к экзотермическим
(
)
повышение температуры должно вызывать
увеличение константы равновесия, то
есть смещение равновесия в сторону
продуктов реакции. Если рассматриваемая
реакция относится к экзотермическим
(![]() )
то, наоборот, повышение температуры
осуществления процесса ведет к уменьшению
величины константы равновесия, то есть
к сдвигу равновесия в сторону исходных
веществ. Наконец, если
)
то, наоборот, повышение температуры
осуществления процесса ведет к уменьшению
величины константы равновесия, то есть
к сдвигу равновесия в сторону исходных
веществ. Наконец, если
![]() ,
то изменение температуры не оказывает
влияния на константу равновесия, то
есть изменением температуры проведения
процесса сместить равновесие в какую-либо
сторону нельзя. Следует также отметить,
что влияние температуры на смещение
равновесия будет сказываться тем
сильнее, чем больше по абсолютной
величине тепловой эффект реакции.
,
то изменение температуры не оказывает
влияния на константу равновесия, то
есть изменением температуры проведения
процесса сместить равновесие в какую-либо
сторону нельзя. Следует также отметить,
что влияние температуры на смещение
равновесия будет сказываться тем
сильнее, чем больше по абсолютной
величине тепловой эффект реакции.
Теперь рассмотрим, как найти стандартную мольную энтропию реакции .
![]() (41)
(41)
Разделим переменные и произведем интегрирование:
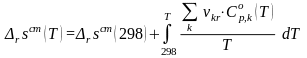 (42)
(42)
Привлекая зависимость (28) и (35) в уравнение (42), получим:
![]() (43)
(43)
Располагая функциями
![]() и
и
![]() можно
рассчитать по уравнению (30) значение
стандартного мольного изменения энергии
Гиббса в ходе химической реакции
можно
рассчитать по уравнению (30) значение
стандартного мольного изменения энергии
Гиббса в ходе химической реакции
![]() при любой
температуре. В случае отсутствия
необходимых для расчета значений
и
можно
воспользоваться следующим выражением:
при любой
температуре. В случае отсутствия
необходимых для расчета значений
и
можно
воспользоваться следующим выражением:
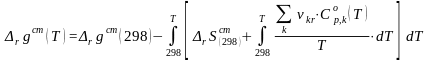 (44)
(44)
Проведя интегрирование
и сгруппировав члены, содержащие
![]() ,
получим:
,
получим:
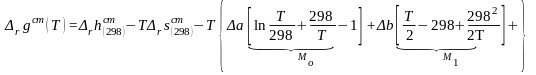
 (45)
(45)
Для упрощения расчетов стандартного мольного изменения функции Гиббса в ходе реакции величины, которые в предыдущем уравнении обозначены в скобках и содержат только выражения с температурой, рассчитаны и сведены в таблицы. Эти таблицы называются таблицы для вычисления термодинамических функций по методу Темкина и Шварцмана и приводятся в справочниках [3]. Запись уравнения (45) с учетом коэффициентов, приводимых в этих таблицах, имеет следующий вид:
![]() (46)
(46)
Располагая величинами стандартной мольной энергии Гиббса в результате протекания химической реакции при различных температурах проведения процесса, можно вычислить величины констант химического равновесия данной реакции при этих же температурах.
![]() (47).
(47).
Это, в свою очередь, позволит рассчитать равновесный выход продукта реакции.
