
- •Общие представления о химическом превращении
- •Зависимость экстенсивных свойств системы от глубины химической реакции
- •3. Расчет стандартной мольной энергии Гиббса реакции, стандартной мольной энтальпии и стандартной мольной энтропии реакции при температуре 298 к
- •Расчет стандартных мольных изменений свойств системы в ходе химического превращения по справочным данным при любой температуре
- •4.1. Общие сведения
- •4.2. Расчет стандартных мольных изменений экстенсивных свойств системы в ходе химического превращения при любой температуре
- •4.2.3. Расчет температурной зависимости стандартной мольной
- •4.2.5.1. Расчёт состава равновесной системы при температуре 900 к и давлении 1 атм. При стехиометрическом начальном составе и отсутствии продуктов реакции в начальный момент в системе
- •Заключение
- •Используемая литература
4.2.5.1. Расчёт состава равновесной системы при температуре 900 к и давлении 1 атм. При стехиометрическом начальном составе и отсутствии продуктов реакции в начальный момент в системе
Для расчета мольных долей удобно пользоваться таблицей 6
Таблица 6
Компонент |
Число молей компонента |
|
В начальный момент времени |
В момент равновесия
|
|
H2O(г) |
|
|
Cl2 |
|
|
HCl(г) |
0 |
|
O2 |
0 |
|
Суммарное количество молей всех компонентов в момент равновесия равно:
![]() = a
– 2ξ+b-2ξ + 4ξ + ξ = a + b + ξ (67)
= a
– 2ξ+b-2ξ + 4ξ + ξ = a + b + ξ (67)
Мольные доли всех компонентов в момент равновесия:
![]()
![]()
![]()
![]() (68)
(68)
Привлекая (68) в выражение закона действия масс, получаем выражение для расчета равновесного состава данной реакции, при температуре 900 К и давлении
1 атм.: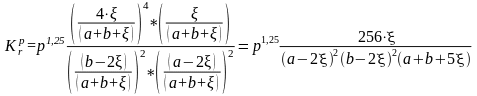
Зная давление и величину константы равновесия, нетрудно определить и глубину химической реакции, а затем рассчитать равновесный состав.
Заключение
В данной курсовой работе были исследованы зависимости стандартных мольных изменений теплоёмкости, энтальпии, энтропии, энергии Гиббса и константы равновесия реакции от температуры, а также определены при заданной температуре и начальном составе системы её равновесный состав и направление реакции.
Для данной реакции
2H2O(г)
+ 2Cl2
=
4HCl(г)
+ O2
рассмотрена зависимость
![]() и
и
![]() ,
,
![]() от Т и показано на графике, что с
увеличением Т в интервале 700 – 1200 К
величины
и
увеличиваются, по расчётным было
установлено, что константа равновесия
зависит от температуры: с увеличением
Т константа равновесия данной реакции
увеличивается.
от Т и показано на графике, что с
увеличением Т в интервале 700 – 1200 К
величины
и
увеличиваются, по расчётным было
установлено, что константа равновесия
зависит от температуры: с увеличением
Т константа равновесия данной реакции
увеличивается.
Используемая литература
1. В.М.Глазов. Основы физической химии: Учебное пособие для вузов. - М.: Высш.школа, 1981.- 456 с.
2. Методические указания к курсовой работе по физической химии для студентов химико-технологического факультета. /Степановских Е.И., Китаев Г.А., Брусницына Л.А., Зуев М.Г./ Екатеринбург 2000г.
3. Краткий справочник физико-химических величин /под ред. А.А.Равделя и А.М.Пономаревой. - Л.: Химия, 1983. - 232 с.
