
- •Общие представления о химическом превращении
- •Зависимость экстенсивных свойств системы от глубины химической реакции
- •3. Расчет стандартной мольной энергии Гиббса реакции, стандартной мольной энтальпии и стандартной мольной энтропии реакции при температуре 298 к
- •Расчет стандартных мольных изменений свойств системы в ходе химического превращения по справочным данным при любой температуре
- •4.1. Общие сведения
- •4.2. Расчет стандартных мольных изменений экстенсивных свойств системы в ходе химического превращения при любой температуре
- •4.2.3. Расчет температурной зависимости стандартной мольной
- •4.2.5.1. Расчёт состава равновесной системы при температуре 900 к и давлении 1 атм. При стехиометрическом начальном составе и отсутствии продуктов реакции в начальный момент в системе
- •Заключение
- •Используемая литература
4.2.3. Расчет температурной зависимости стандартной мольной
энтропии реакции
Привлекая необходимые числовые коэффициенты в уравнение (43), получим:
![]() (56)
(56)
Проведя преобразования, находим температурную зависимость энтропии данной реакции:
![]() (57)
(57)
И рассчитываем значения мольной стандартной энтропии при разных температурах (табл. 4).
Пример расчёта ∆r Sст(Т) при температуре = 900 К:
![]()
Температурные зависимости стандартных мольных энтальпии, энтропии и энергии Гиббса
Таблица 4
Т, К |
Дж/моль |
Дж/(моль·К) |
Дж/моль |
|
298 |
114420 |
128,40 |
76060 |
4,65·10-14 |
700 |
116719,15 |
135,88 |
23213,53 |
0,0185 |
800 |
117098,15 |
136,50 |
9829,36 |
0,2281 |
900 |
117440,13 |
136,99 |
-3598,81 |
1,6176 |
1000 |
117751,00 |
137,38 |
-17074,01 |
7,7963 |
1100 |
118034,53 |
137,69 |
-30560,91 |
28,2663 |
1200 |
118293,23 |
137,95 |
-44081,25 |
82,9614 |
Если к какой-либо
точке на этой кривой (например при
температуре 900 К) провести касательную,
то по угловому коэффициенту касательной,
можно определить величину стандартной
мольной изобарной теплоемкости реакции,
при этом расчетная формула будет иметь
такой вид:
![]() (58)
(58)![]()
Определенная графическим способом мольная изобарная теплоемкость реакции практически совпадает с вычисленной по выражению (53) величиной.
4.2.4. Расчет стандартной мольной функции Гиббса реакции
При вычислении мольной стандартной энергии Гиббса можно воспользоваться соотношением (30), так как в предыдущем расчете нами получены данные по стандартным мольным энтропиям и энтальпиям реакции при разных температурах. Рассмотрим пример расчета мольной стандартной энергии Гиббса в условиях, когда этими данными мы не располагаем, то есть по таблицам для вычисления термодинамических функций по методу Темкина и Шварцмана в требуемом интервале температур (таблица 5)
Таблица 5
Величина
![]() для вычисления
стандартного мольного изменения энергии
Гиббса по методу Темкина и Шварцмана
для вычисления
стандартного мольного изменения энергии
Гиббса по методу Темкина и Шварцмана
Т, К |
|
|
|
|
700 |
0,2794 |
0,1153 |
0,0498 |
0,1853 |
800 |
0,3597 |
0,1574 |
0,0733 |
0,2213 |
900 |
0,4361 |
0,2012 |
0,1004 |
0,2512 |
1000 |
0,5088 |
0,2463 |
0,1134 |
0,2783 |
1100 |
0,5765 |
0,2922 |
0,1652 |
0,2988 |
1200 |
0,6410 |
0,3389 |
0,2029 |
0,3176 |
Пример расчёта стандартной мольной функции Гиббса рассматриваемой реакции при температуре Т = 500 К:
![]() (59)
(59)
∆gст(500) = 114420 - 900·128,4 - 900·[4,2·0,4361 -1,73·10-3·0,2012·103 + +4,97·105·0,2512·10-5] = -3598,81 Дж/моль (60)
Зная величину стандартной мольной функции Гиббса реакции при любой температуре, мы можем по формуле
![]() (61)
(61)
определить величину константы равновесия данной реакции.
Например, для рассмотренной температуры, 900 К величина константы равновесия равна:
ln
Kr
=
![]() =
0,481 Kr
= 1,6176
=
0,481 Kr
= 1,6176
Данные по расчету константы равновесия исследуемой реакции при разных температурах приведены в таблице 4. Представляет интерес рассмотреть зависимость константы равновесия от температуры, имея в виду интегральную форму уравнения изобары
![]() (62)
(62)
Для этого нужные
нам данные таблицы 4 необходимо представить
в виде
![]() и построить
график. На рис. 3 представлена зависимость
и построить
график. На рис. 3 представлена зависимость
![]()
Полученная
зависимость
![]() (рис. 3) позволяет
по тангенсу угла наклона прямой к точке
на этой прямой определить величину
теплового эффекта реакции (стандартной
мольной энтальпии реакции) при этой
температуре. Она будет сопоставима с
вычисленной ранее величиной теплового
эффекта. Для данной реакции в виду малого
значения константы равновесия и поэтому
малых величин логарифмов зависимость
кажется практически линейной на всем
диапазоне температур, то есть тепловой
эффект мало зависит от температуры.
(рис. 3) позволяет
по тангенсу угла наклона прямой к точке
на этой прямой определить величину
теплового эффекта реакции (стандартной
мольной энтальпии реакции) при этой
температуре. Она будет сопоставима с
вычисленной ранее величиной теплового
эффекта. Для данной реакции в виду малого
значения константы равновесия и поэтому
малых величин логарифмов зависимость
кажется практически линейной на всем
диапазоне температур, то есть тепловой
эффект мало зависит от температуры. ![]()
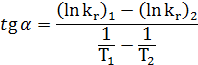
![]()
![]()
Полученное значение стандартной мольной энтальпии реакции графическим методом немного отличается от рассчитанной ранее величины.
4.2.5 Расчет равновесного состава системы гомогенной газовой реакции
Знание константы равновесия реакции позволяет рассчитать состав равновесной смеси, то есть определить максимально возможный, или теоретический выход желаемого продукта. Для этого необходимо решить уравнение закона действия масс (или закона химического равновесия). В предположении идеального поведения газов этот закон запишется:
![]() (63),
(63),
где под знаком произведения расположены величины, относящиеся к состоянию равновесия; причем, давление выражено как отношение парциального давления к единице размерности давления, то есть оно не имеет размерности.
Парциальное давление каждого участника реакции по закону Дальтона равно общему давлению, умноженному на мольную долю компонента, или через число молей компонентов:
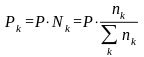 (64)
(64)
Если теперь выразить числа молей всех компонентов через начальные количества и глубину реакции, то при известном общем давлении в системе и известной величине константы равновесия, будем иметь одно уравнение с одной неизвестной величиной - глубиной реакции.
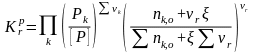 (65)
(65)
Рассмотрим пример составления математического выражения для расчета состава равновесной смеси. Для некоторых реакций получаемые выражения имеют высокий, либо дробный порядок. Подобные уравнения решают либо графически, либо методами последовательного приближения.
Исследуемая нами реакция
2H2O(г) + 2Cl2 = 4HCl(г) + O2
Закон действующих масс для исследуемой в данной работе реакции запишется так:
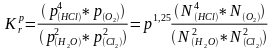 (66)
(66)
