
Основные типы кристаллических решеток
Основные характеристики кристаллических структур. Для количественной оценки степени упакованности кристаллической решетки удобно пользоваться специальными показателями. Рассмотрим наиболее важные из них.
Число атомов на ячейку nя это число атомов, целиком принадлежащих данной элементарной ячейке. Например, в примитивной кубической решетке число атомов на ячейку равно 1 (атомы размещены только в вершинах куба и каждый из них принадлежит ячейке на 1/8). В сложной объемно-центрированной решетке их 2 (помимо восьми вершинных есть один атом в центре куба, целиком принадлежащий ячейке); наконец, в гранецентрированной уже 4 (кроме вершинных, имеется шесть атомов в центре каждой грани куба, принадлежащих ячейке лишь наполовину).
Координационное число К представляет собой количество ближайших равноудаленных атомов, окружающих данный атом. Как отмечалось, в гранецентрированной кубической и гексагональной компактной решетках К=12, в то же время для объемно-центрированной кубической К=8.
Коэффициент компактности (заполнения) q характеризует отношение объема Vа , занятого в ячейке атомами, к объему всей ячейки Vя , т.е. q = V а / V я . Коэффициент заполнения для простой кубической решетки составляет 0,52, для объемно-центрированной кубической 0,68 и для плотнейшей упаковки (гранецентрированной
Подавляющее большинство металлов (около 75%) имеет кристаллические структуры трех видов это решетки типа вольфрама, меди и магния. Познакомимся с ними.
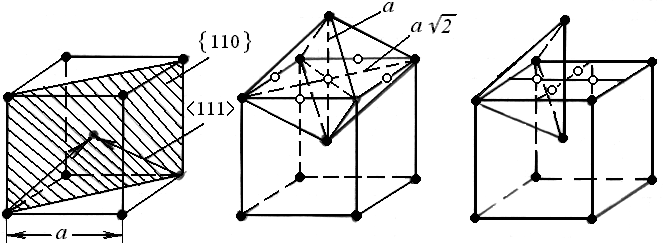
Структурный тип вольфрама (рис.1). Решетка Браве является объемно-центрированной кубической (ОЦК). Слоев с плотнейшей упаковкой эта решетка не имеет. В отличие от других плоскостей более упакованными являются плоскости типа {110}, в которых содержится по два плотноупакованных направления <111> (рис.1,а). Микропоры имеют форму октаэдра и тетраэдра (рис.1,б,в), причем размер октапор оказывается меньше тетраэдрических ( rок.п / rат = 0,15 и rт.п / rат = 0,29 соответственно, при этом rок.п , rт.п и rат размеры октаэдрической, тетраэдрической пор и атома).
а б в
Рис. 1. Кубическая объемно-центрированная решетка:
а элементарная ячейка и плотноупакованные
плоскости и направления;
б октаэдрические поры (о);
в тетраэдрические поры (о); () - атомы металла
С
наличием этих пор связана одна
примечательная особенность
примесные атомы внедрения, размещающиеся
в междоузлиях ОЦК-решетки, предпочтительно
располагаются в меньших по объему
октаэдрических порах, нежели в
относительно более крупных тетраэдрических.
Это объясняется тем, что октаэдрическая
пора, окруженная шестью атомами,
имеет форму слегка сплюснутого
октаэдра
два атома расположены ближе друг к другу
(на расстоянии, равном периоду решетки
a),
чем остальные четыре (на удалении
уже a ![]() ) .
В противоположность этому тетраэдрическая
пора является симметричной, поэтому
внедрение чужеродного атома в такую
позицию вызовет одинаковое смещение
всех четырех окружающих атомов. В то же
время при попадании внедренного
атома в октаэдрическую пору только
два атома окажутся смещенными,
соответственно в решетке произойдет
деформация вдоль направления,
соединяющего ближайшие атомы в октаэдре.
Таким образом, размещение примесных
атомов внедрения в октапорах вызовет
меньшее искажение решетки по сравнению
с нахождением их в тетраэдрических
позициях. Вместе с тем известны случаи,
когда примесные атомы внедрения могут
размещаться и в тетраэдрических порах
(например, атомы водорода).
) .
В противоположность этому тетраэдрическая
пора является симметричной, поэтому
внедрение чужеродного атома в такую
позицию вызовет одинаковое смещение
всех четырех окружающих атомов. В то же
время при попадании внедренного
атома в октаэдрическую пору только
два атома окажутся смещенными,
соответственно в решетке произойдет
деформация вдоль направления,
соединяющего ближайшие атомы в октаэдре.
Таким образом, размещение примесных
атомов внедрения в октапорах вызовет
меньшее искажение решетки по сравнению
с нахождением их в тетраэдрических
позициях. Вместе с тем известны случаи,
когда примесные атомы внедрения могут
размещаться и в тетраэдрических порах
(например, атомы водорода).
Структурой ОЦК обладают щелочные металлы Li, Na, K, Rb, Cs, переходные металлы V, Cr, Nb, Mo, Ta и W, а также полиморфные модификации таких металлов, как Fe, Ti и Zr.
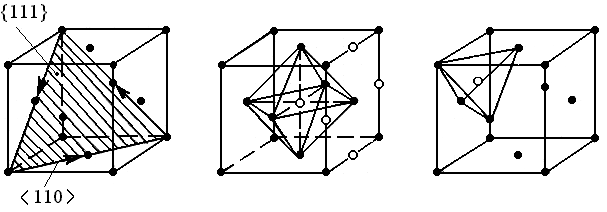
Структурный тип меди (рис.2). Решетка Браве гранецентрированная кубическая (ГЦК), имеет плотнейшие атомные слои типа {111}, чередующиеся в последовательности АВСАВС ... В каждом таком слое содержится три плотноупакованных атомных ряда <110> (рис.2,а). Имеются относительно большие по размеру и симметричные по форме октаэдрические поры (rок.п / rат = 0,41), заметно превышающие тетраэдрические (rт.п / rат = 0,22). Их изображение дано на рис.40,б,в.
Такая структура характерна для благородных металлов, которым относятся Cu, Ag, Au, а также металлы платиновой группы Pt, Pd, Rh, Ir, для многовалентных металлов Al и Pb, переходных металлов последних групп периодической системы Ni, а также соответствующих модификаций Fe, Co.
а б в
Рис. 2. Кубическая гранецентрированная решетка:
а элементарная ячейка и плотноупакованные плоскости
и направления;
б октаэдрические поры (о);
в тетраэдрические поры (о); () атомы металла
Структурный тип магния (рис.3). Решетка Браве гексагональная примитивная. Плотная упаковка обеспечивается совмещением двух решеток Браве, в результате элементарная ячейка представляет собой четырехгранную призму, в которой помимо вершинных атомов содержится еще один, расположенный внутри. Плотнейшие слои типа {0001} размещаются в последовательности АВАВ ..., т.е. упаковка оказывается двухслойной. В каждой такой плоскости имеется три плотноупакованных направления типа <1120>. Плотное прилегание этих слоев получается, когда между периодами решетки а и с выдерживается определенное соотношение с/а =1,633. У большинства металлов с такой структурой отношение с/а оказывается либо меньше (Be, Zr, Ti), либо больше (Zn, Cd) этой величины. Ближе к идеальной плотноупакованной гексагональной структуре подходят решетки Mg и Co.
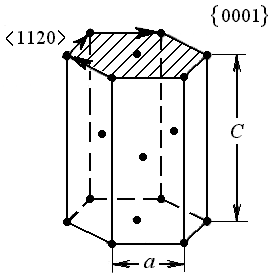
Рис. 3. Элементарная ячейка и плотноупакованные плоскости
и направления гексагональной плотноупакованной решетки
Подобная структура, которую принято называть гексагональной плот- ноупакованной (ГПУ), присуща переходным металлам первых групп Sс, Ti, Zr, Hf, двухвалентным металлам Be, Mg, Zn и Cd и большинству редкоземельных металлов.
