
Вопрос 13
1
Химическая связь - это взаимодействие частиц(атомов, ионов), осуществляемые путём обмена электронами.
Ковалентная связь образуется в результате обобществления электронов , которое происходит в ходе перекрывания электронных облаков. В ковалентной связи участвуют электронные облака двух атомов.
Различают 2 основные разновидности ковалентной связи: полярная и неполярная.
Ковалентная неполярная связь образуется между атомами неметаллов одного и того же химического элемента. Такую связь имеют простые вещества(Кислород, хлор, азот)
Ковалентная полярная связь образуется между атомами различных неметаллов.
2
Карбоновые кислоты это соединение. В молекулах которых содержится одна или несколько карбоксильных групп, соединеных с углеводороным радикалом.
В зависимости от числа числа карбоксильных групп различают: одноосновные к –ты.
R-COOH.
Пример:CHтриCOOH – уксуная к-та.
Взависимости от вида углеводородного радикала различают:
Предельные- в углеводородном радикале имеются только одинарые связи.
Карбоновые к-ты широко применяются в промышлености и в быту, находят широкое применение в химической прмышленности ( HCOOH –востановитель при синтезе органических в-в. , CHтриCOOH – при синтезе красителей), для получения пласстмас, и д.р., в медицине.
Билет 14
1
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Металлическая связь, химическая связь, обусловленная взаимодействием электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллической решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетических уровней, называемых зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическую связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи.
2
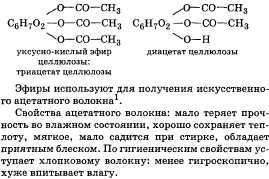
Сложные эфиры это производные карбоновых кислот, в молекулах которых, атом карбоксильной группы замещён на радикал. Сложные эфиры широко распространены а природе они содержатся а ягодах в фруктах, овощах. Составляя основу жиров, восков, и других в-в. Сложные эфиры образованные карбоновыми кислотами и высшими одноатомными спиртами являются восками. Жиры бывают жидкими и твёрдыми. Жидкие называют маслами. Твёрдые являются животного происхождения. Большинство жиров являются производными трёх атомного спирта глицерина и высших карбоновых кислот. На основе жиров люди научились получать ценный продукт, обладающий моющими средствами- мыло.
Процесс получения мыла из жиров называется – омылением.
Билет 15
1




Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом (см. Окислы).
Соединения, содержащие атомы кислорода, соединённые между собой, называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов.
