
- •К. 3. Закономерности в атомных спектрах.
- •Постулаты Бора.
- •Экспериментальное подтверждение гипотезы.
- •Статистическое толкование волн де Бройля.
- •Соотношение неопределенностей Гейзенберга.
- •Уравнение Шредингера.
- •Мкч в бесконечно глубокой потенц-ой яме.
- •Принцип Паули.
- •Распределение электронов по слоям.
- •Периодическая система элементов д.И.Менделеева.
- •Модели атомного ядра.
- •Закон р/акт распада.
- •Зонная теория. Энергетические уровни.
- •Заполнение зон электронами. Проводники, диэлектрики полупроводники.
Распределение электронов по слоям.
n |
слой |
max кол-во элект-ов |
max число элект-ов в слое
|
|||
S (ι=0) |
P (ι=1) |
d (ι=2) |
f (ι=3) |
|||
1 |
K |
2 |
- |
- |
- |
2 |
2 |
L |
2 |
6 |
- |
- |
8 |
3 |
M |
2 |
6 |
10 |
- |
18 |
4 |
N |
2 |
6 |
10 |
14 |
32 |
n=1 – 1s2
n=2 – 2s22p6
n=3 – 3s2 3p6 3d10
n=4 – 4s2 4p6 4d10 4f14
Периодическая система элементов д.И.Менделеева.
Можно считать годом открытия – 1896. К тому времени было известно 63 химич-х элемента, но 36 химич-х элем-та соблюдали возрастание ат. весов, 20 хим-х элем-та – нарушали закон-ть ат. весов, 7 хим-х элем-та – он сам предложил положить и 5 хим-х элем-та – предсказал(Se, Ge, Ga, Te, Re). В рез-те действия ПП электронная оболочка многоэлектр-го атома имеет слоистую структуру. Теория периодич-ой системы основ-ся на следующих положениях:
1.порядковый номер хим-го элем-та = общему числу электронов в атоме данного элемента.
2.состояние электронов в атоме определ-ся набором квант-х чисел(n, l, m, ms).
3.заполнение электронами квант-ых состояний в атоме происходит в соответствии с ПП.
Согласно этим положениям построение электронной оболочки хим-го элем-та в ПСМ можно представить следующим образом:
1.число электронов в каждом слое должно соответствовать числу электронов в периоде.
2.каждый период оканчив-ся электроном, у которого полностью укомплектован соотв-ий электронный слой; электр-ая оболочка обладает сферич-ой симметрией и весьма устойчива→такие элем-ты в хим-ом отношении должны бать инертны.
3.началом каждого периода служит элемент, у которого нач-ся комплектование нового электронного слоя; в этом случае электроны внутренних оболочек компенсируют заряд ядра и связь вновь присоедин-ия электрона будет слабой→в начале каждого периода должен стоять типичный электрон.
Таким образом, периодичность свойств хим-их элементов обусловлено повторению строения внешних электрон-х слоев атома при непрерывном росте их порядкового номера в таблице Менделеева.
К.№ 6 Рентгеновское излучение.
Рентгеновские лучи представляют собой электромагнитное излучение с очень короткими длинами волн (10-5-102 нм). Со стороны длинных волн рентгеновские лучи перекрываются ультрафиолетовыми лучами, а коротковолновое излучение сливается с гамма-лучами радиоактивных веществ. Лучи с большой проникающей способностью были открыты немецким физиком Вильгельмом Конрадом Рентгеном в 1895 г. при исследовании катодного свечения и впоследствии названы его именем. Рентгеном были исследованы основные свойства открытых им лучей: способность отражаться, поглощаться, ионизировать воздух и другие, предложена конструкция трубки для их получения, сделаны первые фотоснимки.
Рентгеновские лучи обладают следующими свойствами:
1. не отклоняются в электрическом и магнитном полях, а следовательно, не несут электрического заряда;
2. обладают фотографическим действием;
3. вызывают ионизацию газа;
4. способны вызывать люминесценцию в ряде веществ т.е. свечение, видимое глазом. С помощью таких веществ можно визуально обнаружить появление рентгеновских лучей.
5. оптическими свойствами: могут преломляться, отражаться, обладают поляризацией, дают явления интерференции и дифракции. Однако оптические свойства рентгеновских лучей слабо выражены и трудно наблюдаемы.
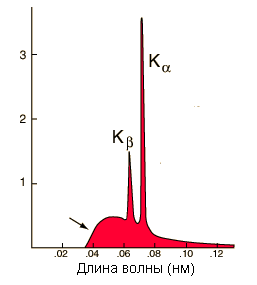
Рентгеновские лучи возникают в процессе бомбардировки веществ потоками электронов с большой кинетической энергией. Для получения рентгеновских лучей служат рентгеновские трубки, представляющие собой стеклянный сосуд с впаянными двумя металлическими электродами, из которого удален воздух. В электрическом поле между катодом и анодом электроны движутся со скоростью, соизмеримой со скоростью света, к аноду и тормозятся его веществом. При этом происходит превращение части кинетической энергии электронов в энергию электромагнитного излучения. Различают два вида рентгеновского излучения: тормозное (белое) и характеристическое. Спектр излучения рентгеновской трубки представляет собой наложение тормозного и характ-ого рентгеновского спектров.
Тормозное: Р. излучение, возникающее при торможении быстрых электронов, называется тормозным.Движущиеся электроны, образуют вокруг себя магнитное поле. Процесс резкого торможения электронов в веществе анода, приводит к изменению магнитного поля, в результате чего и возникают электромагнитные волны. По теории Максвелла, такие тормозящиеся электроны должны излучать короткие электромагнитные волны. Тормозное рентгеновское излучение имеет сплошной спектр и поэтому часто называется “белым” излучением (по аналогии со сплошным спектром белого света). Спектр тормозного излучения определяется напряжением, приложенным к трубке, и не зависит от вещества анода.
Из вида зависимостей можно сделать следующие выводы:
1. Сплошной спектр имеет резкую границу со стороны коротких длин волн – λmin.2. С увеличением напряжения, прил к трубке, весь спектр смещается в сторону коротких длин волн. 3. С увеличением напряжения, приложенного к трубке (и следовательно кинетической энергии электронов), возрастает как интенсивность любой длины волны, так и интегральная интенсивность (т. е. полное излучение во всем диапазоне длин волн).
Характеристическое: излучение возникает в результате вырывания электронов с одной из близких к ядру оболочек атома, которое осуществляется при ионизации быстрыми электронами атомов вещества анода. В атомах тяжелых элементов (ZPt = 78), оболочки K, L, M, N заполнены. Электроны, находящиеся во внутренних слоях, испытывают сильное притяжение, обусловленное большой величиной заряда ядра, и вследствие этого оказываются сильносвязанными. Поэтому для удаления электронов из внутренних слоев необходимо затрачивать большую энергию. Вот почему характеристические лучи возникают в результате бомбардировки веществ электронами большой энергии порядка 104 эВ, а значит, возбуждение характеристического излучения происходит при вполне определенном для данного вещества напряжении на трубке Uо, которое называется потенциалом возбуждения. При всех напряжениях U > Uо на фоне сплошного спектра тормозного излучения будут присутствовать характеристические максимумы. Характеристическое рентгеновское излучение образуется в результате взаимодействия падающих электронов с электронами внутренних оболочек атомов в веществе. Атом возвращается в обычное состояние в результате перехода электрона с наружной оболочки на вакансию во внутренней, теряя энергию на генерацию кванта рентгеновского излучения.
ЗАКОН МОЗЛИ. Положение линий характеристического рентгеновского спектра зависит от номера элемента, составляющего антикатод рентгеновской трубки. Английский физик Генри Мозли в 1913 г. экспериментально проследил, как изменяется длина волны и соответственно частота рентгеновских лучей линий характеристического спектра у различных элементов.
R![]() - постоянная Ридберга, b
- постоянная экранирования, учитывающая
влияние на отдельные электроны всех
остальных электронов атома, n, p
- главные квантовые числа уровней между
которыми осуществляется переход. Закон
Мозли окончательно позволил подтвердить,
что Z определяется зарядом ядра, а не
атомной массой, то есть при переходе от
элемента к элементу заряд ядра
увеличивается на единицу и что элементы
в таблице Д.И.Менделеева расположены в
порядке возрастания заряда ядра. После
работ Мозли система химических элементов
была, наконец, установлена окончательно
и осталось только понять ее особенности.
- постоянная Ридберга, b
- постоянная экранирования, учитывающая
влияние на отдельные электроны всех
остальных электронов атома, n, p
- главные квантовые числа уровней между
которыми осуществляется переход. Закон
Мозли окончательно позволил подтвердить,
что Z определяется зарядом ядра, а не
атомной массой, то есть при переходе от
элемента к элементу заряд ядра
увеличивается на единицу и что элементы
в таблице Д.И.Менделеева расположены в
порядке возрастания заряда ядра. После
работ Мозли система химических элементов
была, наконец, установлена окончательно
и осталось только понять ее особенности.
К. 7 Модель атома по Резерфорду.
Представление об атомном строении материи, т.е. о существующих мельчайших неделымых частиц из которых состоит материя, исходит из античной философии(Демокрит, 2,5 тыс. лет назад). Идея атома была забыта вплоть до 17 века. 1804г.-Дальтон ввел понятие химич-го элемента.
1865г.-Лашмидт определил размеры атомов(~10-27м) и вес атома водорода(~10-27кг).
Во второй половине 19 века стали накаплив-ся сведения о сложном строении атома: 1.был открыт элементарный отриц-ый заряд(1897г. Томсон). 2. было показано, что электроны входят в состав атома.
Модель атома Томсона: Атом предст-ет собой равномерно полож-но заряженный шар диаметром порядка 10-10м, в котором плавают отриц-но заряженные элетроны(10-15м). Устойчивость атома обеспечивается квазиупругими силами между электронами.
Опыты Резерфорда по рассеянию α-частиц.
Основой современных представлений об атоме явились опыты Резерфорда по рассенянию α-частиц, в рез-те которых выяснилось, что представления о полож-ом заряде атома Томсона неверны.
Для получения инфо-ии о полож-ом заряде атома надо было прозондировать электрич-ое поле атома с помощью пробного полож-го заряда. В качестве пробного заряда Резерфорд использовал α-частицы. α-частица – сотавляющая радиоактивного излучения.
1896г. – Анри Беккерело открыл радиоактивность(р/акт-испускание ядрами некот-х элем-ов различных частиц сопровождающийся переходом ядра в др. состояние и изменение его параметра).
α-частицы способны проникать через вещество толщиной 0,01 мм. На основе опытов опеределялось распределение α-частиц рассеяных металлич-ми фольгами. Большинство α-частиц испытывали незначительные отклонения от первоначального положения, но имелись частицы отклоняющиеся на углы
θ = 1350 ÷ 1500.
Выводы из опытов Резерфорда:
1.отклонения α-частиц от прямолинейного направления вызываются действием электрич-х зарядов, нах-ся внутри атомов.
2.в большей части пространства занятого атомов, электрич-ие поля невелики поскольку большинство частиц не испытывают заметного отклонения.
3.Екα = (mα υα2/2) = En =Z4Пε eer → r ~ 10-15м. таким образом, в атомах сущ-ют электрич-е заряды, сконцентрир-е в малой области размерами 10-15м.
4. отклонение α-частицы обусловлено взаимодействием с полож-ми зарядом. Таким образом, полож-ый заряд атома не распределен по всему объему атома, а сконцентрирован в его малой области(r ~ 10-15м) –в ядре.
5 с положит-ым зарядом атома связана также и значит-ая часть массы, т.е. в атоме имеется всего лишь один полож-ый заряд, с которым связана почти вся масса атома.
На основании выводов из опытов по рассеянию α-частиц была предложена ядерная модель атома, согласно которой весь положит-ый заряд и почти вся масса атома сосредоточены в атомном ядре.(ядерная модель атома)
Ядерные силы.
Нуклоны связаны между собой особыми силами притяжения – ядерными силами. Основные свойства:
1. fяд >> fкул, fграв.
2.они короткодействующие, т.е. действуют на расстояниях ~ 10-15 м = 1 Ф.
3. они явл-ся силами особого рода, их природа и свойства изучены недостаточно.
Энергия связи ядра. Деффект масс.
Энергия связи – это энергия, необходимая для разобщения нуклонов, состовляющих ядро. Ее можно определить, исходя из законов сохранения энергии и пропорциональности массы и энергии. Из закона сохранения энергии следует, что энергия нуклонов связанных в ядре должна быть меньше энергии разобщенных нуклонов на величину энергии связи в ядре: Ея = Ен – ε.
Из закона пропорц-ти массы и энергии следует, что:
Ея = mя c2 и Ен = mн c2 { → ε = Ен - Ея = (mн – mя)c2 = ∆m c2, где ∆m – дефект массы. Дефект массы характеризует уменьшение суммарной массы нуклонов при образовании из них ядра.
ε = {[Zmр + (A-Z) mn] – mя} c2 ;
ε (МэВ)=931,5[Zmр+(A-Z) mn – mя]. mр,mn,mя в а.е.м.
удельная энергия связи – энергия связи приходящаяся на один нуклон: ε0=εА. (характер-ет устойчивость атомных ядер).
Зависимость удельной энергии связи от массового числа: т.е. удельная энергия связи слабо меняется с ростом массового числа. Это отражает св-ва насыщения ядерных сил связанных малым радиусом их действия.
