
- •Модульная программа
- •Модуль 0 цели и задачи модульной программы
- •Модуль 1 общая характеристика d-элементов I группы
- •Атомные характеристики d-элементов I группы
- •Основные природные минералы, содержащие d-элементы I группы
- •Модуль 2 простые вещества
- •Модуль 3 кислородные соединения элементов
- •Модуль 4 соединения с неметаллами, комплексные и металлоорганические соединения
- •Модуль 5 технологические процессы в химии d-элементов I группы
Основные природные минералы, содержащие d-элементы I группы
Cu2S |
халькозин |
Cu2O |
куприт |
CuS |
ковеллин |
CuO |
тенорит |
CuFeS2 |
халькопирит |
Cu2(OH)2CO3 |
малахит |
Cu3(OH)2(CO3)2 |
азурит |
Ag2S |
аргентит |
AgCl |
хлораргирит (роговое серебро) |
AuTe2 |
калаверит |
Модуль 2 простые вещества
УЭ-1. Важнейшие физические свойства простых веществ. Нахождение в природе.
Таблица 3
Основные физические свойства элементов подгруппы меди
Э |
tпл, оС |
tкип, оС |
плотн., г/см3 |
крист. решетка |
Eо (Э+/Э0), В |
Удельное сопротивление, Ом*м |
Окраска |
Cu |
1085 |
2540 |
8,9 |
ГЦК |
+0,521 |
1,67*10-8 |
красная |
Ag |
962 |
2210 |
10,5 |
ГЦК |
+0,799 |
1,59*10-8 |
серебристо-белая |
Au |
1064 |
2947 |
19,3 |
ГЦК |
+1,691 |
2,35*10-8 |
жёлтая |
УЭ-2. Свойства и применение простых веществ.
Задание 1. Завершите уравнения реакций простых веществ с кислотами (учтите значения стандартных потенциалов и возможность комплексообразования):
? Cu + HCl
![]() ?
Cu + HNO3
(25%)
?
Cu + HNO3
(25%)
? Cu + H2SO4 (10%) ? Ag + HCl
? Ag + HNO3 (30%) ? Au + H2SO4
? Au + KCN + H2O + O2 ? Au + HCl + HNO3
Задание 2. Завершите уравнения реакций простых веществ с неметаллами:
? Cu + I2 ? Cu + NH3H2O + O2
? Cu + O2
![]() ?
Ag + F2
?
Ag + F2
? Au + Br2 ? Ag + Cl2
Задание 3. Приведите 5 примеров сплавов, содержащих рассматриваемые металлы. Укажите их состав и применение.
Опыты.
(1) Получение меди и серебра химическим восстановлением из раствора. а) В фарфоровую чашку с насыщенным раствором CuSO4 постепенно, небольшими порциями, внесите рассчитанную массу цинковой пыли. Чашку со смесью поставьте на водяную баню и нагрейте до 80 оС. Когда цинк покроется медью, раствор слейте, выделившийся осадок обработайте 5%-ным раствором соляной кислоты, промойте водой путем декантации, перенесите на фильтр, еще раз промойте водой и просушите между листами фильтровальной бумаги.
б) погрузите в раствор нитрата меди (2) предварительно очищенную наждачной бумагой и промытую водой железную пластинку. Через 1-2 мин выньте пластинку.
в) медную пластинку обработайте разбавленной азотной кислотой, промойте водой. На пластинку нанесите несколько капель раствора AgNO3. Составьте уравнение реакции.
(2) Окисление меди кислородом воздуха. а) Нагрейте медную проволоку. б) В пламя газовой горелки всыпьте порошок меди (тяга). Составьте уравнения наблюдаемых реакций.
Модуль 3 кислородные соединения элементов
УЭ-0. Цели и задачи модуля.
Изучив данный модуль, студент должен знать:
-свойства оксидов и гидроксидов: устойчивость, кислотно-основные и окислительно-восстановительные свойства; методы получения;
-химические свойства и получение солей Cu(I), Cu(II), Ag(I), Ag(II), Au(I) и Au(III);
- применение кислородных соединений.
УЭ-1. Свойства оксидов и гидроксидов рассматриваемых элементов.
а) Степень окисления +1.
1. Свойства оксидов Э(I).
Э2O |
Окраска |
tпл, оС |
Cu2O |
красная |
1236 |
Ag2O |
коричневая |
300 (разл.) |
Au2O |
серо-фиолетовая |
200 (разл.) |
2. Кислотно-основные свойства и комплексообразование.
? Cu2O + NH3H2O ? Ag2O + HNO3
? Ag2O + KBr + H2O ? Au2O + KCN + H2O
? Cu2O + HCl (конц.)
3. Окислительно-восстановительные свойства:
? Ag2O + NH3·H2O + CH2O (реакция «серебряного зеркала»)
? Cu2O + O2
? Ag2O + H2O2
1.4. Получение Э2O (неустойчивость ЭOH! )
? CuSO4 + NaOH + N2H4
? AgNO3 + NH3H2O (нед.)
? AgNO3 + NH3H2O (изб.)
б) Степень окисления +2.
1. Свойства оксидов и гидроксидов Э (II).
ЭO |
Окраска |
tразл, оС |
CuO |
чёрная |
1026 |
AgO |
чёрная |
100 |
AuO |
(тёмно-зелёная) |
? (очень неустойчив) |
Cu(OH)2 – синий , tразл < 100 оС
Cu(OH)2
![]() CuO
+ H2O
CuO
+ H2O
Ag(OH)2, Au(OH)2 – неизвестны!
Степень окисления +2 наиболее характерна для Cu!
2. Кислотно-основные свойства, комплексообразование.
? CuO + HCl ? CuO + NaOH (тв.)
? CuO + NaOH (р-р) ? Cu(OH)2 + H2SO4 (р-р)
? Cu(OH)2 + NaOH (конц.) ? Cu(OH)2 + NH3H2O
3. Окислительно-восстановительные свойства:
4 CuII(OH)2 + N2H4 2CuI2O + N2 + 6H2O;
2CuII(OH)2 + 4KOH + K2S2O8 2K[CuIII(OH)4] + 2K2SO4.
4AgIIO + 2H2SO4 (разб.) 2AgI2SO4 + O2 + 2H2O,
но: AgO + 2HClO4 (конц.) Ag2+ + 2ClO4 + H2O. Eo(Ag2+/Ag+) = 2,00 В.
4. Получение:
? Cu + O2
?
CuCl2
+ NaOH
![]()
? Ag + O3 ? AgNO3 + K2S2O8 + KOH
в) Степень окисления +3.
1. Свойства оксидов и гидроксидов Э (III).
Э2O3 |
Окраска |
tразл, оС |
Cu2O3 |
гранатово-красная |
400 |
Ag2O3 |
черная |
-20 (очень неустойчив) |
Au2O3 |
коричневая |
160 |
Au(OH)3 – коричневый, плохо растворим в воде; проявляет амфотерные свойства с преобладанием кислотных свойств.
Cu(OH)3 и Ag(OH)3 неизвестны.
2. Окислительно-восстановительные свойства соединений Э (III):
Cu2O3 + 6 HCl 2 CuCl2 + Cl2 + 3 H2O;
Au2O3 + 3 H2O2 2 Au + 3 O2 + 3 H2O.
3. Кислотно-основные свойства:
Au(OH)3 + 4 HCl H[AuCl4] + 3 H2O;
Au(OH)3 + NaOH Na[Au(OH)4].
Cu2O3 + BaO Ba(CuO2)2,
2 Y2O3
+ 8BaO + 12 CuO + (1-2x)
O2
![]() 4 YBa2Cu3O7-x
4 YBa2Cu3O7-x
(высокотемпературный сверхпроводник, Tкрит = 92 K, Дж. Г. Беднорц и К.А.Мюллер, 1986 г.)
УЭ-2. Химические свойства и получение солей кислородсодержащих кислот Cu, Ag, Au.
а) Степень окисления +1.
CuI : известно мало солей.
Причина - неустойчивость к диспропорционированию:
2 Cu+ Cu0 + Cu2+.
Энергия гидратации: 582 кДж/моль 2121 кДж/моль
Радиус: 0,096 нм 0,072 нм
(CuI можно стабилизировать в различных комплексах и в растворе CH3CN)
Например:
CuI2SO4
![]() Cu
+ CuSO4
Cu
+ CuSO4
получение: 2Cu + 2 H2SO4
![]() Cu2SO4
+ SO2
+ 2 H2O
Cu2SO4
+ SO2
+ 2 H2O
AgI: известно много солей.
Большинство солей AgI малорастворимо в воде. Например: Ag3PO4 (желтый), Ag3AsO4 (желтый), Ag3AsO3 (шоколадно-коричневый). Это используют в аналитической химии для обнаружения анионов (см. Галогениды серебра ! ).
Растворимые соли: AgNO3, AgClO4, AgF, Ag(SO3R), …
AgNO3 – ляпис («адский камень» - оставляет на коже черные пятна, прижигает кожу).
Применение: неорганический и органический синтез, аналитическая химия, бактерицид, для серебрения зеркал и пр.
Хорошо растворим в воде, спиртах, ацетоне, жидком аммиаке, аминах, ацетонитриле, пиридине.
AuI: простые соли кислородсодержащих кислот неизвестны.
Причины:
- очень сильное поляризующее действие («мягкий» катион, склонен сочетаться с «мягкими» анионами и лигандами: I-, S2-, RS-, R3P…)
- склонность к диспропорционированию: 3 AuI AuIII + 2 Au
- очень высокий окислительно-восстановительный потенциал: Eo (Au+/Au) = 1,69 В
б) Степень окисления +2.
CuII : известно много солей.
Координационное число Cu2+ - 6 (реже 4), геометрия – октаэдр (обычно искаженный).
Причина искажения – эффект Яна-Теллера:

(выигрыш в энергии по сравнению с идеальной октаэдрической конфигурацией комплекса)
Различие в цвете объясняют разной силой лигандов (SO42- менее поляризуем, чем H2O ).
Cu(H2O)62+ + 4 NH3 [Cu(NH3)4(H2O)2]2+ + 4 H2O (гексааммин меди (II) неустойчив!)
голубой сине-фиолетовый
SO42- < H2O < NH3 (сила лигандов, величина ЭСКП)
CuSO4 (бесцветный) + 5 H2O CuSO45H2O (сине-голубой).
Обратная реакция ступенчато протекает при нагревании и завершается при 258оС.
Cu(NO3)2 – синие кристаллы, хорошо растворим в воде с образованием кристаллогидратов.
Безводную соль получают следующим способом:
Cu + 3 N2O4
![]() NO+[Cu(NO3)3]-
+ 2 NO;
NO+[Cu(NO3)3]-
+ 2 NO;
NO+[Cu(NO3)3]-
![]() Cu(NO3)2
+ 2 NO2.
Cu(NO3)2
+ 2 NO2.
При попытке обезводить кристаллогидрат нагреванием происходит его гидролиз (вспомните свойства AlCl3): образуются основные соли, например Cu2(OH)3NO3.
Ацетат меди (II) [Cu(CH3COO)2H2O]2 – темно-синевато-зеленые кристаллы; хорошо растворим в воде, спиртах, ацетоне, пиридине (при этом замещаются лабильно координированные молекулы воды).
Структура молекулы напоминает «китайский фонарик» (см. рис.).
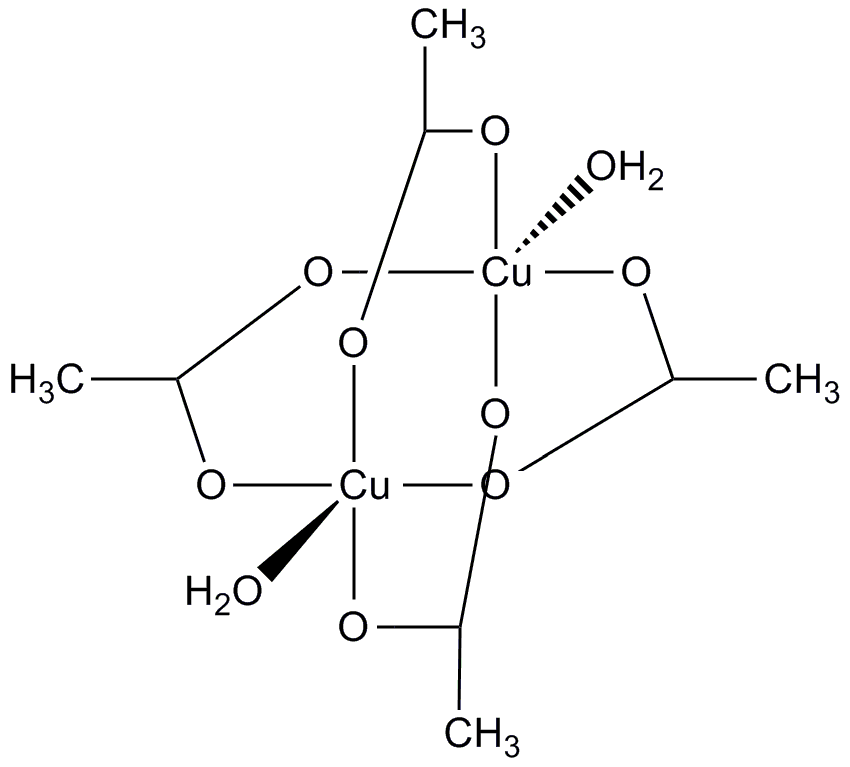
Нет однозначного мнения по поводу наличия связи Cu-Cu в этой молекуле. Соединение диамагнитно.
Карбонат меди (II) в растворе синтезировать невозможно по причине взаимоусиления гидролиза ионов меди (II) и карбоната:
2Cu2+ + 2 CO32- + H2O Cu2(OH)2CO3 + CO2
малахит, «горная зелень»
? Приведите области применения малахита.
AgII:
ионы Ag2+ характеризуются очень сильными окислительными свойствами, окисляют воду (Eo(Ag2+/Ag+)=2,00 В в 4 М HClO4), поэтому простые соли практически неизвестны.
Достоверно описан только Ag(SO3F)2 (синтезируют в отсутствие воды) – очень сильный окислитель, разлагается водой; имеются неподтвержденные сведения о получении других солей. Считают, что ион Ag2+ является интермедиатом в реакциях окисления различных соединений персульфат-ионами при катализе Ag+.
Серебро (II) можно стабилизировать в комплексных соединениях с гетероциклическими аминами, например, с пиридином: [Ag(C5H5N)4](NO3)2 – оранжево-красные кристаллы, в растворе окисляет Mn2+ до MnO4-.
AuII: соли неизвестны, так как происходит диспропорционирование:
2 AuII AuIII + AuI.
в) Степень окисления +3.
CuIII, AgIII – не дают солей кислородсодержащих кислот (очень сильные окислительные свойства!).
AuIII: простые соли не удается выделить из-за гидролиза, комплексообразования и восстановления до металла; нередко выделяют комплексные кислоты:
Au(OH)3 + 4 HNO3 H[Au(NO3)4] + 3 H2O.
Описан селенат золота (III) Au2(SeO4)3 – желтое мелкокристаллическое вещество; возможно, за селенат золота принимали смесь оксоселенитов вида Au2O(SeO3)2, образующихся при растворении металла в горячей (200оС) концентрированной селеновой кислоте.
Опыты.
(3) Восстановление соединений серебра (I). Качественная реакция на ионы Ag+. Получение серебряного зеркала.
В тщательно обезжиренную пробирку налейте раствор AgNO3 и добавляйте по каплям 2 М раствор аммиака, встряхивая пробирку после прибавления каждой капли, пока выпавший осадок не растворится. (следует избегать избытка NH3.) Затем к раствору прилейте 10%-ный раствор глюкозы в объеме, равном содержимому пробирки. Смесь хорошо перемешайте. Пробирку опустите в стакан с водой, нагретой до кипения. Объясните появление блестящего слоя серебра на внутренней поверхности пробирки.
Содержимое пробирки вылейте в банку для серебряных остатков. По окончании опыта слой серебра растворите в разбавленной азотной кислоте. Раствор также слейте в банку для серебряных остатков. Составьте уравнения реакций.
(4) Получение и распад гидроксида меди (I).
Н раствору сульфата меди (II) прилейте избыток раствора щелочи и глюкозы. Смесь хорошо перемешайте и затем нагрейте. Объясните образование желто-оранжевого осадка и его последующее превращение при более сильном нагревании в красный осадок. Составьте уравнения реакций, имея в виду, что глюкоза превращается в глюконовую кислоту:
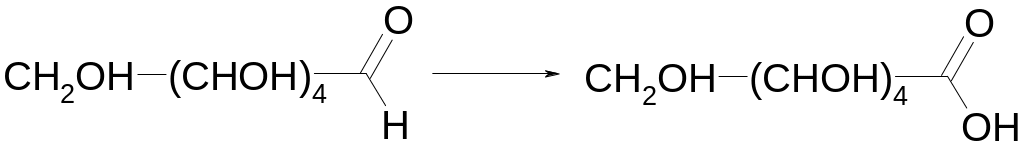
(5) Свойства гидроксида меди (II).
Получите гидроксид меди (II). Исследуйте его отношение к нагреванию, растворам кислот, аммиака и концентрированному раствору щелочи при нагревании. Составьте уравнения реакций.
(6) Гидратация сульфата меди (II).
К порошку CuSO4 в стакане прилейте несколько капель воды. Объясните наблюдаемое изменение окраски. В стакан прилейте воду до растворения соли.
