
12 Понятие кругового процесса. Термический кпд, холодильный коэф-т.
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (см.рис. a). Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1–2) и сжатия (2–1) газа. Работа расширения A1 (определяется площадью фигуры 1 a 2 V1 V2 2) положительна (dV>0)), работа сжатия A2 (определяется площадью фигуры 1 a 2 V1 V2 2) отрицательна (dV<0), Следовательно, работа A= A1+ A1, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Если за цикл совершается положительная работа A>0 (цикл протекает по часовой стрелке), то он называется прямым (рис., а), если за цикл совершается отрицательная работа A<0 (цикл протекает против часовой стрелки), то он называется обратным (рис. b).
Прямой цикл используется в тепловых двигателях – периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах -периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю (D U = 0). В общем случае при протекании кругового процесса система может теплоту как получать Q1, так и отдавать Q2, поэтому теплота, полученная системой Q равна Q = Q1– Q2
Поэтому из первого начала термодинамики для кругового процесса (когда D U = 0) получаем, что работа за цикл равна
А = Q1– Q2
т. е. работа, совершаемая за цикл, равна разности количества полученной извне теплоты Q1 и отданной системой Q2. Поэтому коэффициент полезного действия для кругового процесса (к. п. д.)
![]()
Это термический кпд, он показывает, какая доля от подводимой теплоты преобраз. в работу.
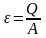
Холодильный коэф-т показывает, сколько единиц теплоты отбирается у низкопотенциального источника на единицу затрачен работы.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении; причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
13. Цикл Корно.
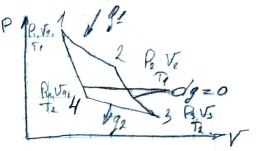
Рабочие тело с начальными координатами в т1 вводиться в соприкосновение с нагревателем имеющую постоянную температуру и получает от него теплоту в кол Q1 при этом изотермически (Т) расширяется до состояния 2. Дальнейшее расширение рабочего тела происходит только за счет изменения внутренней энергии, при этом температура в т3 понижается. В т3 рабочие тело контактирует с холодильником имеющим пост. темп. И отдает ему теплоту в количестве q2, совершая при этом работу сжатия. Параметр т4 подбирается таким образом что бы цикл завершился адиабатным сжатием. ŋt=1-TminTmax, п1-2: q1=RT1*lnV2V1, п3-4: q2=RT2*lnV4V3, п2-3: T2T1=(V2V3)k-1, п4-1: T2T1=(V1V2)k-1. Термический КПД цикла Корно не зависит от вс-в рабочего тела, а зависит только от абсолютных температур, нагревателя и холодильника, при этом КПД тем выше, чем выше температура нагревателя или ниже темп. Холодильника. Но КПД всегда меньше 1 т.к. в обратном случае потребовалось бы Тmax=∞ или Тmin=0 град, что недостижимо. Термический КПД цикла Корно является критерием эффективности любого теплового цикла совершаемого в заданном интервале темп.. На практике цикл Корно не используется из-за низкой теплопроводности газов и наличия трения в реальных механизмах, что существенно понижает КПД цикла.
14.
Второй закон термодинамики, его сущность
и определения.
Определяет направление процесса и
максимальную работу которая может быть
совершена тепловыми двигателями.
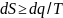 ,
dS-Элементарное
преращение энтропии системы. q-теплота
участвующая в процессе и подводимая
от источника к системе, Т-абсолютная
температура источника теплоты. Знак
равенства в уравнении соответствует
обратимым процессам, а знак неравенства
к необратимым.
,
dS-Элементарное
преращение энтропии системы. q-теплота
участвующая в процессе и подводимая
от источника к системе, Т-абсолютная
температура источника теплоты. Знак
равенства в уравнении соответствует
обратимым процессам, а знак неравенства
к необратимым.
Формулировки закона: 1) Вся теплота теплота переданная источником не может перейти в работу т.к. часть теплоты должна быть отдана холодильнику. 2) теплота не может переходить от менее нагретого тела к более нагретому без совершения работы. 3) Осуществление вечного двигателя 2го рода невозможно.
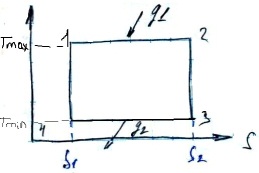
В природе все процессы являются необратимыми, а наиболее близко к обратимому процесс конденсации парообразования. dq=TdS – для обратимого процесса. q=S1S2TdS. Колличество теплоты определяется по площади под кривой процесса изобарного в TS координатах, при этом если энтропия увеличиться S2>S1, то теплота подводиться, а если энтропия уменьшается S2<S1, то теплота отводиться.
