
15. Математич-е выр-я 2го з-на тд.
2й з-н опред-т напр-е процесса, устан-т условия преобр-я тепловой эн-ии в мех-ю и опред-т мах знач-е работы, кот-я м.б. совершена тепловым двиг-м. ds≥dQ/T, ds – элемент. прирощ.энтропии сис-ы; dQ – элем-е кол-во тепла, получ-е сис-й от источника; Т – абсол-я темп-а источника тепла. Формулировки: 1) постулат Клаузиуса: теплота не может перех-ть от холод-го тела к более нагретому даровым процессом без конденсации. 2)п.Томпсона: не вся теплота, пол-я от теплоотдатчика может перейти в работу, т.к. часть теплоты должна перейти в теплоприемник. 3)п.Освальда: невозм-о созд-е вечного дв-ля 2го рода. Нельзя постр-ть такой дв-ль, кот-й только охлаждал источник тепла, т.к. часть подвод-й эн-и отвод-ся д/нагрева холод-ка. TdS≥dQ, dQ=du+dL, TdS≥du+dl – объед-е Ур-е 1го и 2 з-нов ТД. В этих выр-ях знак ≥ соотв-т необрат-м процессам, ≥ - обратимым. Д/того, чтобы процесс был обр-м или равновесным необх-мо, чтобы Р и t раб тела во всей его массе были бы одинаковы на любом участке процесса. все реальные процессы явл-ся необрат-и. Обр-й процесс яв-ся идеальным, к кот-му стрем-ся все реальные процессы. Из действ-х пр. наиболее близкими к обрат-м явл-ся испарение и конденсация.
16 Энтропия. Вывод расчетного уравнения. Ts- диаграмма
Получим формулу для вычисления разности энтальпий dq = cvdT + pdυ. Разделим данное ура-ние на абс температуру dq/T = cvdT/T + (pdυ/T)υ/ υ
dq/T = cv dT/T + Rdυ/υ → dS = dq/T, обозначается для 1 кг газа через S и измеряется в Дж/(кг-К).Для произвольного количества газа энтропия, обозначаемая через S, равна S = Мs и измеряется в Дж/К.
Таким образом, аналитически энтропия определяется следующим образом: dS = dq/T (1). Формула справедлива как для идеальных газов, так и для реальных тел.
Значение энтропии для заданного состояния определяется интегрированием уравнения
S = ∫ dq/T + s0, где s0 константа интегрирования.
при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к, нулю, т. е. sо = 0 при T = 0 К.
cυ = const, s1 – s2 = cυ ln (T2/T1) – R ln (υ2/υ1)
Из уравнения Клапейрона, записанного для состояний 1 и 2, получим следующие формулы для изменения энтропии идеального газа:
s1 – s2 = cp ln (T2/T1) – R ln (p2/p1); s1 – s2 = cυ ln (p2/p1) – cp ln (υ2/υ1)
Поскольку энтропия есть функция состояния рабочего тела, уравнениями можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет.
Из уравнения (1) следует, что в равновесном процессе δq = Tds (2) q = ∫ Tds (3)
Очевидно, что в Т-5-диаграмме элементарная теплота процесса δq изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула (2) показывает, что ds и δq имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (δq >0) его энтропия возрастает ds > 0, а при отводе теплоты (δq < 0) – убывает ds < 0.
П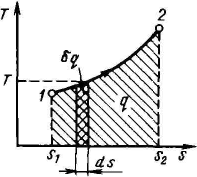 онятие
энтропии позволяет ввести чрезвычайно
удобную для термодинамических расчетов
Т-s
диаграмму,
на которой (как и на р-V-диаграмме)
состояние термодинамической системы
изображается точкой, а равновесный
термодинамический процесс линией.
онятие
энтропии позволяет ввести чрезвычайно
удобную для термодинамических расчетов
Т-s
диаграмму,
на которой (как и на р-V-диаграмме)
состояние термодинамической системы
изображается точкой, а равновесный
термодинамический процесс линией.
графическое изображение теплоты в T-s-координатах
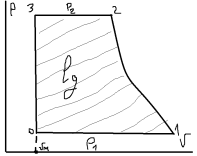
17. Цикл одноступенчатого компрессора. Компрессор – машина предназначенная для сжатия газов. Подразделяются на одно и много ступенчатые, поршневые и центробежные, но термодинамика процессов сжатия в них одинакова.
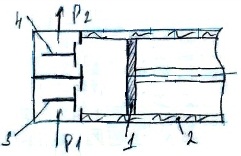
Работа
затрачиваемая на привод компрессора,
преобразуется в потенциальную энергию
сжатого газа и в теплоту. Открывается
клапан (3) и в рабочий объем компрессора
с водоохл. Стенками (2) поступает газ с
начальным давлением Р1 (0-1). 0-1 не является
изотермическим процессом т.к. параметры
рабочего тела не изменяются. Поршень
(1) движется в лево и рабочий цилиндр
сжимается до необходимого давления Р2
(1-2). Открывается клапан (4) и сжатый газ
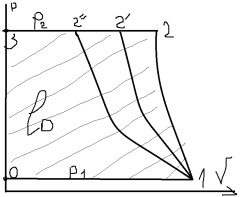
подается потребителю (2-3). 1-2”
– изотермический процесс при Т=const.
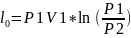 .
1-2 – адиабатный процесс S=const.
.
1-2 – адиабатный процесс S=const.
 .
1-2’ – политропный процесс c=const.
.
1-2’ – политропный процесс c=const.
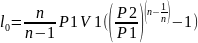 ,
1<n<k.
Теоретическая мощность для привода
двигателя компрессора
,
1<n<k.
Теоретическая мощность для привода
двигателя компрессора
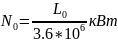 .
L0=l0*m
Дж. m-масса
или расход вещества. На практике исп.
Процесс близкий к политропному приэтом
показатель политропы стараются
приблизить к 1. В реальных компрессорах
присутствует вредное пространство
потери давления во впускном и
нагнетательном клапоне, а также
теплообмен между газом и стенками
цилиндра.
.
L0=l0*m
Дж. m-масса
или расход вещества. На практике исп.
Процесс близкий к политропному приэтом
показатель политропы стараются
приблизить к 1. В реальных компрессорах
присутствует вредное пространство
потери давления во впускном и
нагнетательном клапоне, а также
теплообмен между газом и стенками
цилиндра.
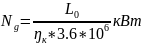 .
VМ-мертвый
объём.
.
VМ-мертвый
объём.
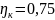 -эффективный
КПД копрессора кот. учитывает мертвый
объем, трение, теплообмен.
-эффективный
КПД копрессора кот. учитывает мертвый
объем, трение, теплообмен.
