
- •Внутренняя энергия 1 атомного газа.
- •Способы изменения внутренней энергии
- •Работа совершаемая идеальным газом при его расширении.
- •Первое начало термодинамики
- •Применение первого начала термодинамики к изо процессам
- •Второе начало термодинамики
- •Тепловые двигатели
- •13. Способы соединения проводников
- •14. Работа тока
- •17. Электричество в газах.
Внутренняя энергия 1 атомного газа.
WpΣ=0 ΣEп=0
Для идеального газа WpΣ=0. Поэтому внутренняя энергия U идеального газа складывается из кинетических энергий хаотического, теплового движения его молекул:
Если 1 атомный газ содержит N молекул, каждая из которых обладает в среднем кинетической энергии <Wк>=3/2 кг , то внутренняя энергия этого газа равна:
U=N<Wк>m/M*NA*3/2*kT=3/2*m/M*RT=3/2*PV
U=3/2*m/M*RT
U=3/2*PV
Способы изменения внутренней энергии
Теплообмен- самопроизвольный, необратимый процесс передачи энергии от более нагретых тел к менее нагретым без совершения работы.
Теплопроводность- передача энергии от более нагретых частей тел к менее нагретым, приводящая к выравниванию температуры.
Конвекция- обмен энергией между движущимся неравномерно нагретыми частями газов или жидкостей. Ее интенсивность зависит от разности температуры между слоями и вязкости среды.
Излучение- передача энергии без непосредственно контактов тел, обменивающихся энергией.
Расчет изменения внутренней энергии для различных процессов
-
ПРОЦЕСС
ФОРМУЛА
ПРИМЕЧАНИЕ
Нагревание и охлаждение
ΔU=cmΔT
c-удельная теплоемкость тела
Плавление или кристаллизация
ΔU=±λm
λ- удельная теплота плавления
Парообразование или конденсация
ΔU=±rm
r- удельная теплота парообразования
Сгорание
ΔU=qm
q- удельная теплота сгорания
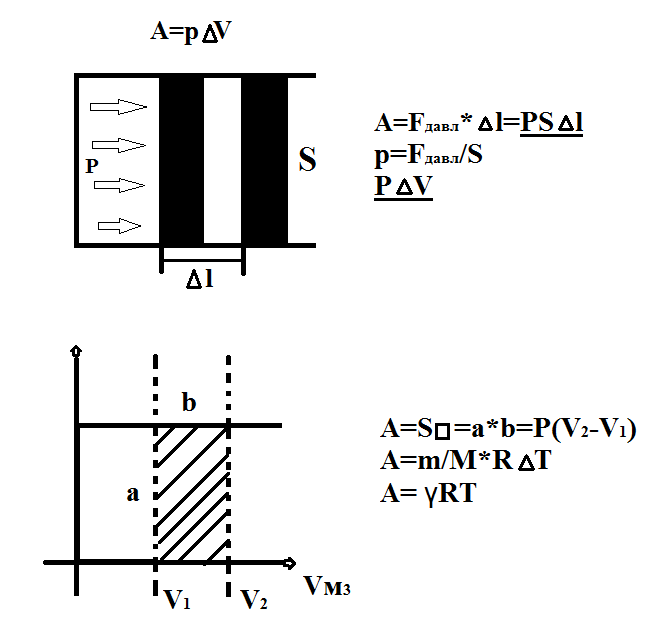
Работа совершаемая идеальным газом при его расширении.
Если газ, расширяясь передвигает поршень на расстояние Δl, то он производит над ним работу.
A=FΔl=pSΔl=Pδv
Работа при расширении газа (ΔV>0),
работа при сжатии отрицательна (ΔV<0).
Выражение справедливо при любых
изменениях объема твердых, жидких и
газообразных тел. (S-площадь
поршня; p-давление; SΔl=Δl-
изменение объема системы)
Первое начало термодинамики
Это закон сохранения и превращение энергии применительно к термодинамическим процессам
Q=ΔU+A’
Количество теплоты переданное системе идет на увеличение внутренней энергии этой системы и совершения работы этой системой (газа).
A’- работа самого газа над внешними телами A’>0, т.к u↑
A- работа над газом
A<0, т.к u↓
A’=A
Применение первого начала термодинамики к изо процессам
-
ПРОЦЕСС
Условие протекания процесса
(Q=ΔU+A) применимо к изо процессу
Изотермическое расширение
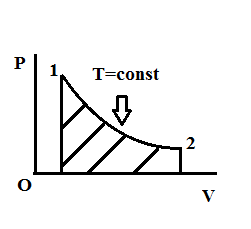
Q=A
Изотермическое сжатие

Q=A
Изохорное охлаждение

Q=ΔU
Изохорное нагревание

Q=ΔU
Изобарное расширение
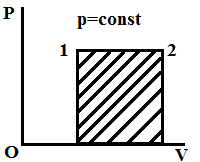
Q=ΔU+A
Изобарное сжатие
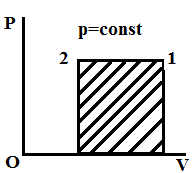
Q=ΔU+A
Адиабатное расширение
ΔQ=0
A’=-ΔU
Понятие о вечном двигателе. Это воображаемый механизм, который безостановочно движ-ся и совершает работу не потребляя при этом энергии из вне:
A’=-ΔU- вечный двигатель первого рода не возможен, т.к нельзя бесконечно совершать работу за счет бесконечной внутренней эгергии.
