
Основные Положения Молекулярно-Кинетической Теории (Опытное Обоснование)
В основе молекулярно-кинетической теориистроения вещества лежат три положения:
Все тела состоят из частиц (атомов, молекул, ионов и др.);
Частицы непрерывно хаотически движутся;
Частицы взаимодействуют друг с другом.
Первое положение подтверждают испарение жидкостей и твердых тел, получение фотографий отдельных крупных молекул и групп атомов, косвенные измерения масс и размеров молекул.
Капля нефти объемом 1,0 мм3 может образовать на поверхности воды пленку площадью 3,0 м2. Полагая, что эта пленка является монослоем и имеет толщину в одну молекулу, получаем диаметр молекулы
Массы атомов и молекул определяют по формуле
где М - молярная масса, NA- постоянная Авогадро.
Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравнивают с 1/12 массы атома углерода (углеродная шкала атомных масс).
Относительной молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) m0 данного вещества к 1/12 массы атома углерода m0c:
Относительные атомные массы всех химических элементов точно определены. Складывая относительные атомные массы, можно вычислить относительную молекулярную массу:
Чем больше атомов и молекул содержится в макроскопическом теле, тем больше вещества содержится в нем. Число молекул в макроскопических телах огромно, поэтому удобно указывать не абсолютное число атомов или молекул, а относительное. Принято сравнивать число молекул или атомов в данном теле с числом атомов, содержащихся в углероде массой 12 г. Относительное число атомов или молекул в теле характеризует особая физическая величина - количество вещества.
Количеством вещества v называют отношение числа молекул N в данном теле, к числу атомов в 0,012 кг углерода:
Количество вещества измеряется в молях.
Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде массой 0,012 кг.
Моль - основная единица Международной системы (СИ). Рекомендуемые кратные и дольные единицы: кмоль, ммоль, мкмоль.
Постоянная Авогадро - число атомов, молекул (структурных элементов) в одном Моле вещества: NA= 6,02 • 1023 моль-1 ~ 6 • 1023 моль-1.
Наряду с относительной молекулярной массой Мr в физике и химии широко используется понятие "молярная масса". Молярной массой вещества называют массу вещества, взятого в количестве 1 моля, m - масса вещества.
Второе положение МКТ о непрерывном движении частиц подтверждают такие явления, как броуновское движение и диффузия.
Броуновское движение - беспорядочное движение малых частиц в жидкости или газе, происходящее под действием молекул окружающей среды.
Это движение в 1827 г. впервые наблюдал английский ботаник Р. Броун, рассматривая в микроскоп взвешенные в воде споры плауна. Интенсивность броуновского движения не зависит от времени, но возрастает с ростом температуры среды, с уменьшением вязкости и размеров частиц. Лишь в конце 70-х гг. XIX в. причину броуновского движения стали связывать с ударами молекул жидкости о поверхность взвешенной в ней частицы. Если бы частица была большой, то молекулы равномерно толкали бы ее со всех сторон, и она оставалась бы на месте.
Но небольшая частица имеет маленькую поверхность, и толчки молекул не уравновешивают друг друга. Равнодействующая сил не равна нулю, и в течение времени меняется по величине и направлению. В результате частица блуждает случайным образом по жидкости:
Причина броуновского движения - тепловое движение молекул среды и отсутствие точной компенсации ударов, испытываемых частицей со стороны окружающих ее молекул. Удары молекул среды приводят частицу в беспорядочное движение: скорость ее меняется по величине и направлению.
Первая количественная теория броуновского движения была разработана в 1905 г. А. Эйнштейном (1879-1955) и М. Смолуховским (1872-1917).
Экспериментально подтвердил эту теорию французский физик Ж. Перрен (1870-1942).
Вследствие теплового движения частиц наблюдается явление диффузии, которое характеризуется проникновением молекул одного вещества между молекулами другого вещества при их соприкосновении.
Диффузия имеет место в газах, жидкостях и твердых телах. Наиболее быстро диффузия происходит в газах, медленнее - в жидкостях, еще медленнее - в твердых телах. Скорость диффузии определяется характером теплового движения частиц в этих средах.
Диффузия играет существенную роль в природе. Так, например, диффузия газов обеспечивает однородность атмосферы вблизи поверхности Земли. Диффузия способствует нормальному питанию растений, животных и т. д.
Подтверждением третьего положения МКТ о взаимодействии частиц является возникновение упругих сил при деформациях тел, существование различных агрегатных состояний (твердого, жидкого, газообразного) одного и того же вещества.
Идеальный Газ
Введем ограничения, которые свойственны любой физической теории.
Идеальный газ - модель реального газа, которая удовлетворяет следующим требованиям:
Расстояние между молекулами гораздо больше их размеров (молекулы можно считать материальными точками);
Силами взаимодействия, кроме моментов соударения, можно пренебречь (потенциальная энергия взаимодействия молекул по сравнению с кинетической энергией хаотического движения пренебрежимо мала);
Столкновение молекул друг с другом и со стенками абсолютно упругое;
Движение каждой молекулы подчиняется классическим законам динамики Ньютона.
Реальный разреженный газ приблизительно ведет себя как идеальный газ.
Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
![]()
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
![]()
можно записать:
![]()
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
Уравнение состояния идеального газа устанавливает взаимосвязь между макроскопическими параметрами р, V, Т, характеризующими состояние данной массы газа т.
В 1834 г. французский ученый Клапейрон (1799 - 1864) получил уравнение для постоянной массы газа:
![]()
В 1874г. Д.И.Менделеев (1834-1907) получил уравнение состояния идеального газа для произвольной его массы: pV = (m/M)RT, оно носит название уравнения Менделеева-Клапейрона, где m - масса газа, R - универсальная газовая постоянная, равная 8,31 Дж/(мольК).

Абсолютная влажность(р) - парциальное давление водяных паров, содержащихся в воздухе, или количество водяных паров, содержащихся в 1 м3воздуха, выраженного в граммах.
Абсолютный нуль температур - температура, при которой прекращается тепловое движение молекул.
Агрегатное состояние вещества - состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразным изменением ряда физических свойств.
Аморфные тела - твердые тела, не имеющие упорядоченного, периодического расположения частиц в пространстве.
Анизотропия - неодинаковость физических свойств среды в различных направлениях, связанная с внутренним строением сред.
Атом - наименьшая часть химического элемента, являющаяся носителем его свойств.
Броуновское движение - беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием молекул.
Влажность (кг/м3) - содержание водяного пара в воздухе.
Внутренняя энергия идеального одноатомного газа - суммарная кинетическая энергия теплового движения атомов газа.
Внутренняя энергия тела (U) - сумма энергии хаотического (теплового) движения всех микрочастиц тела (молекул, атомов, ионов и т. д.) и энергии взаимодействия этих частиц.
Деформация - изменение формы или размеров тела (или части тела) под действием внешних сил (механических нагрузок) при нагревании, охлаждении, изменении влажности и других воздействиях, вызывающих изменение относительного расположения частиц тела.
Динамическое равновесие - процесс, при котором скорость парообразования равна скорости конденсации.
Диффузия - взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Жидкости сохраняют свой объем и принимают форму сосуда.
Закон Бойля-Мариотта. Для газа данной массы произведение давления на его объем постоянно, если его температура не меняется.
Закон Гей-Люссака. Для данной массы газа отношение его объема к абсолютной температуре постоянно, если давление газа не меняется.
Закон Гука. Относительное удлинение прямо пропорционально механическому напряжению.
Закон Шарля. Для данной массы газа отношение его давления к абсолютной температуре постоянно, если его объем не меняется
Идеальный газ - модель, в которой не учитывается взаимодействие частиц и их собственный объем. Соударение частиц происходит по закону упругого взаимодействия.
Изобарический процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении.
Изопроцесс - процесс, протекающий в термодинамической системе с неизменной массой при постоянном значении одного из параметров состояния.
Изотермический процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре.
Изохорический процесс - процесс изменения состояния термодинамической системы при постоянном объеме.
Испарение - парообразование со свободной поверхности жидкости при любой температуре.
Кипение - процесс парообразования внутри и с поверхности жидкости при температуре кипения.
Количество вещества - отношение числа молекул в данном теле к числу атомов в 0,012 кг углерода.
Коэффициент полезного действия теплового двигателя (КПД, n) - физическая величина, определяемая отношением работы А, совершенной тепловым двигателем за один цикл, к количеству теплоты Q1, полученной от нагревателя.
Кристаллические тела - твердые тела, имеющие упорядоченное, периодическое расположение частиц в пространстве.
Критическая температура - температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным паром.
Молекула - наименьшая частица данного вещества, обладающая его основными химическими свойствами.
Молекулярно-кинетическая теория объясняет свойства макроскопических тел и тепловых процессов, протекающих в них, на основе представлений о том, что все тела состоят из отдельных беспорядочно движущихся частиц.
Моль (v) - количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг.
Молярная масса (n) - масса одного моля вещества.
Молярная теплоемкость (с) - физическая величина, показывающая, какое количество теплоты требуется для изменения температуры 1 моля вещества на 1 °С (1 К).
Насыщенный пар - пар, находящийся в термодинамическом равновесии с жидкостью того же состава.
Ненасыщенный пар - пар, находящийся при давлении ниже давления насыщенного пара.
Необратимый термодинамический процесс - процесс, который самопроизвольно может протекать только в одном направлении.
Обратимый термодинамический процесс - термодинамический процесс, который может происходить как в прямом, так и в обратном направлении, причем система возвращается в исходное положение, а в окружающей среде и самой системе не происходит никаких изменений.
Относительная влажность (f, ф) - отношение парциального давления р водяного пара так же, как содержащегося в воздухе при данной температуре к парциальному давлению р0 насыщенного пара при той же температуре, выраженное в процентах.
Парообразование - процесс перехода вещества из жидкого или твердого состояния в газообразное.
Первый закон термодинамики (первая формулировка). Изменение внутренней энергии тела (системы) при переходе из одного состояния в другое равно сумме совершенной над телом работы и полученного им количества теплоты.
Первый закон термодинамики (вторая формулировка). Количество тепла, полученного телом (системой) расходуется на изменение внутренней энергии системы и на работу против внешних сил.
Плавление - процесс перехода вещества из твердого (кристаллического) состояния в жидкое.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов равны.
Пластическая (остаточная) деформация - деформация, не исчезающая после прекращения действия внешних сил.
Пластичность - свойства твердых тел под действием внешних сил изменять, не разрушаясь, свою форму и раз4 меры и сохранять остаточные деформации после прекращения действия этих сил.
Полиморфизм - способность твердых тел существовать в двух или нескольких кристаллических структурах.
Постоянная Авогадро (NA) - количество структурных элементов (атомов, молекул, ионов или других частиц) в одном моле вещества.
Предел пропорциональности (бпроп) - максимальное напряжение, при котором еще выполняется закон Гука.
Предел прочности (бпр) - наибольшее напряжение, возникающее в теле перед началом его разрушения.
Предел упругости (бупр) - напряжение, при котором тело полностью утрачивает упругость.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и объема при постоянной температуре.
Температура (Т, t°) - величина, характеризующая состояние термодинамического равновесия макроскопической системы и пропорциональная средней кинетической энергии частиц системы.
Температура кипения - температура жидкости, при которой давление ее насыщенного пара равно или превышает внешнее давление.
Температура плавления - температура, при которой кристаллическое вещество плавится.
Тепловое движение - беспорядочное (хаотическое) движение микрочастиц, из которых состоят все тела.
Тепловой двигатель - устройство, в котором осуществляется преобразование внутренней энергии топлива в механическую.
Теплоемкость тела (С) - количество теплоты, которое нужно сообщить данному телу, чтобы повысить его температуру на один градус.
Теплопередача - процесс изменения внутренней энергии без совершения работы над телом или самим телом.
Теплопроводность - передача тепла в телах, не сопровождаемая перемещением составляющих их частиц. При теплопроводности перенос энергии осуществляется в результате непосредственной передачи энергии от частиц (молекул, атомов, электронов), обладающих большей энергией, частицам с меньшей энергией.
Термодинамические параметры - физические величины, которые служат в термодинамике для характеристики состояния рассматриваемой системы.
Термодинамическое равновесие - состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды.
Термометр - прибор для измерения температуры посредством контакта его с исследуемой средой.
Удельная теплоемкость (с) - физическая величина, показывающая, какое количество теплоты требуется для изменения температуры вещества массой 1 кг на 1 °С.
Удельная теплота парообразования (L) - величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Удельная теплота плавления (А) - физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления перевести его в жидкое состояние.
Упругая деформация - деформация, полностью исчезающая после прекращения действия внешних сил.
Упругость - свойство тел восстанавливать свою форму и объем после прекращения действия внешних сил и других причин, вызывающих деформацию тел.
Уравнение состояния идеального газа. Для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная.
Хрупкость - способность твердых тел разрушаться при механических воздействиях без заметной пластической деформации.
Второй Закон Термодинамики. Тепловой Двигатель
Второй закон термодинамики указывает направление возможных энергетических превращений. Английский физик У. Томсон в 1851 г. сформулировал закон: в природе невозможен процесс, единственным результатом которого была бы механическая работа, полученная за счет охлаждения теплового резервуара. Эта формулировка показывает, что взаимное превращение тепла и работы неравноценно: работу можно полностью "превратить" в тепло (путем трения, нагрева электрическим током и другими способами), а тепло полностью превратить в работу нельзя.
Чуть раньше У. Томсона формулировку второго закона в 1850 г. дал немецкий физик Р. Клаузиус (1822-1888): "Теплота не переходит самопроизвольно от холодного тела к более горячему". Эта формулировка подчеркивает односторонность реальных процессов.
Р. Клаузиус решил вопрос о направлении самопроизвольных процессов в 1865 г., когда ввел новую функцию - энтропию, установив ее важнейшую особенность: в нетеп-лоизолированных системах самопроизвольно процессы идут в сторону увеличения энтропии; в состоянии теплового равновесия энтропия достигает максимума. Эта функция является мерой беспорядка в системе. Таким образом, самопроизвольные процессы идут в сторону увеличения беспорядка.
Необратимые процессы - процессы, которые могут самопроизвольно протекать только в одном направлении. Систему, в которой происходят необратимые процессы, нельзя вернуть в исходное состояние без того, чтобы в окружающей среде не осталось каких-либо изменений.
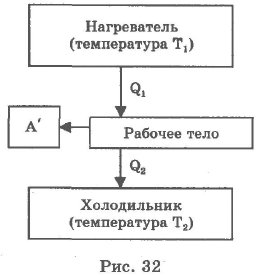
Тепловой двигатель - устройство, в котором осуществляется преобразование внутренней энергии топлива в механическую энергию. Тепловой двигатель содержит три основные части: нагреватель, рабочее тело, холодильник.
Общая блок-схема теплового двигателя представлена на рис. 32. Чаще всего рабочими телами, совершающими работу в тепловых двигателях, являются газ или пар.
За один цикл работы рабочее тело получает от нагревателя количество теплоты Q1. Расширяясь, оно совершает работу А` и часть количества теплоты Q2 передает холодильнику: Q1 = А` + Q2.
Охладителем у большинства тепловых двигателей является окружающая среда (атмосфера).
Тепло, полученное от нагревателя, рабочее тело не может полностью превратить в механическую энергию путем совершения работы. Если бы Q1 = А`, то тогда температура рабочего тела упала до О К, а это, как говорилось выше, невозможно. Если бы температура рабочего тела оказалась ниже температуры окружающей среды, то давление газа (пара) было бы меньше атмосферного и двигатель не смог бы совершать работу.
Коэффициент полезного действия теплового двигателя равен отношению работы А`, совершенной двигателем за один цикл, к количеству теплоты Q1, полученной от нагревателя:
![]()
Максимальный КПД имеет тепловой двигатель, работающий по циклу Карно, состоящему из двух изотерм и двух адиабат.
В 1824 г. С. Карно (1796-1832) доказал теорему: любая реальная тепловая машина, работающая с нагревателем, имеющим температуру Т1, и холодильником, имеющим температуру Т2, не может иметь КПД, превышающий КПД идеальной тепловой машины, определяемый соотношением :
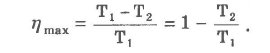
Из этой формулы следует, что чем больше разность температур нагревателя и холодильника (т. е. чем дальше в координатах Р-V отстоят друг от друга изотермы), тем больше nмах. Но КПД всегда меньше 1 (nнах < 1), так как Т2 > О.
