- •21 .Уравнение состояние идеального газа . Газовые законы. Графическое описание.
- •23.Поверхностное натяжение.Коэффициент поверхностного натяжения.Смачивание, капиллярные явления
- •24.Кристаллические тела . Кристаллизация и плавление твёрдых тел. Удельная теплота плавления.
- •25.Работа в термодинамике. Уравнение теплового баланса. Количество теплоты
- •Уравнение теплового баланса
21 .Уравнение состояние идеального газа . Газовые законы. Графическое описание.
У
Где:
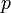 — давление,
— давление,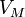 — молярный
объём,
— молярный
объём, — универсальная
газовая постоянная
— универсальная
газовая постоянная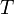 — абсолютная
температура,К.
— абсолютная
температура,К.
равнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа.
Уравнение:
![]()
Так как ![]() ,
где
,
где ![]() — количество
вещества,
а
— количество
вещества,
а ![]() ,
где
,
где ![]() —
масса,
—
масса, ![]() — молярная
масса,
уравнение состояния можно записать:
— молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом.
Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака: |
где p1, p2 и p3 – давления газа в состоянии 1, 2 и 3 (Па); V1, V2 и V3 – объемы газа в состоянии 1, 2 и 3 (м3).
- Изобарический закон в российских учебниках называется законом Гей-Люссака. Процессы можно считать изобарными, если они : проходят:в цилиндре с незакрепленным поршнем (без учета трения); в воздушных шариках при небольших растяжениях или сжатиях. Изобарный процесс (p = const; m = const): -------------------------------------------------------------------------------------------------------------------------------------------------------
— Закон Гей-Люссака где V1 и V2 – объемы газа в состоянии 1 и 2 (м3); T1 и T2 – температуры газа в состоянии 1 и 2 (К).
А
Изохорный процесс (V = const; m = const): где p1 и p2 – давления газа в состоянии 1 и 2 (Па); T1 и T2 – температуры газа в состоянии 1 и 2 (К). (К). в форме пропорции этот закон удобен для расчёта перевода газа из одного состояния в другое. Условия, как в законе Гей-Люссака(T = (t + 273) К и т.д. ). |
Условия называются нормальными, если газ находится при температуре tну = 0 ºС и давлении pну = 101325 Па ≈ 105 Па.
Абсолютная температура
T = (t + 273) К или t = (T – 273) ºС ,
где T – абсолютная термодинамическая температура (по шкале Кельвина) (К); t – температура по шкале Цельсия (ºС).
Более точно T = (t + 273,15) К. Использовать это значение будем в случае, если температуры заданы с точностью до десятых (тогда 273,2) или до сотых градуса.
Уравнение Клапейрона
При m = const:
![]() ,
,
где p1 и p2 – давления газа в состояниях 1 и 2 (Па); V1 и V2 – объемы газа в состояниях 1 и 2 (м3); T1 и T2 – абсолютная температуры газа в состояниях 1 и 2 (К).
Уравнение Клапейрона-Менделеева
![]() ,
,
где p – давление газа (Па); V – объем газа (м3); ν – количество вещества (моль); R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К); T – абсолютная температура газа (К).
Закон Дальтона
![]() ,
,
где р – давление смеси газов (Па); p1, p2, …, pn – парциальные давления отдельных газов (Па).
Парциальное давление – это давление, которое имел бы каждый из газов, составляющих смесь, если удалить из сосуда остальные газы.
Построение графиков изопроцессов
При построении любого графика можно воспользоваться следующим планом:
запишите уравнение функции, чей график мы будем строить;
определите вид графика данной функции во всех осях;
заполните таблицу значений давления, объема, температуры;
постройте график (по точкам).
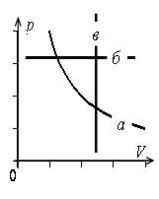
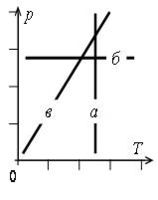
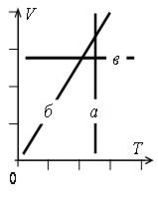
Графики изопроцессов изображены на рис. 1, где а – график изотермического процесса; б – график изобарного процесса; в – график изохорного процесса.
а |
б |
в |
22 .Фазовый переход пар-жидкость. Испарение. Конденсация .насыщенный и ненасыщенный пар. Кипение. Влажность воздуха.
Фазовый переход - переход вещества из одной фазы в другую. Различают: - фазовые переходы первого рода, при которых скачкообразно изменяются плотность, внутренняя энергия и другие термодинамические характеристики, а также выделяется или поглощается определенное количество теплоты (теплоты фазового перехода); - фазовые переходы второго рода, при которых термодинамические функции изменяются непрерывно, а теплота не выделяется и не поглощается.
Парообразование — это переход жидкости в газообразное состояние (в пар). Существует два
способа парообразования
Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава.
Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры. Когда внешнее давление падает ниже давления насыщенного пара, происходит кипение (жидкости) или возгонка (твёрдого тела); когда оно выше — напротив, конденсация или десублимация.
Ненасыщенный пар — пар, не достигший термодинамического равновесия со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
Испаре́ние — процесс перехода вещества из жидкого состояния в газообразное (пар). Процесс испарения является обратным процессуконденсации (переход из парообразного состояния в жидкое). Испарение (парообразование), переход вещества из конденсированной (твердой или жидкой) фазы в газообразную (пар); фазовый переход первого рода.
Конденса́ция — переход вещества в жидкое или твёрдое состояние из газообразного. Максимальная температура, ниже которой происходит конденсация, называется критической. Пар, из которого может происходить конденсация, бывает насыщенным или ненасыщенным.
Кипе́ние — процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества. Кипение является фазовым переходом первого рода.
Относительная влажность воздуха (RH) – это отношение количества воды, содержащейся в воздухе, к максимальному количеству воды, которое может в нем содержаться. Воздух со 100% относительной влажностью – это так называемый насыщенный воздух.