
- •Многоэлектронный атом
- •Лекция 2
- •2 Приближения
- •Среди состояний с одной двухэлектронной конфигурацией наименьшей энергией обладает состояние с наибольшей мультиплетностью.
- •Среди состояний с одной двухэлектронной конфигурацией и мультиплетностью наименьшей энергией обладает состояние с наибольшим l
- •Лекция 3
- •Строение молекул
- •Атом водорода
- •Лекция 4
- •Лекция 5
Квантовая Химия (конспект лекций)
Рябцев Александр Николаевич
Лекций 18, несмотря на праздники. Семинары – 15 (включая практ. и лаб. и 2 контрольные)
Лекция 1
С ферическая
система координат
ферическая
система координат
Сферическими
координатами называют систему
координат для отображения геометрических
свойств фигуры в трёх измерениях
посредством задания трёх координат
![]() ,
где r — расстояние до начала
координат, а θ и
,
где r — расстояние до начала
координат, а θ и
![]() —
зенитный и азимутальный угол соответственно.
—
зенитный и азимутальный угол соответственно.
Три координаты определены как:
 —
расстояние
от начала координат до заданной точки
P.
—
расстояние
от начала координат до заданной точки
P. —
угол
между осью Z
и отрезком, соединяющим начало координат
и точку P.
—
угол
между осью Z
и отрезком, соединяющим начало координат
и точку P. —
угол
между осью X
и проекцией отрезка, соединяющего
начало координат с точкой P,
на плоскость XY
(в Америке углы θ и
меняются
ролями).
—
угол
между осью X
и проекцией отрезка, соединяющего
начало координат с точкой P,
на плоскость XY
(в Америке углы θ и
меняются
ролями).
Если заданы сферические координаты точки, то переход к декартовым осуществляется по формулам:

Одноэлектронный водородоподобный атом.

![]() —
оператор
Лапласа (он же 2).
—
оператор
Лапласа (он же 2).
Перейдем к сферическим координатам (переход громоздкий, поэтому лучше заучить конечный вариант)



Произведем замену
![]()

Умножим на r2sin2

Второе слагаемое тут зависит только от φ. Перенесём его в правую часть равенства.

Равенство
возможно, когда обе части равны какой-то
постоянной величине. Обозначим её
![]() Следовательно,
Следовательно,
![]()
Решением этого уравнения являются функции
![]()
Угол
φ
может изменяться от 0 до 2π.
Функция Φ должна быть периодической с
периодом 2π.
Это возможно, только если
![]() Таким образом, из решения уравнения
Шрёдингера получаем значение одного
из квантовых чисел (конечно, из него
можно получить их все). Число ml
называется магнитным
квантовым числом.
Таким образом, из решения уравнения
Шрёдингера получаем значение одного
из квантовых чисел (конечно, из него
можно получить их все). Число ml
называется магнитным
квантовым числом.
Далее,
интегрируя квадрат модуля функции Φ от
0 до 2π
и приравнивая полученное выражение к
единице, получим, что
![]()
Далее
рассмотрим левую часть уравнения (1).
Она, конечно, равна
![]()

Разделим уравнение на sin 2θ:

После аналогичного вышеуказанному перенесению второго слагаемого в правую часть и обозначения величины, которой равны эти части, через β, получаем


Решение
этих двух последних уравнений приводит
к значениям l
и n
соответственно. Три квантовых числа в
совокупности полностью описывают
состояния электрона в атоме водорода.
Число n
называется главным
квантовым числом.
Оно может иметь значения от 1 до
![]() Число l
называется азимутальным
квантовым числом
и определяет орбитальный момент
количества движения электрона и форму
электронного облака; может иметь значения
от 0 до n
− 1
(n
здесь относится к энергетическом уровню,
на котором находится рассматриваемый
электрон).
Число l
называется азимутальным
квантовым числом
и определяет орбитальный момент
количества движения электрона и форму
электронного облака; может иметь значения
от 0 до n
− 1
(n
здесь относится к энергетическом уровню,
на котором находится рассматриваемый
электрон).
Радиальную часть волновой функции можно записать как (для атома водорода Z=1):

Магнитное
квантовое число ml
определяет проекцию орбитального
момента количества движения на выбранную
ось в магнитном поле. Эта проекция равна
![]()

![]()
a0 – боровский радиус,
![]() обобщенный
полином Лагерра степени n
− ℓ
− 1, (он определяется разными авторами
по-разному, например в предыдущей формуле
по Фларри он определен для n
+ ℓ
)
обобщенный
полином Лагерра степени n
− ℓ
− 1, (он определяется разными авторами
по-разному, например в предыдущей формуле
по Фларри он определен для n
+ ℓ
)
![]() -
сферическая гармоническая функция
степени ℓ
порядка m.
-
сферическая гармоническая функция
степени ℓ
порядка m.
Квантовые числа имеют следующие значения:
![]()
![]()
![]()
К![]() роме
того, эта волновая функция нормированна
.
роме
того, эта волновая функция нормированна
.
Угловой момент
Собственные значения для оператора углового момента:
![]()
![]()
Задача решается в сферических координатах, поскольку атом имеет сферич. Эквипот. Поверхности. нач. коорд. помещ в центр тяж. (ядро)
(помнить 5 постулатов кв. мех.)
1 Состояние сист. опис-ся волн. ф-цией, которая явл. ф-цией координат и врем.
(ВФ обладает след. св-вами: однозначность, непрерывность, дифференцируемость, конечность, квадратичная интегрируемость.)
2
Св-ва сист. описывается динамич.
оператором. (оператор должен быть
линейным

и
эрмитовым
 )
)
3 Если оператор меняет ф-цию до пост. величины, то говорят о собственной ф-цией данного оператора, а постоянная наз. соб знач.
4 Во всех случаях действует временное уравнение Шредингера.
5
(постулат о среднем)

Оператор Гамельтона переводится в сферич. координаты.
Квантовых чисел всегда столько, сколько степеней свободы у системы.
Энергия зависит только от одного кв. числа.
 ,
,
 ,
,
 ,
,
 -постоянная
Ридберга
-постоянная
Ридберга
l:

Энергетич.
состояния водородопод. ат можно
охарактеризовать диаграммой

Многоэлектронный атом

Точно не решается, поэтому пользуются различного рода приближениями
Орбитальное приближение Хартри


Приближение центросимметричного поля


0)Берем пси нулевое
1)Решаем

2)Решаем

3)
Когда
 решение
окончено
решение
окончено
Но здесь не учитывается спин электрона
Спин – собственный угловой момент электрона
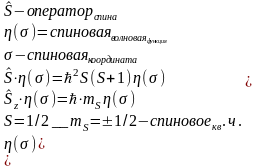
Принцип суперпозиции – если сист. описывается двумя ВФ с одинак. энерг., то система может описываться их линейной комбинацией.
 Принцип
Паули – электрон должен подчиняться
статистике Ферми-Дирака – при перестановке
координат двух электронов ВФ меняет
знак.
Принцип
Паули – электрон должен подчиняться
статистике Ферми-Дирака – при перестановке
координат двух электронов ВФ меняет
знак.

Проблема большая из-за электронного отталкивания.
Оба электрона не стоят на месте поэтому надо учитывать вероятность нахождения электрона, причем эта вероятность зависит от наличия другого электрона. Поэтому необходимо учитывать электронную корреляцию. Используют метод самосогласованного поля (ССП)
Межэлектронное отталкивание приводит к изменению энергии многоэл. атома и не сущ. формулы для этой энергии.
Спинорбитальное взаимодействие.
Спин электрона был обнар. в1921 г. в опытах Штерна – Герлаха. В 1925 ввели понятие спин.
Орбитальный момент может быть а может и не быть, оказалось что у электронов есть собственный угловой момент. Спин – это четвертая координата. Спин не имеет аналитического выражения и зависит от своих собств. коорд. Различают альфа +1/2 и бета -1/2 спиновые состояния.
Если операторы коммутируют, то эти два св-ва могут быть одновременно измерены. Проекции угл. момента не коммутируют. Коммутируют l^2 и одна из проекций.
Спинорбит. взаим. – взаим спин. угл. мом. и орб. угл. мом. электронов в атоме осуществляемое через соотв. магнитные моменты.

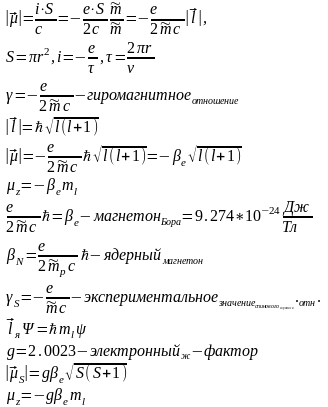
Эл. ж –фактор – безразм. полож. велич., которая вводится для того чтобы привести в соответствие эксп. знач. спинового магн. мом. с тем знач., кот. получ. при помощи классич. электродинамики.
Гамельтониан спинорбитального взаимодействия:


Поскольку пот. энергия оч. сильно зависит от заряда ядра. спинорб. взаимод. увелич. с зарядом ядра. Для легких элементов СВ мало (до 30 аем)

Оказывается, когда заходит вопр о том какую схему выбр.. если спинорб. вз. слаб, то гамильтониан коммутирует и с опер. квадр. спин и орб и полного угл. момента, но если СВ сильное, то гамильтониан коммутирует только с квадратом последнего.

Лекция 2
Орбиталь одноэлектронной пространственной ВФ.
2 Приближения
Центросимметричное поле
Приближение независимых частиц (орбитальное приближение)
Приближение Хартри
Определитель Слетера
……
Приближение j-j (сильное спинорбитальное взаимодействие в атоме)
Квантовое число – только j

Эта схема анализа используется редко из-за неинформативности
Схема Рассела-Саундерса

Для того, чтобы указать направление векторов складываем квантовые числа:


Терм состояния – символ, в котором зашифрованы основные свойства электронного состояния атома
L |
0 |
1 |
2 |
3 |
Символ терма |
S |
P |
D |
F |
Составим таблицу для атома углерода
C: 1s22s22p2
Закрытые оболочки не учитываются



ms |
ml |
2 |
1 |
0 |
-1 |
- |
|||||||||||
1 |
|
[1+,0+] |
[1+,-1+] |
[-1+,0+] |
|
||||||||||||
0 |
[1+,1-] |
[1+,0-] |
[1-,0+] |
[-1+,1-] |
[0+,0-] |
[-1-,1+] |
[-1+,0-] |
[-1-,0+] |
[-1+,1-] |
||||||||
-1 |
|
[1-,0-] |
[1-,-1-] |
[-1-,0-] |
|
||||||||||||
Анализировать таблицу нужно обязательно с крайних клеточек, поскольку максимальное знач. проекции ближе всего к значению вектора.
Правила Хунда (3)

 2
2