
- •Методические указания к лабораторным работам Введение
- •Лабораторная работа № 1. Исследование комплексных соединений
- •Общие сведения
- •Оборудование и реактивы
- •Выполнение работы Образование комплексных соединений Опыт 1. Образование и разрушение амминокомплекса серебра.
- •Опыт 2. Получение амминокомплекса никеля.
- •Опыт 3. Образование и реакции амминокомплекса меди.
- •Опыт 4. Получение комплексного основания кадмия.
- •Опыт 5. Получение тетраиодовисмутата калия.
- •Опыт 6. Получение комплексного йодида ртути.
- •Опыт 7. Образование гидроксокомплекса цинка.
- •Опыт 8. Образование и разрушение амминокомплекса никеля.
- •Опыт 9. Разрушение комплекса при разбавлении раствора.
- •Опыт 10. Разрушение комплекса при осаждении комплексообразователя.
- •Опыт 11. Комплексные соединения в окислительно-восстановительных реакциях. А. Восстановление серебра из его комплексного соединения.
- •Б. Восстановление гексацианоферрата (III) калия.
- •В. Окисление гексацианоферрата (II) калия.
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Исследование окислительно-восстановительных реакций
- •Общие сведения
- •Оборудование и реактивы
- •Опыт 9. Окислительные свойства перманганата калия в различных средах
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3. Определение эквивалентной массы металла
- •Общие сведения
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 4. Исследование скорости химических реакций и химического равновесия
- •Общие сведения
- •Оборудование и реактивы
- •Выполнение работы Опыт 1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде
- •Опыт 2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде
- •Опыт 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе
- •Опыт 4. Влияние катализатора на скорость реакции
- •Опыт 5. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных Опыт 1
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 5 Приготовление раствора и определение его концентрации
- •Общие сведения
- •Протокол лабораторной работы
- •Оборудование и реактивы
- •Выполнение работы Опыт 1. Образование малорастворимых оснований
- •Опыт 2. Растворение малорастворимых оснований
- •Опыт 3. Образование малорастворимых солей
- •Опыт 4. Изучение свойств амфотерных гидроксидов
- •Опыт 9. Смещение равновесия диссоциации слабых электролитов.
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Исследование гидролиза солей
- •Общие сведения
- •Гидролиз соли, образованной сильным основанием и слабой кислотой
- •Гидролиз соли, образованной двумя слабыми электролитами
- •Оборудование и реактивы
- •Выполнение работы Опыт 1. Гидролиз солей
- •Опыт 2. Образование основных и кислых солей при гидролизе.
- •Опыт 3. Факторы, влияющие на степень гидролиза солей. А. Влияние силы кислоты и основания, образующих соль, на степень ее гидролиза.
- •Б. Влияние температуры.
- •Г. Влияние изменения концентрации водородных ионов на гидролиз соли.
- •Опыт 4. Растворение металлов в продуктах гидролиза солей.
- •Опыт 5. Взаимное усиление гидролиза при взаимодействии растворов двух солей
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе Опыт 1.
- •Опыт 3.
- •Опыт 3в.
- •Оборудование и реактивы
- •Выполнение работы
- •I. Выбрать реактивы для приготовления буферного раствора.
- •II. Рассчитать объемы реактивов для приготовления буферного раствора.
- •III. Приготовить буферный раствор и определить его рН
- •IV. Определить буферную емкость
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Содержание протокола лабораторной работы
Опыт 1 – таблица 2. Зависимость времени реакции от количества тиосульфата натрия
Номер пробирки |
С(Na2S2O3) (относительные единицы) |
Время реакции , с |
1 |
1 (4) |
|
2 |
2 (8/4) |
|
3 |
3 (12/4) |
|
Опыт 2 – таблица 3. Зависимость времени реакции от температуры
№ п/п |
Температура, °С |
Время, , сек. |
1 |
|
|
2 |
|
|
3 |
|
|
Опыт 3 – таблица 4. Зависимость времени реакции от степени измельчения
№ пробирки |
Состав системы |
Время, , сек. |
1 |
Мел кусочком + HCl |
|
2 |
Мел в порошке + HCl |
|
Опыт 4 – таблица 5. Зависимость времени реакции от состава системы.
№ пробирки |
Состав системы |
Время, , сек. |
1 |
10 капель NH4CNS 0,5 н. 1 капля FeCl3, 0,5 н. |
|
2 |
10 капель NH4CNS 0,5 н. 1 капля FeCl3, 0,5 н. 1 капля CuSO4, 1 н. |
|
Опыт 5 – таблица 6. Зависимость положения равновесия от состава системы
№ пробирки |
Состав системы |
Добавленный реактив |
Наблюдения |
1 |
……..капель 0,0025н. FeCl3 ……..капель 0,0025 н. NH4CNS |
нет |
|
2 |
FeCl3 |
|
|
3 |
NH4CNS |
|
|
4 |
NH4Cl |
|
Обработка экспериментальных данных Опыт 1
1. Заполнить таблицу 7.
Таблица 7
Зависимость скорости реакции от концентрации тиосульфата натрия
№ пробирки |
С(Na2S2O3) (относительные единицы) |
lnCотн = ln(Ci/C1) |
Время реакции , с |
Скорость реакции v = 1/τ, с−1 |
1 |
1 |
0 |
|
|
2 |
2 |
0,693 |
|
|
3 |
3 |
1,10 |
|
|
2. По данным таблицы 7 построить график зависимости скорости реакции от концентрации тиосульфата натрия.
3. По данным таблицы 7 построить график зависимости в координатах lnCотн – . Провести линию тренда – должна быть прямая зависимость. Определить тангенс угла наклона прямой. Значение тангенса угла наклона соответствует величине константы скорости реакции.
Опыт 2
1. По данным таблицы 3 заполнить таблицу 8.
Таблица 8
Зависимость скорости реакции от температуры
№ п/п |
Температура T, K |
Время реакции , сек. |
Скорость реакции v = 1/τ, с−1 |
|
Ea, кДж/моль |
1 |
T1 |
|
|
1 |
Ea, 1 |
2 |
T2 |
|
|
||
2 |
Ea, 2 |
||||
3 |
T3 |
|
|
2. Значение температурного коэффициента (коэффициента Вант-Гоффа) рассчитать по формуле:
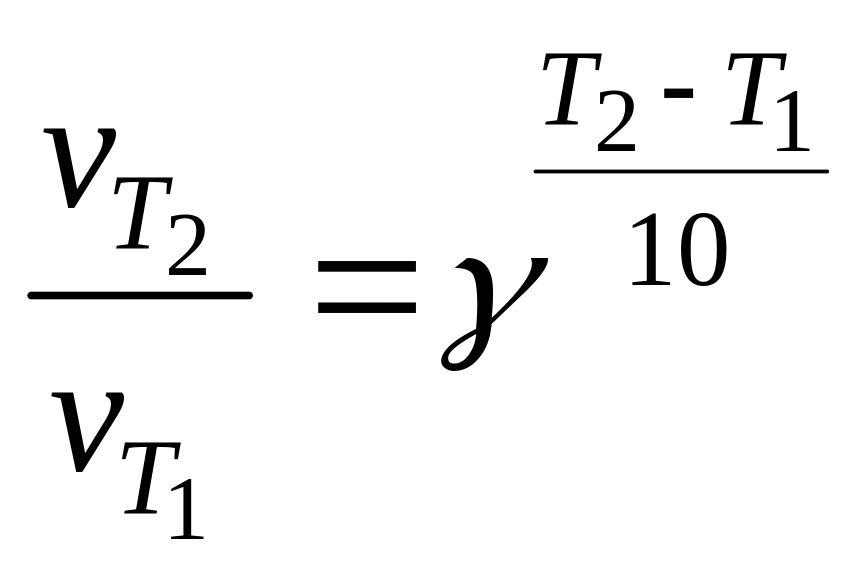 ,
,
рассматривая попарно Т2 − Т1 и Т3 − Т2.
3. Значение энергии активации рассчитать исходя из формулы:
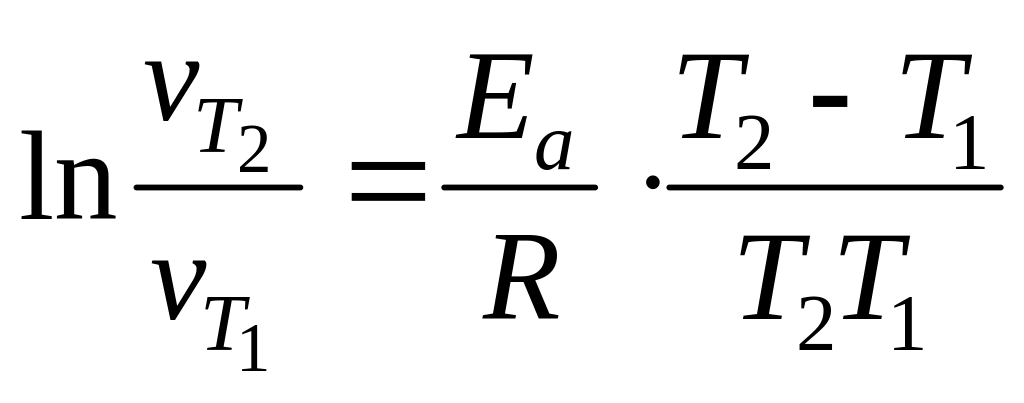 ,
,
рассматривая попарно Т2 − Т1 и Т3 − Т2.
4. Определить среднее значение коэффициента Вант-Гоффа ср.
5. Определить среднее значение энергии активации Ea, ср.
