
- •4. Охорона навколишнього середовища і хімічна технологія
- •4. 1. Класифікація промислових забруднень біосфери
- •4.2. Основи промислової екології
- •4.3. Основні положення екології
- •4.4. Екологічні проблеми хімічної технології
- •4.5. Очищення промислових газових викидів
- •4.6. Утилізація твердих відходів
- •4.7. Очищення стічних вод хімічних виробництв
- •5. Виробництво сульфатної кислоти
- •5. 1. Основні властивості та застосування сульфатної кислоти
- •5.2. Методи виробництва сульфатної кислоти
- •5.3. Сировинна база сульфатнокислотного виробництва
- •5.4. Хімічна схема виробництва сульфатної кислоти з колчедану
- •5.5. Фізико–хімічне обґрунтування технологічних режимів стадій виробництва сульфатної кислоти
- •5.6. Технологічна схема виробництва сульфатної кислоти методом пкпа
- •5.7. Удосконалення сульфатнокислотного виробництва
- •6. Технологія аміаку і нітратної кислоти
- •6.2. Синтез аміаку
- •6.3. Способи виробництва аміаку з азоту повітря кон-тактним методом
- •6.4. Хімічна і принципова схеми виробництва аміаку
- •6.5. Фізико-хімічне обґрунтування режимів виробництва синтез− газу
- •6.6. Очищення природного і конвертованого газів
- •6.7.Фізико-хімічні основи синтезу аміаку
- •6.8. Технологічна схема синтезу аміаку під середнім тиском
- •6.9. Виробництво нітратної кислоти
- •6.9.1. Сорти і області застосування нітратної кислоти
- •6.9.2. Хімічна і функціональна схеми виробництва розведеної нітратної кислоти
- •6.10. Технологічна схема виробництва розведеної нітратної кислоти
- •6. 11. Виробництво концентрованої нітратної кислоти
- •6.11.1. Концентрування нітратної кислоти
- •6.11.2. Прямий синтез концентрованої нітратної кислоти
- •6.12. Охорона навколишнього середовища у виробництві нітратної кислоти
6.7.Фізико-хімічні основи синтезу аміаку
Як видно з рівняння (6.11), синтез аміаку— процес оборотний, він відбувається зі зменшенням об'єму і виділенням тепла, отже, виходячи з принципа Ле Шателье і відповідно до рівняння константи рівноваги, для зміщення рівноваги у бік утворення аміаку необхідно підвищувати тиск і знижувати температуру (рис. 6.3).
Синтез аміаку у відсутністі каталізатора відбувається надто повільно, тому на практиці цей процес ведуть у присутності каталізатора за температурі вище 400°С. Найбільш високу каталітичну активність у цьому процесі мають залізо, марганець, вольфрам; платина і деякі інші метали. Присутність у каталізаторі невеликої кількості добавок (промоторів, або активаторів) підвищує його активність і стійкість. В Україні застосовують залізний каталізатор, що одержується сплавленням оксидів заліза Fe3О4 з активаторами: А12О3, К2О, СаО і SiO2 і подальшим відновленням оксидів заліза до металічного. Цей каталізатор має високу активність і велику стійкість до перегрівів і домішок, які у невеликих кількостях завжди містяться в азотоводневій суміші.
Звичайно розмір зерен каталізатора складає 4 – 6 мм; зразковий склад промислового залізного каталізатора (до його відновлення) наступний (мас. частка, %): 31 FeO, 62 Fe2О3, 1,7 А12О3, 1,1 К2О, 2,5 СаО і 0,03 SiO2.
Відновлення каталізатора ведуть у колоні синтезу азотоводневою сумішшю, що пропускається через апарат протягом декількох діб. На деяких промислових установках відновлення залізного каталізатора проводять поза колоною синтезу. Це дозволяє скоротити період пуску колони і одержати активніший каталізатор.
Домішки діють на каталізатор по–різному. Сірководень і інші сірковмісні сполуки отруюють залізний каталізатор незворотно. Так, при вмісті сірки у каталізаторі 0,1% його активність знижується на 50%, у присутності 1% сірки настає практично повне отруєння каталізатора. Кисень і кисневі сполуки (Н2О, СО, О2) також отруюють каталізатор, але цей процес оборотний.
Синтез аміаку – типовий гетерогенно-каталітичний процес, лімітуючою стадією якого є активована адсорбція реагуючих речовин на поверхні каталізатора.
Вихід аміаку на промислових
установках залежить від багатьох
параметрів технологічного режиму:
температури, тиску, інтенсивності
процесу, складу газової суміші, активності
каталізатора, конструкції апарату та
ін. При цьому інтенсивність характеризують
не часом зіткнення
,
а об'ємною швидкістю S
= 1/![]() ,
год-1,
яка визначається об'ємом газової суміші
у м3,
що проходить через одиницю об'єму
каталізатора у м3
за годину (м3∙м-3∙год-1).
,
год-1,
яка визначається об'ємом газової суміші
у м3,
що проходить через одиницю об'єму
каталізатора у м3
за годину (м3∙м-3∙год-1).
На практиці синтез аміаку на каталізаторі за реакцією (6.5) ведуть в умовах, далеких від рівноважних, тому що визначний вплив на загальну швидкість процесу чинить швидкість прямої реакції. Значення константи швидкості цієї реакції залежить від ряду параметрів: температури, активності каталізатора, розміру зерен та ін.
Залежність константи швидкості k від температури виражається рівнянням Арреніуса. Енергія активації для промислового ка-талізатора становить приблизно 168 кДж/моль.
Важливою характеристикою хіміко-технологічного процесу являється його інтенсивність. У даному випадку (як і в інших хімічних процесах) процес необхідно вести так, щоб забезпечувалася оптимальна інтенсивність, що визначається головним чином економічними чинниками. Оптимальну інтенсивність визначають шля-хом аналізу взаємного впливу окремих параметрів. Інтенсивність може бути розрахована за рівнянням:
І=0,77z∙S,
де z–мольна частка аміакуу газовій суміші, частка одиниці; S−об’ємна швидкість, год-1; 0,77−густина аміаку, кг/м3.
Синтез аміаку відбувається з помітною швидкістю тільки у присутності каталізатора, причому каталізаторами даної реакції слугують тверді речовини. Гетерогенно–каталітичний процес синтезу аміаку має складний механізм, який може бути описаний наступними стадіями:
− дифузія молекул азоту і водню до поверхні каталізатора;
− хемосорбція молекул реагентів (адсорбатів) на поверхні каталізатора;
− поверхнева хімічна реакція з утворенням нестійких проміжних комплексів і взаємодія між ними;
− десорбція продукту;
− дифузія продукту реакції (аміаку) від поверхні каталізатора у газову фазу.
Дослідження кінетики і механізму реакції синтезу дозволило зробити висновок про те, що лімітуючою стадією процесу являється хемосорбція азоту. Цей висновок дає можливість описати механізм синтезу аміаку скороченою схемою:
N2 +Z ↔ ZN2,
ZN2 + 3H2 ↔ 2NH3 + Z,
N2 +3H2 ↔ 2NH3,
де Z — вільний центр поверхні каталізатора; ZN2– хемосорбована частка (адсорбат).
Швидкість оборотної реакції одержання аміаку з елементів для більшості відомих каталізаторів описується рівнянням Тьомкіна–Піжова:
![]()
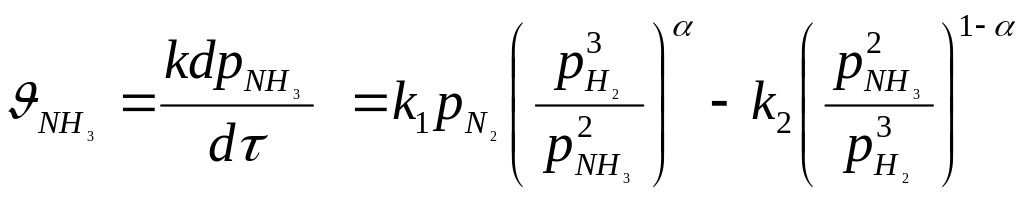 ,
(6.14)
,
(6.14)
де – k 1
і k2
– константи швидкостей утворення і
розкладання аміаку; РN![]() ,
РН
,
PNН
,
РН
,
PNН![]() – парціальний тиск азоту, водню і аміаку;
– парціальний тиск азоту, водню і аміаку;
![]() – постійна, що задовольняє нерівності
0 <
< 1 і що характеризує ступінь покриття
поверхні каталізатора азотом.
– постійна, що задовольняє нерівності
0 <
< 1 і що характеризує ступінь покриття
поверхні каталізатора азотом.
При проведенні процесу за атмосферному тиску величина для промислових каталізаторів в інтервалі температур 400 – 500°С становить 0,5.
Швидкість реакції синтезу аміаку залежить від температури, тиску і складу реакційної суміші. Оптимальними вважають такі значення указаних параметрів, за яких швидкість процесу максимальна. Щоб визначити оптимальну температуру синтезу Топт., потрібно продиференціювати за температурою кінетичне рівняння (6.14), прирівняти одержаний вираз до нуля і знайти Т опт. Виконавши ці дії, одержимо формулу:
 (6.15)
(6.15)
З формули (6.15) слідує, що зі збільшенням умісту у циркуляційному газі аміаку і зменшенням умісту азотоводневої суміші оптимальна температура падає.
З рівняння Тьомкіна – Піжова видно, що швидкість прямої реакції синтезу пропорційна р1,5, а швидкість зворотної реакції пропорційна р0,5. Звідси очевидно, що зі зростанням тиску швидкість процесу збільшується.
І термодинамічні, і кінетичні чинники свідчать на користь проведення процесу за високого тиску (збільшується рівноважний вихід, підвищується швидкість синтезу). Конденсація аміаку також поліпшується за високого тиску. Разом з тим підвищення тиску збільшує витрату електроенергії на компресію, підвищує вимоги до машин і апаратів. При зниженому тиску спрощується апаратурне оформлення процесу, знижується витрата енергії, але при цьому зростають габарити апаратів, збільшуються енерговитрати на циркуляцію газу і виділення аміаку, підвищуються вимоги до чистоти газу синтезу.
Оскільки присутність інертних домішок у реакційній суміші рівнозначна зниженню загального тиску, то зі збільшенням вмісту метану, аргону і гелію у суміші швидкість реакції синтезу зменшується.
Аналізуючи кінетичне рівняння (6.14), бачимо, що швидкість прямої реакції обернено пропорційна парціальному тиску аміаку, а для зворотної реакції характерна пряма пропорційність. Таким чином, з підвищенням умісту аміаку загальна швидкість реакції падає. Збільшення об'ємної швидкості суміші призводить до зменшення приросту вмісту аміаку і, тим самим до збільшення середньої швидкості і підвищення продуктивності процесу.
Реакція синтезу аміаку зворотна, тому повного перетворення азоту і водню в аміак за час їх одноразового проходження через апарат не відбувається. Умови рівноваги процесу і кінетичні закономірності його перебігу на залізних каталізаторах зумовлюють можливість перетворення в аміак лише 20 – 40% вихідної реакційної суміші. Для повнішого використання реагентів необхідна їх багатократна циркуляція через колону синтезу. Всі сучасні схеми синтезу аміаку являються циркуляційними, такими, що передбачають виділення аміаку і повернення азотоводневої суміші, що непрореагувала, у цикл синтезу. Щоб виділити аміак, азотоводневу суміш разом з аміаком охолоджують до температури зрідження аміаку. Досягти повної конденсації аміаку не вдається; невелика частина його залишається в азотоводневій суміші.
У системах, що працюють за високого тиску (наприклад, 60 – 100 МПа), для виділення аміаку з азотоводневої суміші можна обмежитися повітряним або водяним охолодженням. Азотоводнева суміш, що не прореагувала, із залишковим аміаком знову повертається на синтез аміаку.
