
Основные положения Образование двойного электрического слоя
При погружении частицы в раствор ионы в узлах кристаллической решетки частицы имеют значение химического потенциала 1, в растворе же ионы приобретают химический потенциал 2, система стремится к выравниванию потенциалов до равновесного рав, что приводит к возникновению двойного электрического слоя.
Возможны три механизма образования двойного электрического слоя (ДЭС):
1. Поверхностная диссоциация функциональных групп;
2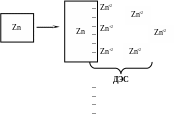 .
Адсорбция ионов электролитов;
.
Адсорбция ионов электролитов;
3. Ориентация полярных молекул на межфазной границе.
а) В случае гидрозолей металлов в раствор переходят катионы металлов, твердая поверхность заряжается отрицательно, а дисперсионная среда положительно.
б) В случае некоторых оксидов, кислот, белков и так далее с твердой поверхности в дисперсионную среду переходят ионы одного заряда, ионы с противоположным зарядом остаются на твердой частице и являются потенциалопределяющими.
Пример: гидрозоль диоксида кремния SiO2. Поверхностные молекулы реагируют с водой, образуя кремниевую кислоту, которая диссоциирует, отдавая в дисперсионную среду ионы Н+:
H2SiO3 H+ + HSiO3-
Твердая частица при этом заряжается отрицательно, а среда – положительно. Поэтому при соприкосновении воды с толченым кварцем среда заряжается положительно и перемещается к отрицательному электроду.
а) Адсорбция ионов, способных достраивать кристаллическую решетку частицы дисперсной фазы.
В соответствии с правилом Фаянса-Панета, на поверхности твердой частицы избирательно адсорбируются только те ионы, которые способны достроить ее кристаллическую решетку или изоморфны с ней.
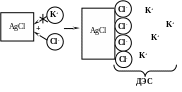
Предположим, что твердые частицы хлорида серебра диспергированы в водном растворе хлорида калия:
 В
данном случае на поверхности будут
сорбироваться ионы Cl-,
так как они входят в состав кристаллической
рещетки и будут придавать частице
отрицательный заряд, одновременно
прилегающая к частице жидкая среда
приобретает положительный заряд, т.е.
возникает ДЭС. Ионы, придающие заряд
твердой частице, называются
потенциало-определяющими, противоположно
заряженные – противоионами.
В
данном случае на поверхности будут
сорбироваться ионы Cl-,
так как они входят в состав кристаллической
рещетки и будут придавать частице
отрицательный заряд, одновременно
прилегающая к частице жидкая среда
приобретает положительный заряд, т.е.
возникает ДЭС. Ионы, придающие заряд
твердой частице, называются
потенциало-определяющими, противоположно
заряженные – противоионами.
б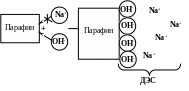 )
Адсорбция без достройки кристаллической
решетки (ориентация полярных молекул
на межфазной границе). Этот случай имеет
место, когда в растворе имеются ионы,
обладающие большой адсорбционной
способностью – Н+
или ОН-.
Пример: возникновение ДЭС на границе
«частицы твердого парафина-водный
раствор щелочи». ДЭС образуется в
результате адсорбции ионов ОН-.
)
Адсорбция без достройки кристаллической
решетки (ориентация полярных молекул
на межфазной границе). Этот случай имеет
место, когда в растворе имеются ионы,
обладающие большой адсорбционной
способностью – Н+
или ОН-.
Пример: возникновение ДЭС на границе
«частицы твердого парафина-водный
раствор щелочи». ДЭС образуется в
результате адсорбции ионов ОН-.
Строение двойного электрического слоя
Современные представления о строении ДЭС базируются на следующих положениях:
ДЭС образован потенциалоопределяющими ионами, находящимися на поверхности твердой частицы и эквивалентным количеством противоионов, находящихся в дисперсионной среде вблизи поверхности твердой частицы.
Потенциалоопределяющие ионы прочно связаны с твердой частицей хемосорбционными силами и равномерно распределены по ее поверхности.
Дисперсионная среда рассматривается как непрерывная (бесструктурная) среда, характеризуемая диэлектрической проницаемостью и вязкостью .
ДЭС рассматривается как плоскопараллельный. Это допущение приемлемо, так как толщина ДЭС намного меньше, чем радиус кривизны поверхности твердой частицы.
Противоионы имеют конечные размеры и, следовательно, не могут подходить к твердой поверхности ближе, чем на расстояние одного ионного радиуса.
Слой противоионов, компенсирующих заряд твердой поверхности, имеет сложное строение и состоит из двух частей: плотного слоя (также именуемого адсорбционным слоем или слоем Гельмгольца) и диффузного слоя (слоя Гуи).
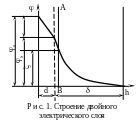
Адсорбционный слой противоионов примыкает к заряженной поверхности твердой частицы и имеет толщину порядка диаметра гидратированного противоиона d. Те противоионы, которые находятся в этом пространстве, называются адсорбционными противоионами. Они связаны с заряженной твердой частицей двумя видами сил – адсорбционными и электростатическими. Эта связь настолько прочна, что противоионы адсорбционного слоя перемещаются вместе с твердой частицей, не отрываются от нее, образуя с ней единое кинетическое целое – коллоидную частицу. Противоионы адсорбционного слоя равномерно распределены в слое, поэтому падение потенциала происходит линейно и равно d.
Диффузный слой имеет толщину , его образуют те противоионы, которые находятся от заряженной поверхности на расстоянии, большем d, но в пределах расстояния . Эти противоионы притягиваются к частице только электростатическими силами, а, следовательно, менее прочно, чем противоионы адсорбционного слоя. При движении твердой частицы они от нее отрываются. На противоионы диффузного слоя большое влияние оказывает тепловое движение, стремящееся распределить их равномерно по всему объему системы. Его действие тем сильнее, чем дальше от заряженной поверхности находятся противоионы. Это приводит к установлению динамического равновесия в диффузном слое. Так как противоионы в диффузном слое распределены неравномерно, то и падение потенциала в нем () происходит также неравномерно – по криволинейной зависимости (рис. 1).
П
 олное
падение потенциала в ДЭС называется
термодинамическим потенциалом 0:
олное
падение потенциала в ДЭС называется
термодинамическим потенциалом 0:
![]()
Таким образом, в ДЭС происходит полная компенсация суммарного заряда твердой поверхности суммарным зарядом противоионов и на границе ДЭС с дисперсионной средой потенциал равен нулю.
При движении частицы двойной электрический слой разрывается. Место разрыва при перемещении твердой и жидкой фаз относительно друг друга называется плоскостью скольжения (границей скольжения) – линия АВ на рис. 1. Плоскость скольжения лежит или на границе между диффузным слоем и адсорбционным слоем, либо в диффузном слое, но вблизи этой границы (пунктирная линия на рис. 1).
Потенциал на плоскости скольжения называется электрокинетическим потенциалом (или -(дзета) – потенциалом ).
-потенциал является важнейшей характеристикой ДЭС: он опреде-ляет скорость относительного перемещения дисперсной фазы и диспер-сионной среды, интенсивность электрокинетических явлений, устойчи-вость золей и т.д.
