
Факторы, от которых зависит -потенциал:
-потенциал тем больше, чем больше термодинамический потенциал 0;
-потенциал тем больше, чем больше , т.е. чем больше противоионов находится в диффузном слое (при одном и том же 0);
добавка индифферентного электролита;
добавка неиндифферентного электролита;
рН среды;
концентрация золя;
температура;
природа дисперсионной среды.
Индифферентным электролитом называется электролит, ионы которого не способны достроить кристаллическую решетку частицы дисперсной фазы.
При введении в лиофобный золь индифферентного электролита возможны два случая.
В
 лиофобный золь вводится электролит,
один ион которого одинаков с
противоионом ДЭС. В этом случае
термодинамический потенциал 0
практически не изменится,
не изменится общее число противоионов,
необходимых для компенсации
потенциалоопределяющих ионов, но
изменится их распределение в ДЭС. Так
как концентрация противоионов в
коллоидном растворе увеличится,
естественно, увеличится их концентрация
в адсорбционном слое, значит, в
диффузионном слое их останется меньше.
Диффузионный слой сжимается – это
приводит к уменьшению -потенциала
по абсолютной величине. Может быть
достигнуто такое состояние, когда все
необходимое число противоионов находится
в адсорбционном слое, диффузного слоя
нет, -потенциал
равен нулю, золь находится в изоэлектрическом
состоянии (рис. 2).
лиофобный золь вводится электролит,
один ион которого одинаков с
противоионом ДЭС. В этом случае
термодинамический потенциал 0
практически не изменится,
не изменится общее число противоионов,
необходимых для компенсации
потенциалоопределяющих ионов, но
изменится их распределение в ДЭС. Так
как концентрация противоионов в
коллоидном растворе увеличится,
естественно, увеличится их концентрация
в адсорбционном слое, значит, в
диффузионном слое их останется меньше.
Диффузионный слой сжимается – это
приводит к уменьшению -потенциала
по абсолютной величине. Может быть
достигнуто такое состояние, когда все
необходимое число противоионов находится
в адсорбционном слое, диффузного слоя
нет, -потенциал
равен нулю, золь находится в изоэлектрическом
состоянии (рис. 2).В лиофобный золь вводится индифферентный электролит, который не имеет ионов, входящих в ДЭС. В этом случае ион, заряд которого одинаков по знаку с зарядом противоиона будет конкурировать за нахождение в ДЭС, будет происходить ионный обмен в сответствии с уравнением Никольского:
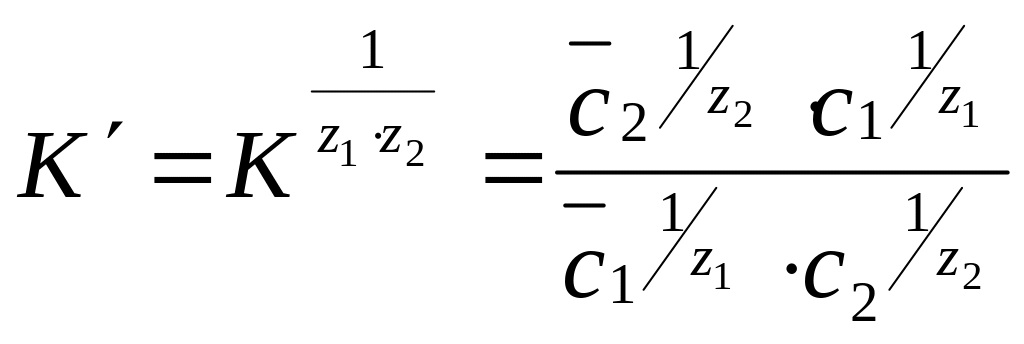 ,
,
где К – константа ионного равновесия;
 с – концентрация ионов в ионите;
с – концентрация ионов в ионите;
с – концентрация ионов в растворе.
Влияние иона-конкурента на строение ДЭС зависит от его способности сжимать ДЭС: она возрастает от Li+ к Cs+, от F- к Br- и объясняется возрастанием адсорбционной способности иона с увеличением кристаллического радиуса иона. Адсорбционная способность иона увеличивается также с увеличением его заряда.
 Если
адсорбционные способности противоиона
и иона-конкурента близки, то будет
происходить сжатие ДЭС и уменьшение
-потенциала
вплоть до нуля.
Если
адсорбционные способности противоиона
и иона-конкурента близки, то будет
происходить сжатие ДЭС и уменьшение
-потенциала
вплоть до нуля.
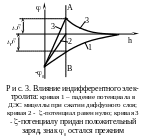
Если же адсорбционная способность иона-конкурента значительно больше, чем данного противоиона (например больше заряд), то может произойти перезарядка коллоидной частицы, т. е. -потенциал изменит свой знак, сохраняя постоянным термодинамический потенциал (рис. 3).
В качестве примера рассмотрим гидрозоль AgCl, стабилизированный хлоридом калия (линия 1 на рис. 3). Если к этому золю добавить нитрат натрия, то будет происходить ионный обмен между ионами К+ и Na+, в результате которого в адсорбционном слое будут находиться как ионы К+, так и ионы Na+.
Так как их адсорбционные способности близки, увеличение концентрации ионов Na+ будет эквивалентно увеличению концентрации ионов К+ и будет приводить к сжатию диффузного слоя и уменьшению -потенциала по абсолютной величине вплоть до нуля (линия 2 на рис. 3).
Есои к исходному золю добавить Fe(NO3)2, то ионы Fe+3 будут конкурировать с ионами калия за нахождение в адсорбционном слое, а так как адсорбционная способность ионов Fe+3 гораздо больше, в результате ионного обмена в адсорбционном слое ионов Fe+3 может оказаться так много, что они не только полностью скомпенсируют заряд потенциалоопределяющих ионов, но и окажутся в избытке, придавая адсорбционному слою и -потенциалу положительный заряд. Однако знак 0 останется прежним, так как ионы Fe+3 не способны достраивать кристаллическую решетку твердой частицы и, следовательно, выступать в роли потенциалоопределяющих ионов. (кривая 3 на рис. 3).
Неиндифферентным электролитом называется электролит, один из ионов которого способен достраивать кристаллическую решетку твердой фазы, т.е. специфически адсорбироваться на поверхности твердой частицы, придавая ей свой заряд.
При введении в золь неиндифферентного электролита возможны также два случая.
В систему вводится тот же электролит, который образовал ДЭС.
В этом случае в золе одновременно возрастает концентрация как потенциалоопределяющих ионов, так и противоионов. Это приводит к появлению двух противоположных тенденций: с одной стороны, увеличение концентрации потенциалоопределяющих ионов увеличивает 0, а следовательно, и электрокинетический потенциал; с другой стороны, увеличение концентрации противоионов приводит к сжатию диффузного слоя и уменьшению -потенциала.
П ри
малых концентрациях неиндифферентного
электролита преобладает первый фактор
и -потенциал
по абсолютной величине возрастает, при
больших концентрациях -потенциал
уменьшается.
ри
малых концентрациях неиндифферентного
электролита преобладает первый фактор
и -потенциал
по абсолютной величине возрастает, при
больших концентрациях -потенциал
уменьшается.
В систему вводится неиндифферентный электролит, имеющий потенциалоопределяющие ионы противоположного знака.
Например, в золь хлорида серебра, стабилизированного хлоридом калия, добавили нитрат серебра, содержащий ионы Ag+, способные достроить кристаллическую решетку AgCl. По мере поступления ионов Ag+ в золь они попадают в адсорбционный слой и образуют с потенциалоопределяющими ионами Cl- малорастворимое соединение AgCl, что приводит к уменьшению по абсолютной величине как 0, так и . Этот процесс идет до тех пор, пока все потенциалоопре-деляющие ионы Cl- не свяжутся ионами Ag+ - в этот момент 0 и станут равными нулю. Дальнейшее добавление AgNO3 приведет к тому, что ионы Ag+ будут специфически адсорбироваться на нейтральной поверхности твердой частицы, заряжая ее положительно. Таким образом, произойдет перезарядка поверхности – термодинамический потенциал 0 станет положительным - рис. 4: линия 1 соответствует исходному золю AgCl, а линия 2 – золю, полученному в результате добавления избытка AgNO3.
Влияние рН
Введение в золь ионов Н+ и ОН- может сильно сказаться на величине -потенциала, так как эти ионы обладают высокой сорбционной способностью: ионы Н+ - из-за малых размеров и, следовательно, большой плотности заряда, ионы ОН- - из-за большой поляризуемости.
Влияние концентрации золя
Здесь наблюдаются две противоположные тенденции:
с разбавлением золя уменьшается концентрация противоионов, что приводит к расширению ДЭС и, следовательно, к увеличению по абсолютной величине -потенциала;
с разбавлением золя усиливается десорбция потенциалоопределяющих ионов, что приводит к уменьшению по абсолютной величине 0 и, следовательно, -потенциала.
Влияние температуры
Наблюдаются две противоположные тенденции:
с ростом температуры усиливается диффузия противоионов, ДЭС расширяется, -потенциал по абсолютной величине возрастает;
усиливается десорбция потенциалоопределяющих ионов, уменьшая абсолютную величину 0 и -потенциала.
Влияние природы дисперсионной среды
Дисперсионная среда обычно характеризуется двумя величинами: диэлектрической проницаемостью () и вязкостью ().
-потенциал золя тем больше, чем больше диэлектрическая проницаемость среды.
Роль вязкости сводится, главным образом, к положению границы скольжения АВ. Чем больше вязкость, тем толще слой дисперсионной среды, который «прилипает» к частице при разрыве мицеллы и, следовательно, тем меньше численное значение -потенциала.
