
- •1. Техника безопасности при работе в лаборатории химии
- •Лабораторная работа № 1 электролиз
- •Лабораторная работа № 2 гальванические элементы. Коррозия металлов
- •Лабораторная работа № 3
- •Часть 1. Хром. Марганец.
- •Часть 2. Железо. Кобальт. Никель.
- •Лабораторная работа №4 Синтез и свойства полимеров
- •Приложения
- •1. Единицы измерения физических величин
- •2. Фундаментальные физические постоянные
- •3. Греческий алфавит
Лабораторная работа № 1 электролиз
Цель работы
Изучение процессов, происходящих при электролизе водных растворов электролитов.
Оборудование и реактивы
Источник постоянного электрического тока, электролизеры, кристаллизатор, медный и графитовые электроды, пробки, пробирки, промывалка, секундомер, спиртовка, спички, химические стаканы.
Медная и никелевая пластинки, медная проволока; иод-крахмальная бумага; дистиллированная вода, растворы: хлороводородная кислота HCl (2 М), гидроксид натрия NaOH (15%-ный), хлорид натрия NaCl (насыщ.), сульфат никеля (II) NiSO4 (0,3 М) и 0,5 М сульфат меди (II) CuSO4, иодид калия KI, сульфат натрия Na2SO4; индикаторы: метиловый оранжевый, фенолфталеин.
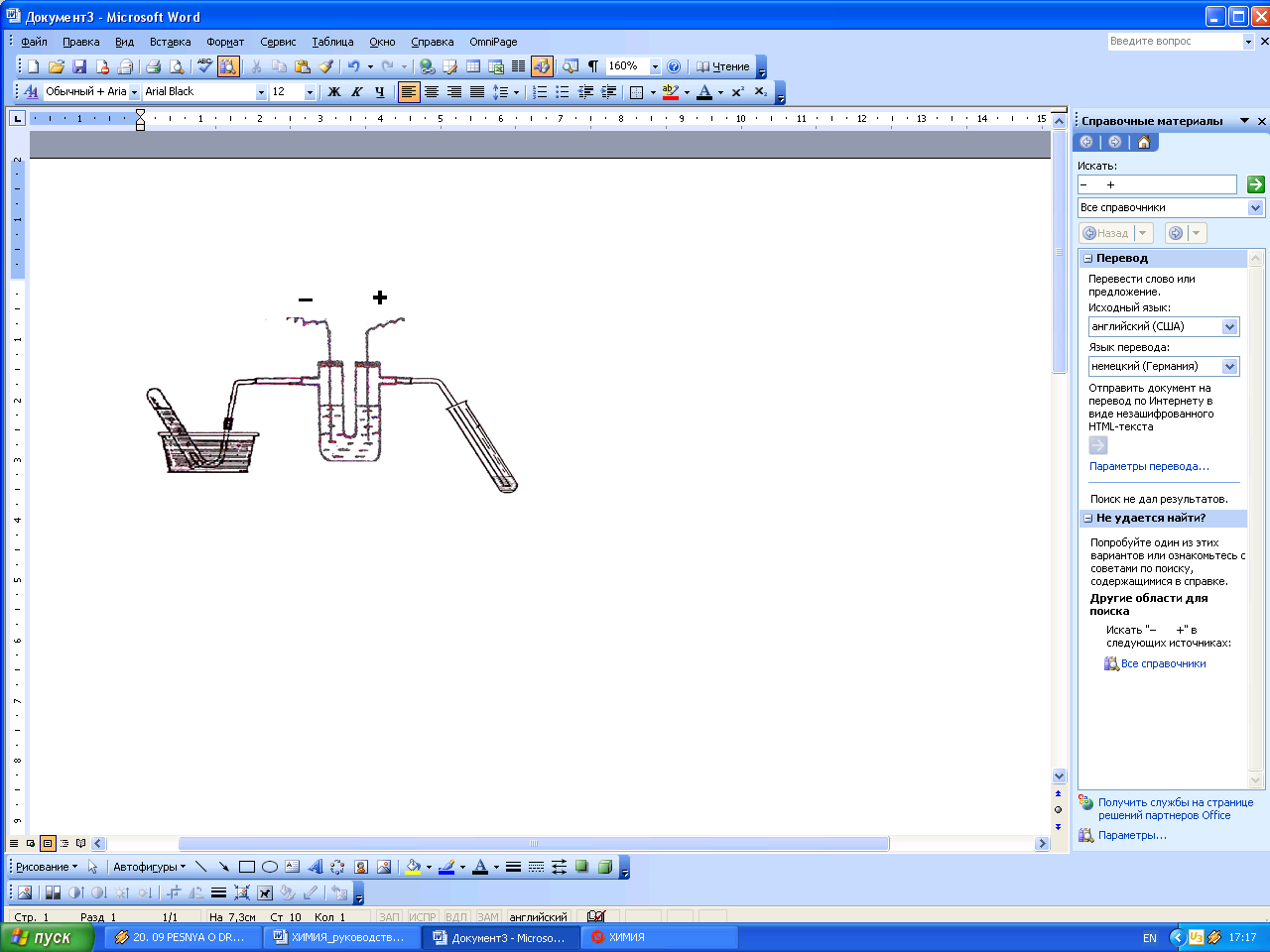
Экспериментальная часть1
О
Рис. 6. Схема
электролизера
Опыт 1. Электролиз раствора хлорида натрия
Соберите электролизер с насыщенным раствором NaCl на инертных электродах по схеме (рис. 6) и подключите к источнику электрического тока, отметьте время полного заполнения пробирки газом с катода. Подтвердите качественный состав выделившегося на катоде газа ______, собранного над водой – поднося пробирку с газом (строго вертикально и вверх дном) к горящей лучине или спиртовке. Выделяющийся на аноде газ ______ пропустите в раствор KI с иод-крахмальной бумагой.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Вычислите массовую долю выхода (η) водорода от теоретически возможного (%) по формуле: η = mпрак ∙100% / mтеор = ______________________________.
Вычисление практической массы (mпрак) проводится исходя из практического объема газа, полученного за время проведения эксперимента: mпрак = M ∙ Vпрак / Vm,
____________________________________________________________,
где М – молярная масса полученного вещества; Vпрак – объем полученного вещества; Vm – молярный объем газа, равный 22,4 моль/л.
Вычисление теоретической массы (mтеор) получаемых веществ проводится по формуле: Mтеор= МЭ∙I∙τ / F =________________________________________,
где МЭ – молярная масса эквивалента получаемого вещества (= молярная масса полученного вещества / число принятых или отданных электронов; г/моль); I – сила тока, при которой осуществляется процесс (А); τ – время электролиза (с); F – постоянная Фарадея (96485 Кл/моль).
Опыт 2. Электролиз раствора сульфата натрия
В U-образную трубку налейте 0,5 М раствора Na2SO4 и добавьте в оба колена несколько капель раствора метилового оранжевого. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 3. Электролиз раствора иодида калия
В U-образную трубку налейте 0,5 М раствор KI и добавьте в оба колена несколько капель раствора фенолфталеина. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. Объясните изменение цвета раствора около катода и анода. Внесите в околоанодное пространство иод-крахмальную бумагу.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 4. Электролиз раствора сульфата меди (II)
В U-образную трубку налейте 0,5 М раствор CuSO4 и добавьте в околоанодное пространство несколько капель раствора метилового оранжевого. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. Объясните появление на катоде красного налета меди. Проделайте данный опыт, используя растворимый медный анод.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 5. Электролитическое получение никеля (никелирование)
Подготовка к никелированию:
- механическая обработка: тонкую медную пластинку (длиной 3–4 см и шириной 1 см) с прикрепленной к одному концу медной проволокой тщательно очистите наждачной бумагой;
- обезжиривание: опустите очищенную пластинку на 1–2 минуты в 15%-ный раствор щелочи, а затем, не касаясь руками пластинки, промойте ее дистиллированной водой из промывалки;
- травление: опустите обезжиренную пластинку на 1–2 минуты в 2 М раствор HCl для освобождения поверхности металла от оксидов, а затем, не касаясь руками пластинки, промойте ее дистиллированной водой из промывалки и положите на фильтровальную бумагу.
Прибор для электролиза: в химический стакан налейте электролит и опустите электроды, в качестве катода используйте предварительно обезжиренную и протравленную в соляной кислоте медную пластинку, в качестве анода – никелевую пластинку. Электролиз проводите при комнатной температуре, плотности тока 0,3 А/дм2, напряжении 3,5 В и расстоянии между электродами 1,5 см. Используйте электролит для никелирования: в 100 мл H2O растворяют 5 г NiSO4 и 1,5 г H3BO3. Составьте уравнения электродных процессов.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Вывод: ___________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Пример Напишите электронные уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата меди(II). Какая масса меди выделится на катоде и какой объем кислорода выделится на аноде в течение 1 часа и силе тока равной 4А?
Решение
Электролиз раствора сульфата меди(II): (-) К: Cu2+, H2O. (+) А: SO2−4 , H2O. На катоде: Cu2+ + 2 e = Cu0; На аноде 2H2O - 4 e = O2↑+4H+ электролиз 2CuSO4+2H2O→2Cu + 2H2SO4 +O2↑ Мэ=63,54/2 = 31,77 г/моль. m = МэIt/F m(Cu) = 31,77•4•3600/96500 = 4,74 г. m/Mэ= VO2 /Vэ(O2), Vэ(O2)=5,6 л. V = V(O2)It/96500 = 5,6•4•3600/96500 = 0,84 л. Ответ: 0,84 л. |
Контрольные задания
1. Составьте уравнения процессов, протекающих при электролизе расплавов а) NaOH, б) NiCl2, в) K2S с инертными электродами.
2. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) H2SO4, б) Pb(NO3)2 с платиновыми электродами.
3. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) BaCl2, б) Ni(NO3)2 с угольными электродами.
4. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) FeCl3, б) Ca(NO3)2 с инертным анодом.
5. Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный.
6. Составить схемы электролиза водного раствора хлорида меди, если: а) анод медный; б) анод угольный.
7. Раствор содержит ионы Fe2+, Ag+, и Pb2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла?
8. При электролизе растворов CuCl2 на аноде выделилось 560 мл газа (н. у.). Найти массу меди, выделившейся на катоде.
9. Какие вещества и в каком количестве выделятся при пропускании тока силой 10 А в течение 5 минут через расплав хлорида магния?
10. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6А через раствор нитрата серебра в течение 30 мин.
11. Сколько времени потребуется для полного разложения 2 молей воды током силой 2А?
12. Как электролитически получить LiОН из соли лития? Какое количество электричества необходимо для получения 1т LiОН? Составить схемы электродных процессов.
13. Найти объем кислорода (н. у.), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН.
14. Найти объем водорода (условия нормальные), который выделится при пропускании тока силой в 3 А в течение 1 ч через водный раствор серной кислоты.
15. Какое количество электричества потребуется для выделения из раствора: а) 2 г водорода; б) 2 г кислорода?
16. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) сульфида натрия, б) бромида алюминия с инертными электродами.
17. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) нитрата серебра, б) карбоната натрия с инертными электродами.
18. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) сульфида лития, б) нитрита калия с инертными электродами.
19. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) нитрата хрома (III), б) азотной кислоты с инертными электродами.
20. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) гидроксида калия, б) хлороводородной кислоты с инертными электродами.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
