
- •Исходные данные
- •1. Расчет зависимости давлений насыщенных паров компонентов от температуры, равновесных концентраций, энтальпий
- •2. Материальный баланс колонны
- •3. Расчет флегмового числа
- •4. Тепловой баланс колонны
- •5. Графический расчет числа теоретических тарелок
- •6. Определение нагрузок по парам и жидкости в основных сечениях колонны
- •7. Определение основных размеров колонны
- •Средние температурные поправки плотности на 1ºC для нефтей и нефтепродуктов
- •117917, Гсп-1, Ленинский проспект, д.65
Целью технологического расчета ректификационной колонны является определение: температурного режима, нагрузок по парам и жидкости, количества и качества получаемых продуктов, размеров аппарата.
Расчет ректификационной колонны может быть выполнен как в массовых, так и в мольных единицах, причем соответствующие уравнения материального баланса имеют один и тот же вид. Ниже приведен расчет колонны в массовых единицах. Примем следующие обозначения (рис. 1):
F , x , e , tF - массовый расход сырья, массовая доля НКК, доля отгона и температура сырья на входе в
колонну;
GF , gF , yF*, xF* - массовый расход паровой части сырья и
неиспарившейся жидкости в секции питания,
доля НКК в этих потоках;
D , yD , tD - массовый расход, доля НКК и температура паров
ректификата, отбираемых из колонны;
W, xW , tW - массовый расход, доля НКК и температура
остатка, уходящего с низа колонны;
GNk, yNk , tNk - массовый расход, доля НКК и температура паров,
уходящих с верхней тарелки в парциальный
конденсатор;
gD , xD* , tD - массовый расход, доля НКК и температура
горячего орошения;
g1 , x1 , t1 - массовый расход, доля НКК и температура
жидкости, стекающей с нижней тарелки
концентрационной части;
GNo , yNo , tNo - массовый расход, доля НКК и температура паров,
уходящих с верхней тарелки отгонной части;
GW , yW* , tW - массовый расход, доля НКК и температура паров,
поступающих из кипятильника;
Qd - тепло, снимаемое на верху колонны
(тепло орошения);
QВ - тепло, подводимое в низ колонны
(тепло кипятильника).

Рис. 1. Принципиальная схема ректификационной колонны
Исходные данные
1. Сырье состоит из смеси н.октана и н.декана, содержание н.октана
в сырье xF = 0,4 .
2. Содержание н.октана в ректификате yD = 0,98 , в остатке xW = 0,01.
3. Давление в секции питания колонны эв = 0,12 МПа.
4. Массовая доля отгона сырья, поступающего в колонну е=0,2.
5. Физические свойства компонентов:
н.октан н.декан
молекулярная масса, М 114,2 142,2
температура кипения, tk, оС 125,7 174,1;
относительная плотность, 420 0,703 0,730.
6. Массовый расход сырья F = 12000 кг/ч.
1. Расчет зависимости давлений насыщенных паров компонентов от температуры, равновесных концентраций, энтальпий
Для расчета состава равновесных фаз и построения кривой равновесия фаз, изобарных температурных кривых и энтальпийной диаграммы рассчитываются давления насыщенных паров (ДНП) компонентов от температуры.
Большинство существующих формул для определения упругости насыщенных паров эмпирические. Наиболее известными для определения упругости насыщенных паров индивидуальных углеводородов являются формулы: Дальтона, Дюринга, Рамсай-Юнга, Кокса, Ашворта, Антуана, Вильсона [1-4].
В приведенном ниже примере для расчета давлений насыщенных паров используется уравнение Антуана [1]:
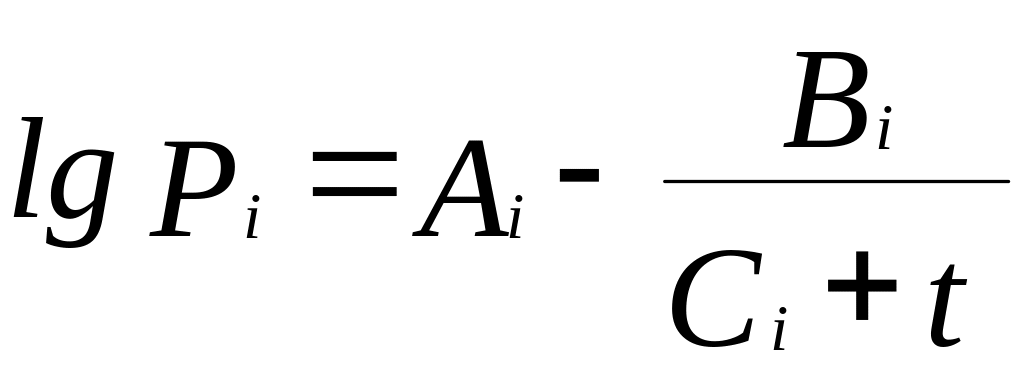 ,
(1)
,
(1)
где Ai , Bi , Ci - константы уравнения Антуана для i-го компонента;
t - температура, оС.
Константы уравнения Антуана взяты из справочной литературы [1, 2].
Для н.октана с температурой кипения 125,7оС при давлении в колонне = 0,12 МПа ближайшая температура 130оС, для н.декана с температурой кипения 174,1оС такой температурой является 180оС; следовательно, кривые зависимости ДНП от температуры строятся в интервале температур 130 - 180оС . Интервал температур уточняется, т.е. определяются температуры кипения компонентов при заданном давлении (P1= при t=ta ; P2= при t=tw).
Температуры кипения компонентов при давлении = 0,12 МПа составляют: н.октана ta = 131,98oC и н.декана tw = 180,96 oC .
В интервале ta - tw произвольно задаемся рядом температур и вычисляем составы равновесных жидкой x' и паровой y' фаз по уравнениям (2) и (3):
 ,
(2)
,
(2)
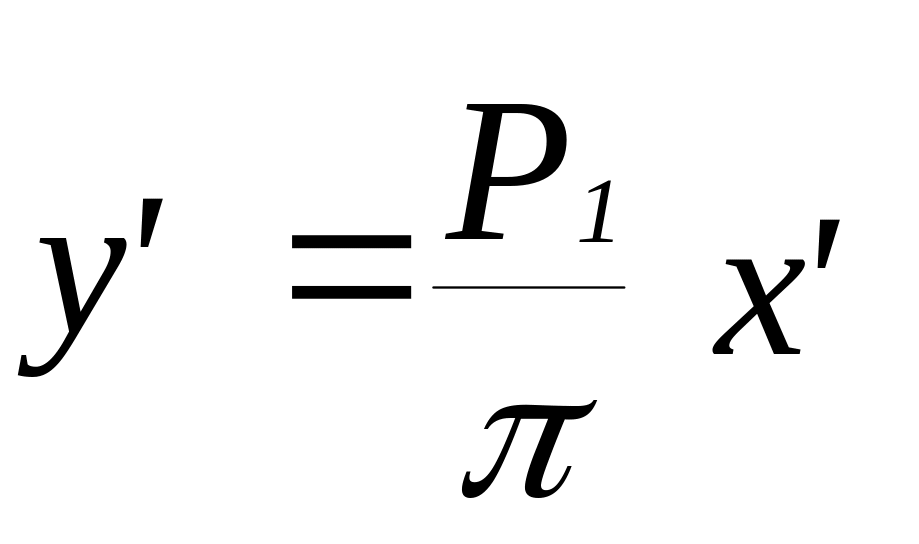 .
(3)
.
(3)
Значения массовых концентраций определены по уравнениям (4) и (5):
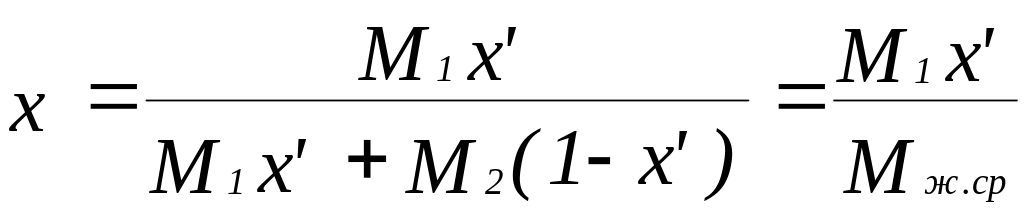 ,
(4)
,
(4)
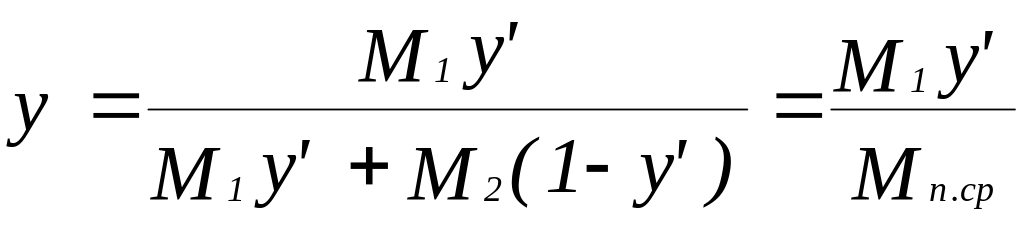 ,
(5)
,
(5)
где М1 и М2 - соответственно, молекулярные массы н.октана
и н.декана;
Mж.ср и Mп.ср - средние молекулярные массы жидкости и паров.
Температура ввода сырья в колонну определяется при заданной доле отгона е = 0,2:
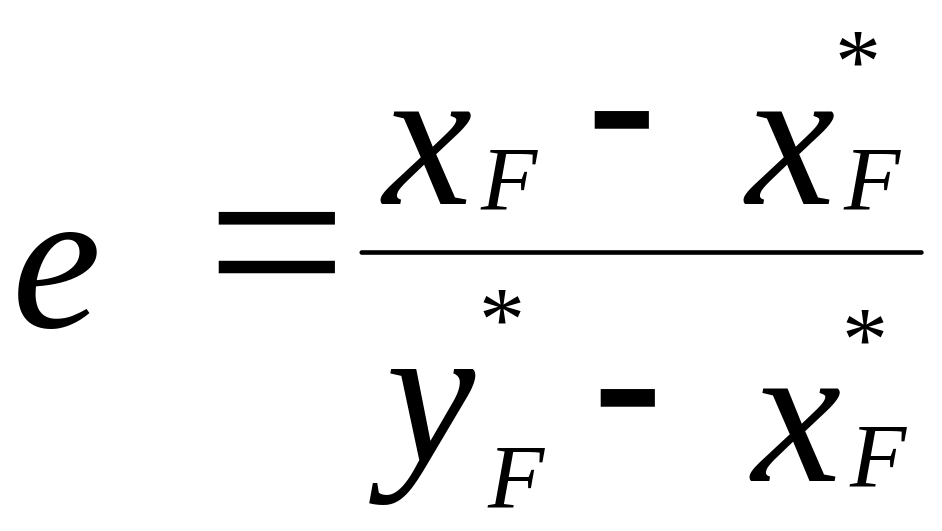 .
(6)
.
(6)
Температуры дистиллята и остатка определяются без учета изменения давления по высоте колонны подбором по заданным концентрациям yD и xW..
Результаты расчетов приведены в табл. 1., на рис. 2-4 даны графические зависимости.
Таблица 1
t,oC |
P1 |
P2 |
x' |
y' |
x |
y |
e |
131,98 |
0,1200 |
0,0302 |
1,0000 |
1,0000 |
1,0000 |
1,0000 |
##### |
133,65 |
0,1254 |
0,0318 |
0,9419 |
0,9846 |
0,9286 |
0,9809 |
-10,112 |
140,00 |
0,1480 |
0,0389 |
0,7436 |
0,9169 |
0,6995 |
0,8986 |
-1,505 |
145,00 |
0,1678 |
0,0453 |
0,6098 |
0,8528 |
0,5564 |
0,8231 |
-0,587 |
150,00 |
0,1897 |
0,0525 |
0,4921 |
0,7779 |
0,4376 |
0,7377 |
-0,125 |
154,92 |
0,2133 |
0,0604 |
0,3898 |
0,6927 |
0,3390 |
0,6441 |
0,200 |
160,00 |
0,2399 |
0,0696 |
0,2958 |
0,5913 |
0,2522 |
0,5374 |
0,518 |
165,00 |
0,2685 |
0,0798 |
0,2132 |
0,4771 |
0,1787 |
0,4228 |
0,907 |
170,00 |
0,2997 |
0,0910 |
0,1390 |
0,3471 |
0,1147 |
0,2991 |
1,547 |
179,94 |
0,3696 |
0,1168 |
0,0125 |
0,0385 |
0,0101 |
0,0312 |
18,488 |
180,96 |
0,3774 |
0,1200 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
##### |
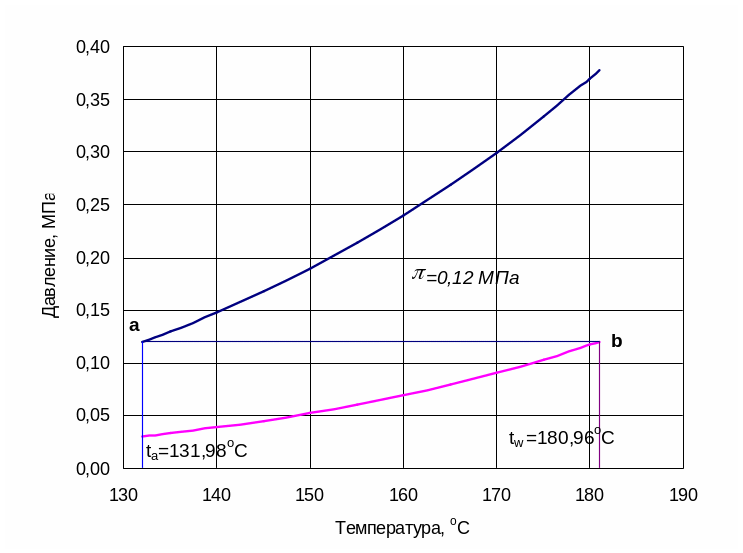
Рис.2. Зависимости давлений насыщенных паров н.октана и н.декана
от температуры

Рис.3. Изобарные температурные кривые

Рис. 4. Кривая равновесия фаз
Энтальпии н.октана и н.декана находят из справочной литературы [2], или они могут быть определены приближенно по формулам Крега [2]:
для жидкости
 ,
ккал/кг
(7)
,
ккал/кг
(7)
для паров
![]() ,
ккал/кг
(8).
,
ккал/кг
(8).
Для
пересчета величин
![]() и
и
![]() можно воспользоваться приближенной
формулой [2]:
можно воспользоваться приближенной
формулой [2]:
![]() ,
(9)
,
(9)
где
![]() - температурная
поправка (см. табл. П-1).
- температурная
поправка (см. табл. П-1).
Энтальпия жидкости состава x при температуре t определяется по уравнению (10), а паров состава y - по уравнению (11):
![]() ккал/кг.
(10)
ккал/кг.
(10)
![]() ккал/кг.
(11)
ккал/кг.
(11)
Вычисления приведены в табл. 2, по которым на рис. 5 построена
энтальпийная диаграмма, связывающая составы жидкой и паровой фаз с их энтальпией.
Таблица 2
t, oC |
x |
y |
h1 |
h2 |
ht |
H1 |
H2 |
Ht |
131,98 |
1,0000 |
1,0000 |
71,6 |
70,3 |
71,6 |
146,8 |
145,0 |
146,8 |
133,65 |
0,9286 |
0,9809 |
72,7 |
71,3 |
72,6 |
147,7 |
145,9 |
147,7 |
140,00 |
0,6995 |
0,8986 |
76,5 |
75,1 |
76,1 |
150,7 |
148,9 |
150,5 |
145,00 |
0,5564 |
0,8231 |
79,6 |
78,1 |
78,9 |
153,2 |
151,3 |
152,8 |
150,00 |
0,4376 |
0,7377 |
82,7 |
81,1 |
81,8 |
155,7 |
153,8 |
155,2 |
154,92 |
0,3390 |
0,6441 |
85,8 |
84,2 |
84,7 |
158,1 |
156,2 |
157,4 |
160,00 |
0,2522 |
0,5374 |
89,0 |
87,3 |
87,7 |
160,7 |
158,7 |
159,8 |
165,00 |
0,1787 |
0,4228 |
92,1 |
90,4 |
90,7 |
163,2 |
161,3 |
162,1 |
170,00 |
0,1147 |
0,2991 |
95,3 |
93,6 |
93,8 |
165,8 |
163,8 |
164,4 |
179,94 |
0,0101 |
0,0312 |
101,8 |
99,9 |
100,0 |
171,0 |
169,0 |
169,1 |
180,96 |
0,0000 |
0,0000 |
102,4 |
100,5 |
100,5 |
171,5 |
169,5 |
169,5 |

Рис. 5. Энтальпийная диаграмма
