
- •Лабораторная работа № 1
- •Приготовление раствора карбоната натрия с заданным процентным содержанием растворённого вещества методом разбавления
- •Лабораторная работа 3
- •"Химическое равновесие"
- •Опыт 1. Влияние концентрации реагирующих веществ
- •На состояние химического равновесия
- •Ход опыта
- •Результаты и наблюдения
- •Обработка результатов
- •Опыт 2. Влияние температуры на состояние химического равновесия
- •Лабораторная работа 4 «Электролиты» Опыт 1. Влияние соли слабой кислоты на диссоциацию этой кислоты
- •Опыт 2. Влияние соли слабого основанияна диссоциацию этого основания
- •Опыт 3. Получение кислой соли
- •Ход опыта
- •Результаты опыта
- •Обработка результатов
- •Опыт 4. Получение основной соли
- •Ход опыта
- •Результаты и наблюдения
- •Лабораторная работа 5
- •Результаты и наблюдения
- •Обработка результатов
- •Опыт 2. Совместный гидролиз двух солей
- •Лабораторная работа № 7
- •"Окислительно-восстановительные реакции"
- •Влияние среды на окислительные свойства перманганата калия
- •Ход опыта
- •Результаты и наблюдения
- •Обработка результатов
Отчеты по лабораторным работам 2012
ОГЛАВЛЕНИЕ
Лабораторная работа №1 "Приготовление растворов
заданной концентрации"…………………………………………………….….
Лабораторная работа №2 "Термохимические измерения"…………………....
Лабораторная работа №3 "Химическое равновесие"………………………...
Лабораторная работа №4 "Электролиты"…...
Лабораторная работа №5 "Условия образования и растворения осадков. Произведение растворимости"…...
Лабораторная работа №6 "Гидролиз"…...
Лабораторная работа №7 "ОВР"…...
Лабораторная работа № 1
"Приготовление растворов заданной концентрации"
Приготовление раствора карбоната натрия с заданным процентным содержанием растворённого вещества методом разбавления
В ходе лабораторной
работы необходимо приготовить 250 мл
раствора карбоната натрия (![]() )
с заданной концентрацией (
)
с заданной концентрацией (![]() ).
).
Ход опыта
Получить у преподавателя задание процентное содержание растворённого вещества , определить по табл. 1 плотность раствора заданной концентрации
 .
.
= 250 мл; = %; = г/мл.
Определить процентное содержание растворённого вещества в исходном растворе карбоната натрия
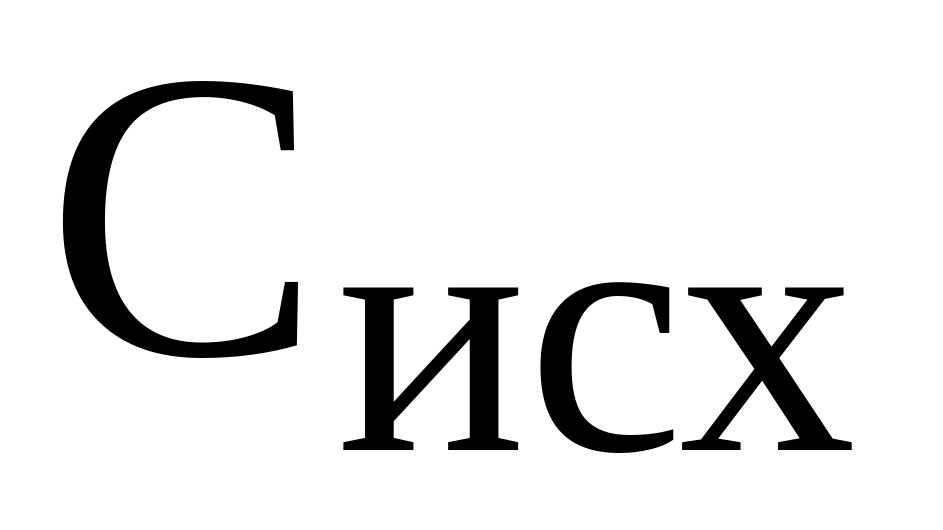 по плотности исходного раствора
по плотности исходного раствора
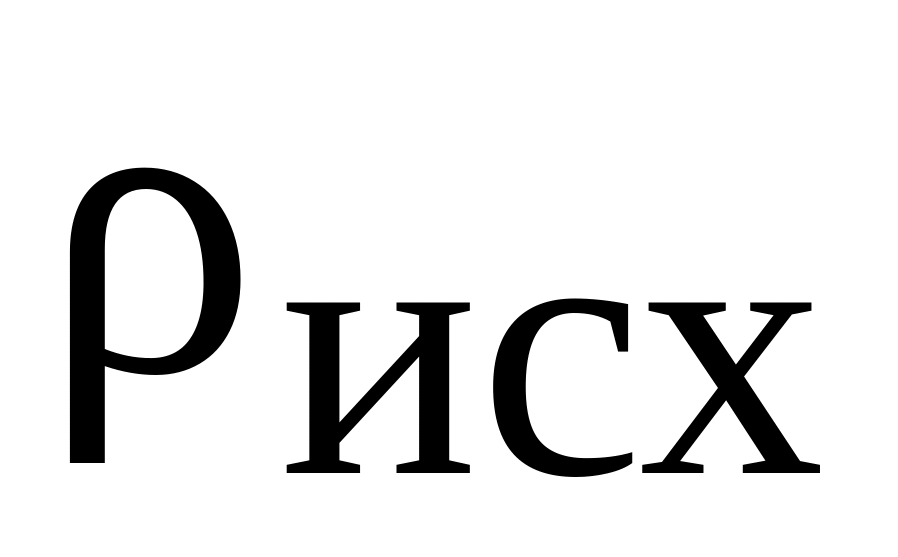 .
Плотность измерить с помощью ареометра.
Для этого исходным раствором заполнить
мерный цилиндр вместимостью 250 мл и
погрузить в него ареометр таким образом,
чтобы он не касался дна и стенок цилиндра.
Плотность раствора соответствует
делению шкалы ареометра, совпадающему
с нижней точкой мениска жидкости.
Процентное содержание растворённого
вещества в исходном растворе определить
по табл. 1.
.
Плотность измерить с помощью ареометра.
Для этого исходным раствором заполнить
мерный цилиндр вместимостью 250 мл и
погрузить в него ареометр таким образом,
чтобы он не касался дна и стенок цилиндра.
Плотность раствора соответствует
делению шкалы ареометра, совпадающему
с нижней точкой мениска жидкости.
Процентное содержание растворённого
вещества в исходном растворе определить
по табл. 1.
%; г/мл.
Рассчитать объём исходного раствора
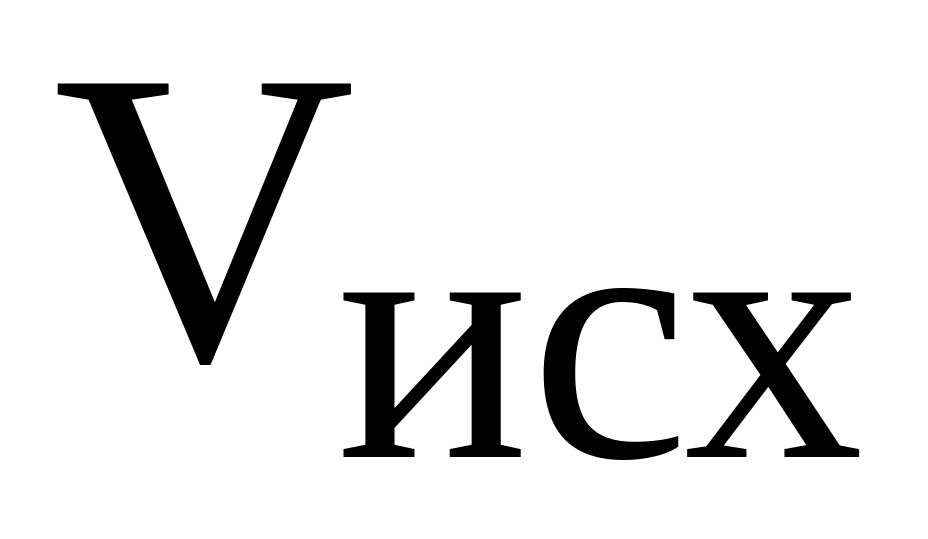 (мл), необходимый для приготовления
определённого объёма раствора (
)
с заданным процентным содержанием
растворённого вещества (
).
Результат расчёта округлить до 0,1 мл.
(мл), необходимый для приготовления
определённого объёма раствора (
)
с заданным процентным содержанием
растворённого вещества (
).
Результат расчёта округлить до 0,1 мл.


= мл
Приготовить раствор (в мерном цилиндре вместимостью 250 мл):
отмерить необходимый объём исходного раствора карбоната натрия;
довести объём жидкости в цилиндре до 250 мл водой;
тщательно перемешать приготовленный раствор, для чего перелить раствор в стакан, а затем из стакана снова в мерный цилиндр.
Измерить плотность приготовленного раствора, по табл. 1 определить соответствующее процентное содержание растворённого вещества, полученные данные записать в табл. 2.
Таблица 1
Процентное содержание растворённого вещества (С)
и плотность раствора карбоната натрия ()
-
С, %
, г/мл
С, %
, г/мл
2
3
4
5
6
7
8
9
10
1,02
1,03
1,04
1,05
1,06
1,07
1,08
1,09
1,10
11
12
13
14
15
16
17
18
1,11
1,12
1,13
1,15
1,16
1,17
1,18
1,19
Таблица 2
Плотность раствора карбоната натрия и процентное
содержание растворённого вещества
-
Раствор
, г/мл
С, %
заданный
приготовленный
Вывод
Приготовление раствора методом разбавления выполняют в следующей последовательности:

Лабораторная работа 2
Термохимические измерения
Определение энтальпии нейтрализации
Цели опыта
Определить, является реакция нейтрализации экзо- или эндотермической.
Рассчитать значение энтальпии нейтрализации на основе калориметрических измерений.
Составить термохимическое уравнение нейтрализации соляной кислоты гидроксидом натрия.
Ход опыта
Опыт проводят в упрощенном калориметре (стакан в стакане).
Во внутренний стакан калориметра налейте из бюретки 30 мл 0,5М раствора соляной кислоты, поместите термометр и измерьте начальную температуру (t1). Термометр оставьте в стакане до конца эксперимента.
В другой стакан отмерьте из бюретки 30 мл 0,5М раствора гидроксида натрия.
Быстро вылейте раствор щелочи в стакан с кислотой (внутренний стакан калориметра), осторожно перемешайте полученный раствор и измерьте конечную температуру раствора (t2).
Результаты опыта
Исходные данные и результаты опыта:
Объем раствора кислоты

 = ______ мл = _______ л;
= ______ мл = _______ л;Объем раствора щелочи
 = _______ мл = ________ л;
= _______ мл = ________ л;Концентрация раствора кислоты
 = _____ моль/л;
= _____ моль/л;Концентрация раствора щелочи
 = _____ моль/л;
= _____ моль/л;начальная температура
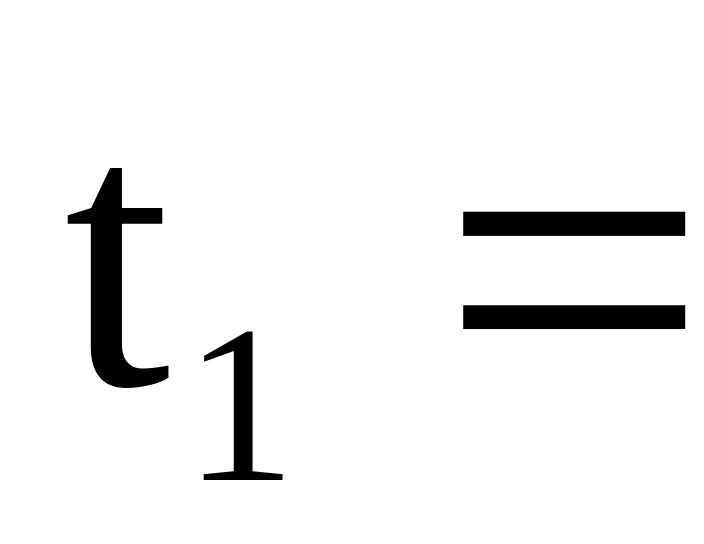 ______ 0С;
______ 0С;конечная температура
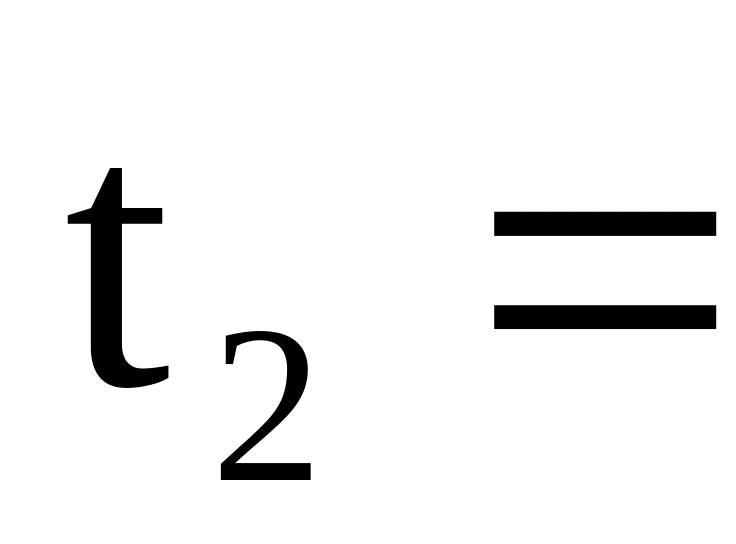 _____ 0С.
_____ 0С.
Обработка результатов
Количество выделившейся при нейтрализации теплоты:
![]() ___________________ =
_________ Дж = ________ кДж,
___________________ =
_________ Дж = ________ кДж,
где c – удельная теплоемкость раствора, принять равной удельной теплоемкости воды, c = 4,18 Дж/(г·К);
V – объем полученного раствора, мл, V ≈ Vк + Vщ;
ρ – плотность раствора, принять равной плотности воды, ρ ≈ 1 г/мл;
![]() – разность конечной
и начальной температур, К;
– разность конечной
и начальной температур, К;
![]() .
.
Количество вещества хлороводорода и гидроксида натрия, взятое для реакции:
![]() ________________________ =
____________ моль,
________________________ =
____________ моль,
где
![]() – молярная концентрация раствора
кислоты (щелочи), моль/л;
– молярная концентрация раствора
кислоты (щелочи), моль/л;
Vк – объем раствора кислоты, л;
Vщ – объем раствора щелочи, л.
Количество теплоты, выделяющейся при нейтрализации 1 моль реагента:
![]() =
_________ кДж/моль.
=
_________ кДж/моль.
Энтальпия нейтрализации:
ΔН = – Q = _____________ кДж/моль.
Вывод
Реакция нейтрализации является _____________________________________
(экзотермической, эндотермической)
Термохимическое уравнение реакции нейтрализации соляной кислоты гидроксидом натрия:
