
- •Пульмонология
- •Диагностика хронического бронхита
- •Инструментальные исследования
- •Программа обследования
- •Лечение
- •Предрасполагающие факторы бронхиальной астмы
- •Предрасполагающие факторы бронхиальной астмы
- •Патогенез бронхиальной астмы
- •Классификация
- •I. Этапы развития бронхиальной астмы
- •III. Клинико-патогенетические варианты бронхиальной астмы.
- •IV. Тяжесть течения.
- •V. Фаза течения бронхиальной астмы
- •VI. Осложнения
- •Классификация
- •Клинические симптомы астматического статуса
- •1 Стадия астматического статуса
- •Диагностика
- •2 Стадия астматического статуса
- •3 Стадия астматического статуса
- •Программа обследования при астматическом статусе
- •Алгоритм № 3 по лечению астматичесокого статуса (Даниляк и.Г., Гуляева ф.Е.)
- •(Лечение проводится в палате интенсивной терапии)
- •III стадия (лечение в отделении реанимации)
- •Больных с анафилактическим вариантом астматического статуса
- •Диагностические критерии плевритов
- •Патогенез
- •Классификация легочного сердца
Пульмонология
Пневмония. Современные представления об этиологии, патогенезе. Классификация. Шкала оценки степени тяжести пневмонии. Необходимый диагностический минимум по рекомендациям Европейского общества пульмонологов. Критерии диагноза пневмонии.
Пневмония - это острое инфекционное заболевание, протекающее с образованием воспалительного экссудата в паренхиме легкого и затемнением при рентгенографии, которое ранее отсутствовало (при этом нет других известных причин возникновения затемнения при рентгенологическом исследовании легких)". Вместе с тем, более отражающим суть этого заболевания, представляется другая формулировка: "Пневмонии - это группа различных по этиологии, патогенезу и морфоло-гической характеристике острых очаговых инфекционных заболеваний легких с преимущественным поражением респираторных отделов и наличием внутриальвеолярной экссудации"
В нашей стране, как и во всем мире, в настоящее время используется этиопатогенетическая (клинико-эпидемиологическая) рубрификация пневмонии. В основе ее лежит принцип разделения пневмоний в зависимости от условий, в которых развилось заболевание (внебольничные и госпитальные), механизма попадания в дыхательные пути инфекционного агента (аспирационные), особенностей клинических проявлений (атипичные пневмонии) и состояния организма (пневмонии при тяжелых нарушениях иммунитета). Каждый из этих вариантов имеет характерную, свойственную в большей степени одному из них, группу возбудителей. Практическая ценность данного подхода состоит в том, что при используемом ныне эмпирическом подходе к антибактериальной терапии, инициальное лечение антибиотиками можно осуществлять, опираясь на анамнестические сведения в зависимости от чувствительности микробов каждой из указанных групп. Действующий в России Стандарт предписывает различать внебольничные, госпитальные и пневмонии у лиц с иммунодефицитами. При этом Консенсус между Европейским респираторным обществом и Американским торакальным обществом предлагает выделять: 1. Внебольничные (распространенные, бытовые) пневмонии 2. Госпитальные (внутрибольничные, нозокомиальные) пневмонии 3. Атипичные пневмонии 4. Пневмонии у лиц с тяжелыми дефектами иммунитета
В странах СНГ принята классификация пневмонии по О.В. Коровиной(1987). Согласно этой классификации, пневмонии разделяют:
по этиологии - бактериальная (с указанием вида возбудителя), вирусная, микоплазменная, смешанной природы (вирусно-бактериальная), аллергическая (острый эозинофильный инфильтрат, синдром Леффлера), обусловленная физико-химическими факторами;
по патогенезу - первичная (у ранее здоровых лиц), вторичная , как осложнение других заболеваний (например, у больного ХОЗЛ, аспирационная и др.);
по течению - остротекущая, затяжная (более 4 недель);
по клинико-рентгенологическим данным - паренхиматозная (долевая, очаговая), интерстициальная (с преимущественным поражением перибронхиальной ткани);
по осложнениям - осложненная и неосложненная.
Осложнения пневмонии
Осложнения пневмонии делят на легочные и внелегочные.
Легочные осложнения:
реактивный плеврит (вследствие обструкции лимфатических ходов и венозного дренажа) парапневмонический (на высоте пневмонии) и метапневмонический;
эмпиема плевры (проникновение пиогенной инфекции в плевральное пространство);
некротизирующая пневмония с абсцедированием (деструкция легочной ткани с накоплением «обломков» в зоне воспаления), обусловленная анаэробной или Гр− инфекцией;
бронхообструктивный синдром;
массивный коллапс или отек легких;
острый респираторный дистресс-синдром у взрослых (ОРДСВ);
гипоксемия с острой дыхательной недостаточностью (острое нарушение функции внешнего дыхания, характеризующееся недостаточным обеспечением организма кислородом и выведением углекислого газа).
В последнем случае уплотнение легочной ткани вызывает гиповентиляцию и нарушение соотношения “вентиляция-перфузия” с формированием гипоксемии, которая относительно резистентна к кислородотерапии. У пожилых больных хроническими обструктивными заболеваниями легких (у которых уже есть локальные нарушения соотношения “вентиляция-перфузия”) может развиться сильная дыхательная недостаточность с резистентной к лечению гипоксемией.
Внелегочные осложнения (бактериальные вследствие выхода бакктерий в кровяное русло и отсева микробов в другие органы):
сепсис с инфекционно-токсическим шоком (обусловлен высвобождением эндотоксина и липополисахаридов из бактериальной клетки), чаще встречается при Гр− и пневмококковой инфекции;
ДВС-синдром;
инфекционно-аллергический миокардит;
бактериальный эндокардит;
перикардит;
очаговый нефрит и острая почечная недостаточность;
вторичный гнойный менингит;
гепатит;
артрит;
тромбофлебит;
отит;
медленное разрешение пневмонии,
а также острое и подострое легочное сердце.
Классификация пневмоний за рубежом
За рубежом пневмонии классифицируют следующим образом:
первичная, типичная (амбулаторная). Может быть первичной или вторичной на фоне имеющихся заболеваний (хронические обструктивные заболевания легких, сахарный диабет и др.) или предрасполагающих факторов;
вторичная (госпитальная, аспирационная);
при нарушениях иммунитета;
атипичная (обычно врач общей практики имеет дело с десятью такими больными за год).
Чаще всего пневмония разрешается спонтанно, с восстановлением нормальной структуры бронхолегочной ткани. В некоторых случаях идет стимуляция фибробластов, усиливается синтез соединительной ткани (ремоделирование легких) и формируется постпневмонический, сегментарный пневмосклероз.
Этиология пневмоний
Рассматривать вопросы лечения пневмоний в отрыве от этиологических аспектов этой проблемы практически невозможно. По официальным данным МЗ РФ [7]спектр возбудителей пневмонии в нашей стране представлен следующим образом:
|
Внебольничные пневмонии: |
Госпитальные пневмонии: |
|
Streptococcus pneumoniae; Mycoplasma pneumoniae; Haemophilus influenzae; Influenza virus; Chlamidia (Chlamydophila) pneumoniae; Legionella spp.; Staphylococcus aureus - редко; Грамотрицательная флора - редко; В 20-50% этиология пневмоний не устанавливается; |
Staphylococcus aureus;Streptococcus pneumoniae; Pseudomonas aeruginoza;Klebsiella pneumoniae; Escherichia coli;Proteus mirabilis; Legionella pneumophila; Haemophilus influenzae; Анаэробы; Вирусы (цитомегаловирус и др.); Грибы (Aspergillus, Candida); Pneumocystis carini |
Наиболее частыми бактериальными возбудителями внебольничных пневмоний традиционно являются пневмококки и гемофильные палочки. Вместе с тем, в последние годы все больше акцентируется эпидемиологическая значимость ранее малоизвестных агентов, таких как легионеллы, микоплазмы, хламидии, пневмоцисты, грибы. Серьезной проблемой является возрастающая приобретенная резистентность к антибиотикам многих микроорганизмов. У молодых лиц пневмонии чаще вызываются моноинфекцией, а у лиц старше 60 лет - ассоциациями возбудителей, представленных обычно сочетанием грамположительной и грамотрицательной флоры. Аспирационные пневмонии обусловлены попаданием в дыхательные пути из желудка (при регургитации) неклостридиальных облигатных анаэробов (Bacteroides fragilis, Bacteroides melaninogenicus, Fusobacterium nucleatum, Peptococcus и др.) чаще всего в сочетании с разнообразной грамотрицательной палочковой микрофлорой. Пневмонии у лиц с тяжелыми нарушениями иммунитета связаны с цитомегаловирусной инфекцией, патогенными грибами, Pneumocystis carinii, микобактериями туберкулеза, а также практически со всеми микробными агентами, упоминавшимися в других рубриках. На протяжении последних лет во всем мире наблюдается стремительный рост резистентности возбудителей пневмоний к антибактериальным препаратам. Значительно увеличилась доля пневмоний, вызываемых штаммами S. pneumoniae, устойчивыми к пенициллину и цефалоспоринам первых генераций.
Патогенез.Наиболее частым путём проникновения микроорганизмов в лёгочную ткань является бронхогенный — и этому способствуют: аспирация, вдыхание микробов из окружающей среды, переселение патогенной флоры из верхних отделов дыхательной системы (нос, глотка) в нижний, медицинские манипуляции — бронхоскопия, интубация трахеи, искусственная вентиляция легких, ингаляциялекарственных веществ из обсеменённых ингаляторов и т. д. Гематогенный путь распространения инфекции (с током крови) встречается реже — при внутриутробном заражении, септических процессах и наркомании с внутривенным введением наркотиков. Лимфогенный путь проникновения встречается очень редко. Далее, при пневмонии любой этиологии, происходит фиксация и размножение инфекционного агента в эпителииреспираторных бронхиол — развивается острыйбронхит или бронхиолит различного типа — от лёгкого катарального до некротического. Распространение микроорганизмов за пределы респираторных бронхиол вызывает воспаление лёгочной ткани — пневмонию. За счёт нарушения бронхиальной проходимости возникают очаги ателектаза и эмфиземы. Рефлекторно, с помощью кашля и чихания, организм пытается восстановить проходимость бронхов, но в результате происходит распространение инфекции на здоровые ткани, и образуются новые очаги пневмонии. Развивается кислородная недостаточность, дыхательная недостаточность, а в тяжёлых случаях и сердечная недостаточность. Больше всего поражаются II, VI, X сегменты правого лёгкого и VI, VIII, IX, X сегменты левого лёгкого. Часто в процесс вовлекаются и регионарные лимфатические узлы — бронхопульмональные, паратрахеальные, бифуркационные.
ДИАГНОСТИКА
ПЛАН ОБСЛЕДОВАНИЯ
Диагноз внебольничной пневмонии необходимо предполагать при наличии лихорадки, кашля, одышки, отделения мокроты и/или болей в груди. Для верификации диагноза необходимо провести: рентгенографию лёгких (инфильтративное, обычно одностороннее затемнение лёгочной ткани), общий анализ крови (лейкоцитоз).
Методы лабораторной диагностики пневмонии:
Клинический анализ крови (неспецифические воспалительные признаки: лейкоцитоз, изменения в лейкоцитарной формуле, ускоренная СОЭ).
Биохимические анализы крови (исследование С-реактивного белка, функциональные тесты печени, почек, уровень гликемии и др.).
Исследование мокроты: бактериоскопия мазка, окрашенного по Грамму; культуральное исследование; определение чувствительности к антибактериальным препаратам.
Микробиологическое исследование образцов крови со средами для культивирования аэробов и анаэробов (у больных, требующих госпитализации в ОАРИТ).
Серологические методы диагностики внутриклеточных возбудителей (микоплазма, хламидия, легионелла).
Определение газов артериальной крови (у больных с признаками дыхательной недостаточности).
Бронхоскопические методы исследования с использованием бронхоальвеолярного лаважа (БАЛ) и "защищенной" браш-биопсии (в случаях неэффективности терапии у пациентов с тяжелой внебольничной пневмонией иммунодефицитными состояниями или подозрением на наличие необычного возбудителя).
Методы лучевой диагностики пневмонии:
Обзорная рентгенография органов грудной клетки в передней прямой и боковой проекциях.
Компьютерная томография (КТ) легких (при неинформативности рентгенографического обследования, при необходимости дифференциальной диагностики, в случаях пневмоний с замедленным разрешением).
Ультразвуковое исследование (УЗИ) для оценки состояния плевры и плевральных полостей при развитии парапневмонических экссудативных плевритов.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
■ Больных беспокоят лихорадка в сочетании с кашлем, одышкой, отделением мокроты и/или болями в груди. Пациенты жалуются на немотивированную слабость, утомляемость, снижение аппетита.
■ При физикальном обследовании пациента отмечают укорочение (тупость) перкуторного звука над поражённым участком лёгкого, локально выслушиваемое бронхиальное дыхание, звучные мелкопузырчатые хрипы или крепитации на вдохе, усиление бронхофонии и голосового дрожания. Выраженность объективных признаков пневмонии зависит от размеров поражения легочной ткани.
■ Плевральный выпот (как правило, ограниченный) осложняет течение внебольничной пневмонии в 10–25% случаев и не имеет особого значения в определении этиологии заболевания.
■ Образование полостей деструкции в лёгких не характерно для пневмонии пневмококковой, микоплазменной и хламидийной этиологии, и скорее свидетельствует в пользу инфекции, вызванной стафилококками, аэробными грамотрицательными бактериями кишечной группы и анаэробами.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
■ К обязательным лабораторным исследованиям относят общий анализ крови: лейкоцитоз более 10–12·109/л указывает на высокую вероятность бактериальной инфекции, а лейкопения ниже 3·109/л или лейкоцитоз выше 25·109/л служат неблагоприятными прогностическими признаками.
■ У пациентов с явлениями дыхательной недостаточности в амбулаторных условиях необходимо провести дополнительное исследование — пульсоксиметрию (с целью определения насыщения крови кислородом). Сатурация кислородом менее 88% — прогностически неблагоприятный признак, указывающий на необходимость помещения больного в отделение интенсивной терапии.
■ Рутинная микробиологическая диагностика пневмонии в амбулаторной практике недостаточно информативна и не оказывает существенного влияния на выбор антибактериального ЛС.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Рентгенологическое исследование лёгких — обязательный инструментальный метод исследования у больных с пневмонией.
■ Рентгенологический признак пневмонии — инфильтративное, обычно одностороннее затемнение лёгочной ткани, которое может быть очаговым, сливным, сегментарным (полисегментарным), долевым (обычно гомогенным) или тотальным. Рентгенологическое исследование следует проводить в двух проекциях — заднепередней и боковой. При выполнении исследования следует оценить распространённость инфильтрации, наличие или отсутствие плеврального выпота, полости деструкции, признаков сердечной недостаточности.
■ В большинстве случаев, основываясь на анализе клинико-рентгенологической картины заболевания, не удаётся с определённостью высказаться о вероятной этиологии внебольничной пневмонии.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ
Диагноз внебольничной пневмонии может быть определённым, неточным/неопределённым и маловероятным.
■ Диагноз внебольничной пневмонии считают определённым при наличии у больного рентгенологически подтверждённой пневмонической инфильтрации лёгочной ткани и, по крайней мере, 2 следующих клинических признаков: острое начало заболевания с подъёмом температуры тела выше 38 °С; кашель с мокротой, возможно, малопродуктивный; признаки пневмонии, выявленные при физикальном обследовании (крепитации и/или мелкопузырчатые хрипы, жёсткое и/или бронхиальное дыхание, укорочение перкуторного звука); лейкоцитоз (более 10·109/л) и/или палочкоядерный сдвиг (более 10%).
■ При отсутствии или невозможности рентгенологического подтверждения очаговой инфильтрации в лёгких (рентгенография или крупнокадровая флюорография) диагноз пневмонии неточный (неопределённый).
■ Если при обследовании пациента с лихорадкой, жалобами на кашель, одышку, отделение мокроты и/или боли в груди рентгенологическое исследование органов грудной клетки оказывается недоступным и отсутствует соответствующая локальная симптоматика (укорочение или тупость перкуторного звука над поражённым участком лёгкого, локально выслушиваемое бронхиальное дыхание, звучные мелкопузырчатые хрипы или крепитации на вдохе, усиление бронхофонии и голосового дрожания), то диагноз внебольничной пневмонии маловероятен.
Диагностика пневмонии не относится к числу сложных медицинских задач, если соблюдать определенные правила. Существует понятие «золотого стандарта» при установлении диагноза пневмонии, он складывается из 5 признаков:
• острое начало заболевания с лихорадкой;
• появление кашля, гнойной мокроты;
• укорочение перкуторного звука и появление аускультативных признаков пневмонии над пораженным участком легкого;
• лейкоцитоз или (реже) лейкопения с нейтрофильным сдвигом;
• при рентгенологическом исследовании – инфильтрат в легких, который ранее не определялся.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Внебольничную пневмонию следует дифференцировать со следующими заболеваниями.
■ Подозревать туберкулез лёгких следует в случаях «стертого» начала заболевания и клинических симптомов, отсутствия эффекта от антибактериальной терапии в течение 7–10 сут. Необходимо учитывать социальный статус пациента, контакт с больным туберкулезом, особенности рентгенологических изменений в лёгких. В случае проведения антибактериальной терапии больным на этапе дифференциальной диагностики исключают препараты с антимикобактериальной активностью (фторхинолоны, рифампицин, аминогликозиды).
■ С целью исключения новообразования всем курящим лицам в возрасте старше 40 лет, а также пациентам из других групп риска развития онкологического процесса, при медленном обратном развитии пневмонии, следует выполнять бронхоскопию с биопсией, а при необходимости КТ.
■ ТЭЛА необходимо исключать у больных, страдающих тромбофлебитом глубоких вен нижних конечностей.
■ Для дифференциальной диагностики с застойной сердечной недостаточностью следует провести ЭКГ, ЭхоКГ, консультацию кардиолога.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
■ При подозрении на туберкулез лёгких больного направляют на консультацию к фтизиатру.
■ Для дифференциальной диагностики с хронической сердечной недостаточностью необходима консультация кардиолога.
Критерии диагноза внебольничной пневмонии
Диагноз внебольничной пневмонии устанавливается на основании сочетания изменений на рентгенограмме (долевая или очаговая инфильтрация) с двумя из следующих признаков
Остролихорадочное начало заболевания (температура выше 38° С).
Кашель с мокротой.
Одышка (чатота дыхания более 20/мин)
Аускультативные признаки пневмонии (влажные мелкопузырчатые хрипы и/или крепитация) .
Лейкоцитоз более 10*10 9 /л и/или палочкоядерный сдвиг более 10%
Лейкопения менее 4*10 9 /л
Критерии диагноза госпитальной пневмонии
Появление "свежих" очагово-инфильтративных изменений в легких на рентгенограмме.
Два или более из следующих признаков:
Повышение температуры тела более 39° С.
Бронхиальная гиперсекреция.
PaO 2 менее 70 мм рт. ст. (при дыхании комнатным воздухом) или PaO 2 /FiO 2 240 мм рт.ст. (при ИВЛ или ингаляции кислорода)
Два или более из следующих признаков:
Кашель, одышка, аускультативные признаки пневмонии.
Лейкоцитоз более 10*10 9 /л и/или палочкоядерный сдвиг более 10%
Лейкопения менее 4*10 9 /л
Гнойная мокрота или бронхиальный секрет (в мазке полморфноядерные лейкоциты более 25 в поле зрения при малом увеличиении).
Для оценки пневмонии как тяжелой необходимо наличие хотя бы одного критерия.
Острая дыхательная недостаточность.
Частота дыхания более 30/мин.
Насыщение кислородом менее 90%
Гипотензия.
Систолическое артериальное давление менее 90 мм рт. ст.
Диастолическое артериальное давление менее 60 мм рт. ст.
Двухстороннее или многодолевое поражение легких.
Острая почечная недостаточность.
Нарушение сознания.
Тяжелая сопутствующая патология (застойная сердечная недостаточность 2 - 3 степени, цирроз печени, декомпенсированный сахарный диабет, хроническая почечная недостаточность).
Внелегочный очаг инфекции (менингит, перикардит и др.).
Лейкопения < 3х10 9 /л или лейкоцитоз > 25х10 9 /л.
Гемоглобин менее 100 г/л.
Гематокрит менее 30%
Общие принципы лечения
Первая задача, которую необходимо решить, это определение места лечения пациента. От степени тяжести заболевания зависит объем различных лечебно-диагностических мероприятий. Внебольничные пневмонии условно разделяют на 3 группы .: 1) пневмонии, не требующие госпитализации, 2) пневмонии, требующие госпитализации в стационар, 3) пневмонии, требующие госпитализации в отделения интенсивной терапии. Пневмонии, не требующие госпитализации - самая многочисленная группа, на ее долю приходится до 80% всех больных с пневмонией, эти больные имеют легкую пневмонию и могут получать терапию в амбулаторных условиях, летальность не превышает 1%. Пневмонии, требующие госпитализации в стационар - эта группа составляет около 20%, больные имеют фоновые хронические заболевания и выраженные клинические симптомы, риск летальности госпитализированных больных достигает 10%. ЦЕЛИ ЛЕЧЕНИЯ
■ Эрадикация возбудителя, купирование симптомов заболевания, нормализация лабораторных показателей и функциональных нарушений.
■ Разрешение инфильтративных изменений в лёгочной ткани и профилактика осложнений заболевания.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализации подлежат больные по следующим показаниям:
■ При наличии пневмонической инфильтрации в легочной ткани и, по крайней мере, 2 следующих клинических признаков:
✧ острое начало заболевания с подъёмом температуры тела выше 38 °С;
✧ кашель с мокротой, возможно, малопродуктивный;
✧ ЧДД дыхания ≥20 в минуту;
✧ крепитации и/или мелкопузырчатые хрипы, жёсткое или бронхиальное дыхание, укорочение перкуторного звука;
✧ лейкоцитоз (более 10·109/л) и/или палочкоядерный сдвиг (более 10%).
■ При неэффективности антибактериальной терапии в течение 3 сут и более.
■ Вопрос о стационарном лечении должен быть рассмотрен в следующих случаях.
✧ Возраст пациента старше 60 лет.
✧ Больной страдает сопутствующими заболеваниями (хронический бронхит или ХОБЛ, бронхоэктазы, злокачественные новообразования, сахарный диабет, ХПН, хроническая сердечная недостаточность, хронический алкоголизм, наркомания, выраженный дефицит массы тела, цереброваскулярные заболевания).
✧ Предпочтения пациента и/или членов его семьи.
■ В случаях, когда у больного имеют место признаки тяжёлого течения внебольничной пневмонии (ЧДД ≥30 в минуту; систолическое АД менее 90 мм рт.ст., двусторонняя или многодолевая пневмоническая инфильтрация, быстрое прогрессирование очагово-инфильтративных изменений в лёгких, септический шок или необходимость введения вазопрессоров в течение 4 ч и более, ОПН), показана неотложная госпитализация при помощи скорой медицинской помощи в отделение/палату интенсивной терапии Критерии внебольничной пневмонии, требующей госпитализации в отделение интенсивной терапии: Острая дыхательная недостаточность: гипоксемия (PaO2 / FiO2 < 250 мм рт.ст. < 200 мм рт.ст. у больных ХОБЛ); признаки утомления диафрагмы; потребность в искусственной вентиляции легких Нестабильная гемодинамика: шок (систолическое АД < 90 мм рт.ст. или диастолическое АД < 60 мм рт.ст.); потребность в вазопрессорах более 4 часов; диурез < 20 мл/час (при отсутствии гиповолемии) Острая почечная недостаточность, требующая проведения диализа ДВС-синдром Менингит Кома .
Оценка тяжести пневмонии
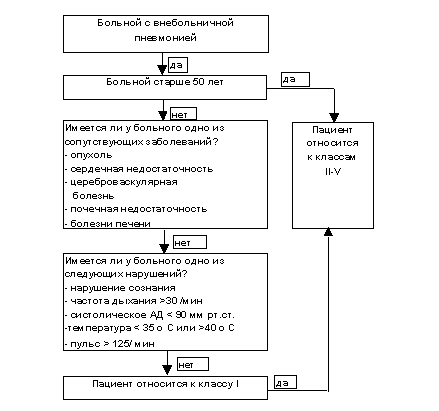
Объективная оценка тяжести состояния больного является, необходим инструментом для принятия решения о тактике ведения больного, его транспортировке, об оптимальном месте терапии больного (специализированное отделение, отделение интенсивной терапии), для сравнения исходов в зависимости от методов терапии, качества оказания помощи. Наиболее актуальной проблемой при первичной оценке больного с пневмонией является вопрос о том, где больной должен получать терапию: в домашних условиях (т.е. госпитализация не требуется), в условиях отделения стационара или в условиях реанимационного отделения. Применение шкал тяжести пневмоний и рекомендаций респираторных сообществ, позволяет значительно уменьшить расходы на лечение и частоту неудач терапии. Одной из наиболее распространенных шкал для оценки тяжести и прогноза внебольничной пневмонии является шкала, предложенная M. Fine в 1997 г. [13]. Оценке подлежат 20 параметров, из них 3 – демографических, 5 – характер и тяжесть сопутствующей патологии, 5 – данные клинического исследования, 7 – лабораторные показатели. В зависимости от количества баллов выделено 5 групп пациентов (классы риска). Приведенная шкала тяжести пневмонии, так называемая прогностическая шкала PORT (Pneumonia Patient Outcomes Research Team), учитывает факторы риска неблагоприятного исхода и может служить ориентиром при решении вопроса о госпитализации.Используя этот алгоритм, можно провести классификацию больных в соответствии с имеющимися факторами риска. Чем больше баллов имеет больной, тем более вероятен плохой прогноз заболевания. Пациенты, относящиеся к I, II и III классам риска, имеют невысокий риск летальности (менее 5%), и могут получать терапию (антибиотики per os или парентерально) во внебольничных условиях. Пациенты IV и V классов имеют более высокий риск летальности (до 30%), и должны быть доставлены в стационар и получать парентеральную терапию. Больные, относящиеся к V классу, как правило, имеют тяжелую пневмонию и нуждаются в интенсивной терапии. Оценка больных с пневмонией по шкале Fine проводится в два этапа. На первой этапе определяют больных с очень низким риском летальности (класс I): возраст больных менее 50 лет, отсутствие сопутствующих заболеваний, отсутствие жизненно важных нарушений. На втором этапе проводится подсчет суммы баллов на основании данных о возрасте, наличии сопутствующих заболеваний, жизненно важных функ-циональных нарушениях, а также эпидемиологических, лабораторных, газометриче-ских и рентгенографических данных, выполняется стратификация больных на классы II-V (рис. 1, табл. 1). Данные о сроках госпитализации и летальности больных с вне-больничной пневмонией в соответствии с оценкой по шкале Fine представлены в табл. 2 [13]. Таблица 1 Балльная система для оценки факторов риска при внебольничной пневмонии [13]
|
Характеристика |
Баллы |
|
Демографические факторы | |
|
Возраст: мужчины Возраст: женщины Пребывание в домах ухода |
= возраст (лет) = возраст - 10 лет + 10 |
|
Сопутствующие заболевания | |
|
Опухоли Заболевания печени Застойная сердечная недостаточность Цереброваскулярная болезнь Заболевания почек |
+30 +20 +10 +10 +10 |
|
Физикальные признаки | |
|
Нарушение сознания Частота дыхания >30 /мин Систолическое АД < 90 мм рт.ст. Температура < 35 o C или >40 о С Пульс > 125/ мин |
+20 +20 +20 +15 +10 |
|
Лабораторные и рентгенологические данные | |
|
РН артериальной крови < 7,35 Мочевина крови > 10,7 ммоль /л Натрий крови < 130 ммоль /л Глюкоза крови > 14 ммоль/л Гематокрит < 30% РаО2 < 60 мм рт.ст. Плевральный выпот |
+30 +20 +20 +10 +10 +10 +10 |
Таблица 2 Категории риска и клинический профиль больных с внебольничной пневмонией в соответствии со шкалой Fine [13]
|
Класс |
I |
II |
III |
IV |
V |
|
Число баллов |
- |
<70 |
71-90 |
91-130 |
>130 |
|
Летальность,% |
0,1-0,4 |
0,6-0,7 |
0,9-2,8 |
8,5-9,3 |
27-31,1 |
|
Госпитализация более 7 дней, % |
25 |
33,8 |
45,8 |
62,8 |
72,6 |
Рисунок 1 Алгоритм оценки риска у больных с внебольничной пневмонией [13]
.
Лечение госпитальных пневмоний
Принципиально терапия госпитальных пневмоний (ГП) не отличается от таковой при лечении внебольничных пневмоний. Однако особенности этиологии (нозокомиальная инфекция), целый ряд отягощающих течение болезни факторов существенно влияют на спектр применяемых антибактериальных препаратов и объем средств патогенетической терапии. Для удобства выбора начальной антибактериальной терапии предложено подразделять ГП на 2 подгруппы. 1. Пневмонии, развивающиеся у пациентов в отделениях общего профиля без факторов риска, или ранние респиратор-ассоциированные пневмонии, развивающиеся у больных в отделениях интенсивной терапии и реанимации. Препаратами выбора для эмпирической терапии могут быть парентеральные цефалоспорины III поколения (цефотаксим или цефтриаксон) в максимальных дозах, а в качестве альтернативы следует рассматривать фторхинолоны. При высоком риске псевдомонадной этиологии ГП целесообразно назначить антисинегнойные цефалоспорины III-IV поколений (цефтазидим, цефоперазон, цефепим) в сочетании с аминогликозидами (амикацин, тобрамицин). Следует и в данном случае учитывать, что гентамицин в данном случае менее эффективен в связи с растущей резистентностью возбудителей ГП к данному препарату во многих регионах. 2. Поздние респиратор-ассоциированные пневмонии и пневмонии, возникающие у пациентов в отделениях общего профиля при наличии факторов риска (предшествующая антибактериальная терапия или антибиотикопрофилактика). У этой категории больных особенно высока вероятность этиологической роли псевдомонад и полирезистентных (госпитальных) штаммов энтеробактерий, стафилококков, энтерококков. Могут быть следующие варианты эмпирической терапии: карбапенемы внутривенно (меропенем 1 г 3 раза; имипенем 0,5 г 4 раза), антипсевдомонадные цефалоспорины IV поколения + аминогликозиды, антипсевдомонадные пенициллины (мезлоциллин, азлоциллин, пиперациллин, пиперациллин/тазобактам, тикарциллин/клавулановая кислота) + аминогликозиды, азтреонам + аминогликозиды, ципрофлоксацин (например, в комбинации с аминогликозидами); при подозрении на легионеллезную инфекцию - макролиды (эритромицин, азитромицин, мидекамицин и др.); при высокой вероятности стафилококковой или энтерококковой инфекции - гликопептиды (ванкомицин); при неэффективности предшествующей терапии, включавшей гликопептиды - противогрибковые препараты (амфотерицин В, флюконазол). При аспирационных ГП высока вероятность этиологической роли анаэробов, поэтому в схему лечения включают антианаэробные препараты широкого спектра действия (защищенные b-лактамы, цефокситин, цефотетан, цефметазол, карбапенемы) или узкой направленности (метронидазол, тинидазол, линкомицин, клиндамицин) в комбинации с другими антибиотиками. Таблица 4 Программа эмпирической антибактериальной терапии госпитальной пневмонии в отделениях общего профиля [17]
|
Группа больных |
Наиболее вероятные возбудители |
Препараты 1-го ряда1 |
Препараты 2-го ряда (резерв)2 | |
|
Основные средства |
Альтернативные средства | |||
|
I. Нетяжелое течение, отсутствие факторов риска, без предшествующего применения антибиотиков |
S.pneumoniae (PS); S.aureus (MS); H.influenzae; Enterobacteriaceae |
Цефуроксим + гентамицин; Амоксициллин /клавуланат + гентамицин |
Цефотаксим Цефтриаксон |
Цефепим3 Тикарциллин /клавуланат ±аминогликозиды Фторхинолоны 3,4 |
|
II. Тяжелое течение или наличие факторов риска или предшествующее применение антибиотиков |
Enterobacteriaceae S.aureus (MS, MR) S.pneumoniae (риск PR) Acinetobacter spp. |
Цефепим 3,5 |
Тикарциллин/клавуланат Пиперациллин/тазобактам |
Имипенем5 Меропенем5 Фторхинолоны 4 |
|
III. Любое течение при наличии факторов риска P.aeruginosa |
Те же + P.aeruginosa |
Цефтазидим5 Цефоперазон5 (+аминогликозид ) |
Цефепим5 Ципрофлоксацин5 (+ аминогликозид) |
Имипенем5 Меропенем5 |
|
IV. Риск аспирации или абсцедирование |
S.aureus K.pneumoniae Анаэробы |
Линкомицин ± аминогликозид Амоксициллин/клавуланат |
Цефалоспорин III + линкомицин или метронидазол Тикарциллин/клавуланат |
Цефепим или Фторхинолон (+ метронидазол) Имипенем Меропенем |
Примечание: 1 - отнесение препаратов в разряд основных или альтернативных средств должно быть обосновано с учетом локальных данных антибиотикорезистентности и курсовой стоимости лечения (с учетом непрямых затрат); 2 - назначаются при неэффективности стартовой терапии средствами 1-го ряда; 3 - при риске аспирации добавляют линкомицин или метронидазол; 4 - левофлоксацин, офлоксацин, ципрофлоксацин; 5 - при выделении S.aureus ( MR) назначают ванкомицин или линезолид или рифампицин; PS - пенициллинчувствительные штаммы; PR - пенициллинрезистентные штаммы; MS - метиициллинчувствительные штаммы; MR - метициллинрезистентные штаммы. Длительность антибиотикотерапии при ГП, определяеемая обычно индивидуально, варьирует в зависимости от характера течения и колеблется от 7-10 до 14-21 дня. Клиниче-ское улучшение не бывает явным в течение первых 48-72 часов и, следовательно, выбранную схему антимикробного лечения в этот период не следует менять; корректировать терапию лишь тогда, когда будет отмечено прогрессирующее ухудшение или будут получены соответствующие результаты первичного микробиологического исследования. Основным критерием завершения антибиотикотерапии является стойкая (в течение 3-4 дней) нормализация температуры. Сохранение отдельных клинических, лабораторных и/или рентгенологических признаков заболевания не является абсолютным показанием к про-должению антибактериальной терапии или ее модификации. В подавляющем большинстве случаев их разрешение происходит самопроизвольно или под влиянием патогенетической и симптоматической терапии.
Патогенетическая терапия неосложненных пневмоний
Как теперь стало очевидно, антибактериальнная терапия не всегда обеспечивает успех лечения и, как правило, должна сочетаться с проведением лечебных мероприятий, на-правленных на стимуляцию защитных и приспособительных реакций организма (нормализация нарушенных обменных процессов, стимуляция неспецифических факторов защиты ). Все это заставляет не только искать новые антибактериальные средства, но и хорошо знать возможности дополнительных методов лечения, позволяющих воздействовать на отдельные патогенетические звенья воспаления и обменные процессы.
Муколитики
Нормализация эндобронхиального гомеостаза является крайне важной задачей патогенетической терапии. В клинической практике при лечении пневмоний наиболее часто применяются следующие препараты: бромгексин (бисолвон), амброксол (лазолван, амбробене), ацетилцистеин (мукомист, мукобене), карбоцистеин (бронкатар, мукодин, мукопронт). Препараты группы ацетилцистеина содержат реактивные группы, разрывающие сульфгидрильные связи мукополисахаридов мокроты. Ацетилцистеин увеличивает синтез глютатиона, принимающего участие в процессах детоксикации, обладает защитными свойствами, направленными против свободных радикалов, реактивных метаболитов, ответственных за формирование хронического воспалительно процесса, особенно у курильщиков. Доказано, что к третьим суткам применения ацетилцистеина при пневмонии дренажная функция мелких бронхов существенно улучшается. Препараты группы карбоцистеина активируют сиаловую трансферазу - фермент бокаловидных клеток, что приводит к нормализации количества и уменьшению вязкости секрета. Карбоцистеин действует также как и мукорегулятор - способствует регенерации слизистой дыхательных путей, что особо важно при лечении больных хроническим бронхитом. Карбоцистеин, хотя и не обладает столь сильным муколитическим эффектом, как ацетилцистеин, однако имеет меньше побочных эффектов. Бромгексин используется сравнительно давно и зарекомендовал себя как хороший муколитик с минимальным количеством побочных эффектов (возможны лишь явления индивидуальной непереносимости: зуд кожи, сыпь, насморк, тошнота, диаррея). В настоящее время все большую популярность завоевывает препарат лазолван (амброксола гидрохлорид), являющий дериватом бромгексина ( бромгексин в организме человека метаболизируется в амброксол), что позволило не только снизить частоту побобочных реакций , но и повысить его эффективность. Амброксол стимулирует образование трахеобронхиального секрета пониженной вязкости за счет изменения химизма мукополисахаридов мокроты: во-первых, разрушая кислые мукополисахариды бронхиальной слизи, во-вторых, стимулируя выработку нейтральных мукополисахаридов бокаловидными клетками. Важной явля-ется также способность препарата повышать мукоцилиарный клиренс путем стимуляции двигательной активности ресничек мерцательного эпителия. Отмечен синергизм между амброксолом и антибиотиками, что позволяет снижать дозы последних, без ущерба для эффективности лечения. Отличительной особенностью препарата является его способность повышать синтез, секрецию сурфактанта и блокировать распад последнего под воз-действием неблагоприятных факторов. Эта способность амброксола делает необходимым его применение у больных, находящихся на длительной оксигенотерапии (при которой разрушается сурфактант) или ИВЛ. Оказывая положительное влияние на продукцию сур-фактанта, амброксол опосредованно повышает мукоцилиарный транспорт, что в сочетании с усилением секреции гликопротеидов (мукокинетическое действие) обуславливает выра-женный отхаркивающий эффект препарата. Следует отметить, что в условиях стационара наибльее эффективным путем введения муколитиков (лазолвана, ацетилцистеина) является ингаляционный через компрессорный или ультразвуковой небулайзер. При нахождении же больного в отделении интесивной терапии данный метод введения является приоритетным. Преимущества ингаляционного пути введения препарата: - создание высокой концентрации в дыхательных путях; - быстрота наступления эффекта; - минимум побочных эффектов; - только увеличение влажности вдыхаемого воздуха до 100 % уменьшает вязкость мокроты на 20 %; - возможность одновременного введения эффективных комбинаций различных препаратов; - при необходимости можно проводить ингаляции через контуры подачи кислорода и аппаратуру ИВЛ. Лазолван следует ингалировать по 2 мл (в 1мл - 7,5 мг амброксола) 3 раза в день. В случае выявления при спирографии существенных нарушений ФВД (обычно при наличии сопутствующей ХОБЛ) следует добавлять 1-2 мл беродуала. Параллельно можно использовать ингаляции через небулайзер физиологического раствора.
Брохологическая санация
Восстановление дренажной функции бронхов является одной из важнейших задач патогенетической терапии при пневмониях. Обтурация бронхов, дренирующих пораженные сегменты (частично или полностью) слизисто-гнойной пробкой по нашим данным наблюдается примерно у 40 % больных. Для удаления скопления мокроты используется фибробронхоскопия, а также санация бронхиального дерева интратрахеальными инстилляциями при помощи гортанного шприца или резинового зонда. Применяются обычно растворы антисептиков, муколитики (лазолван или10 % раствор ацетилцистеина), антибиотики (например флуимицил-антибиотик-комплексный препарат, состоящий из N-ацетилцистеина и тиамфеникола). Доза антибиотика, вводимая эндобронхиально может соответствовать среднесуточной. В комплексной эндобронхиальной терапии по показаниям применяются также иммуномодуляторы (тималин по 10 мг). Одна или несколько эндобронхиальных манипуляций позволяют существенно ускорить разрешение пневмонического процесса и снизить частоту осложнений. Накопленный нами опыт позволяет рекомендовать эндобронхиальную санацию для более широкого применения в комплексной терапии больных пневмониями.
Противовоспалительная терапия
Ограничение зоны пневмонической инфильтрации, уменьшение отека, снятие плевральных болей достигается назначением аспирина, индометацина, диклофенака, ибупрофена и др. нестероидных противовоспалительных препаратов. Вместе с тем, все они не лишены побочных эффектов. В том аспекте особое место занимает эреспал (феспирид). Данный противовоспалительный препарат не вызывает осложнений, свойственных стероидным и нестероидным препаратам. Применяемый преимущественно в пульмонологии фенспирид обладает способностью эффективно купировать воспалительные процессы в легких и плев-ре, уменьшает продукцию мокроты и препятствует бронхоконстрикции, восстанавливая таким образом адекватный дренаж бронхиального дерева. Это имеет важное значение при лечении больных, у которых пневмония возникает на фоне хронических обструктивных заболеваний легких. Используются дозировки 160-240 мг\ сутки.
Дифференциальная диагностика пневмоний вызванных различными возбудителями. Особенности медикаментозной терапии.
4.3.1. Пневмококковая пневмония. Наиболее частый вариант среди пневмоний в тесно взаимодействующих коллективах (30-70%). Возникает нередко во время эпидемий гриппа у больных с хроническими заболеваниями легких. Характерны острое начало, появление "ржавой" мокроты, herpes labialis (30%), клинико-рентгенологические признаки долевого поражения, часто возникает парапневмонический плеврит, редко наблюдается абсцедирование. Так называемые "круглые" пневмонии (рентгенологически выявляемые круглые очаговые тени, трудно отличимые от опухоли) наиболее часто встречаются при пневмококковых пневмониях у детей и взрослых. Как правило, наблюдается хороший эффект от применения пенициллинов. 4.3.2. Микоплазменная пневмония. Составляет около 10% всех случаев пневмоний в тесно взаимодействующих коллективах. Практически не встречается среди госпитальных пневмоний. Заболевают, главным образом, дети школьного возраста и взрослые в период вспышек микоплазменных инфекций (осенне-зимний период). Характерны постепенное начало с наличием катаральных явлений, относительно малая выраженность клинико-рентгенологической легочной симптоматики и признаки внелегочных поражений (миалгии, конъюнктивиты, поражение миокарда, гемолитические анемии). Рентгенологически характерны усиление и сгущение легочного рисунка, пятнистые затемнения без анатомических границ, преимущественно в нижних отделах. Отсутствует эффект от пенициллинов и цефалоспоринов. 4.3.3. Пневмонии, вызванные гемофильной палочкой. Возникают обычно на фоне хронических обструктивных заболеваний легких, сердечной недостаточности, часто у курильщиков, у лиц пожилого возраста, после неосложненных операций. Рентгенологически выявляются очагово-пятнистые затемнения. Отсутствует эффект от пенициллинов. 4.3.4. Легионеллезная пневмония.
Одна из форм легионеллезной инфекции составляет около 5% всех домашних и 2% госпитальных пневмоний. Факторами риска являются: земляные работы, проживание вблизи открытых водоемов, контакт с кондиционерами (легионеллы составляют часть естественных и искусственных водных экосистем и в кондиционерах обитают в конденсируемой при охлаждении влаге), иммунодефицитные состояния. Характерны острое начало, тяжелое течение, относительная брадикардия, признаки внелегочного поражения (диарея, увеличение печени, желтуха, повышение уровня трансаминаз, мочевой синдром, энцефалопатия). Рентгенологически - долевые затемнения в нижних отделах, возможно наличие плеврального выпота. Деструкции легочной ткани редки. Отсутствует эффект от пенициллинов. 4.3.5. Хламидиозные пневмонии. Составляют до 10% всех домашних пневмоний (по данным серологических исследований США). Фактором риска является контакт с птицами (голубеводы, владельцы и продавцы птиц). Возможны эпидемические вспышки в тесно взаимодействующих коллективах. Клинически характеризуются острым началом, непродуктивным кашлем, спутанностью сознания, ларингитом, болями в горле (у половины больных). 4.3.6. Стафилококковая пневмония. Составляет около 5% домашних пневмоний, значительно чаще отмечается при гриппозных эпидемиях. Фактором риска является хронический алкоголизм, может встречаться у пожилых больных. Обычно наблюдаются острое начало, выраженная интоксикация, рентгенологически выявляется полисегментарная инфильтрация с множественными очагами распада (стафилококковая деструкция). При прорыве в плевральную полость развивается пиопневмоторакс. В крови - нейтрофильный сдвиг, токсическая зернистость нейтрофилов, анемия. Возможно развитие сепсиса с очагами септикопиемии (кожа, суставы, головной мозг). 4.3.7. Пневмонии, вызванные анаэробной инфекцией. Возникают в результате анаэробных микроорганизмов ротоглотки (бактероиды, актиномицеты и др.) обычно у больных алкоголизмом, эпилепсией, с острыми нарушениями мозгового крообращения, в послеоперационном периоде, при наличии назогастрального зонда, нарушениях глотания (заболевания ЦНС, дерматомиозит и др.). Рентгенологически пневмонии локализуются обычно в заднем сегменте верхней доли и верхнем сегменте нижней доли правого легкого. Средняя доля поражается редко. Возможно развитие абсцесса легкого и эмпиемы плевры. 4.3.8. Пневмонии, вызванные клебсиеллой (палочка Фридлендера). Возникают обычно у больных хроническим алкоголизмом, сахарным диабетом, циррозом печени, после тяжелых операций, на фоне иммунодепрессии. Характерны острое начало, тяжелая интоксикация, дыхательная недостаточность, желеобразная мокрота с запахом пригорелого мяса (непостоянный признак). Рентгенологически - часто поражение верхней доли с хорошо подчеркнутой междолевой бороздой выпуклостью книзу. Возможно развитие одиночного абсцесса. 4.3.9. Пневмонии, вызванные кишечной палочкой. Часто возникают у больных сахарным диабетом с наличием хронического пиелонефрита, эпицистомы, у больных сенильной деменцией с недержанием мочи и кала (пациенты интернатов для престарелых). Локализуются часто в нижних долях, склонны к развитию эмпиемы. 4.3.10. Пневмонии вызванные синегнойной палочкой. Одна из форм госпитальных пневмоний, возникающих у тяжелых больных (злокачественные опухоли, операции, наличие трахеостомы), обычно находящихся в БИТ, реанимационных отделениях, подвергающихся искусственной вентиляции легких, бронхоскопии, другим инвазивным исследованиям, у больных муковисцидозом с наличием гнойного бронхита, бронхоэктазов. 4.3.11. Грибковые пневмонии. Возникают обычно у больных со злокачественными опухолями, гемобластозами, получающими химиотерапию, а также у лиц, длительно леченных антибиотиками (часто рецидивирующие инфекции), иммунодепрессантами (системные васкулиты, трансплантация органов). Отсутствует эффект от пенициллиновых, цефалоспориновых и аминогликозидных антибиотиков. 4.3.12. Пневмоцистные пневмонии. Вызываются микроорганизмом Phneumocystis carinii, относящимся к классу простейших (по некоторым данным к грибам). Встречается, главным образом, у больных с первичными и вторичными иммунодефицитами, на фоне иммунодепрессивной терапии после трансплантации органов, у больных гемобластозами, при ВИЧ-инфекции. Характерно несоответствие между тяжестью состояния и объективными данными. Рентгенологически характерны двусторонние прикорневые нижнедолевые сетчатые и сетчато-очаговые инфильтраты, склонные к распространению. Возможно образование кист. 4.3.13. Вирусные пневмонии. Возникают обычно в период вирусных инфекций (эпидемии гриппа А и др.). В клинической картине преобладают проявления соответствующей вирусной инфекции (грипп, аденовирусная инфекция, инфекция респираторно-синтициальным вирусом). Физикальная и рентгенологическая симптоматика при вирусных пневмониях скудная. Наличие чисто вирусных пневмоний признается не всеми. Предполагается, что вирусы вызывают нарушения в системе местной защиты легких (Т-клеточный дефицит, нарушения фагоцитарной активности, повреждение реснитчатого аппарата), способствующие возникновению бактериальных пневмоний. Вирусные (или "поствирусные") пневмонии часто не распознаются, даже у больных, у которых наблюдается "затяжное" течение острых респираторно-вирусных инфекций, развиваются признаки бронхиальной обструкции, наблюдаются изменения в крови. Часто ставится диагноз: остаточные явления перенесенной ОРВИ. В тесно общающихся коллективах наиболее часто встречаются пневмококковая, микоплазменная и вирусная пневмонии. В табл. 1 приведены основные дифференциально-диагностические признаки этих вариантов пневмоний.
|
Признаки |
Пневмококковая пневмония |
Вирусная пневмония |
Микоплазменная пневмония |
Легионеллезная пневмония |
|
Эпидемиоло- гическая ситуация |
Обычно отсутствует |
Эпидемии вирусных инфекций |
Вспышки микоплазменных инфекций (осень, зима) |
Путешествия, контакты с замкнутыми водными системами, коллектив |
|
Наличие фонового заболевания |
Часто ХОЗЛ |
Возможны ХОЗЛ, сердечная недостаточность |
Не характерно |
Возможно (иммунодепрессии) |
|
Внелегочные проявления |
Редко |
Миокардит |
Лимфоаденопатия, кожные высыпания, гемолитические анемии |
Поражения почек, кишечника |
|
Физикальные признаки легочного воспаления |
Характерны |
Не характерны |
Мало характерны |
Характерны |
|
Рентгенологические признаки очагового воспаления |
Лобарное затемнения |
Усиление, деформация, сетчатость легочного рисунка, очаговые затемнения |
Усиление и сгущение рисунка, пятнистые затемнение без четких границ |
Лобарные, сегментарные, субтотальные затемнения, часто двусторонние |
|
Периферическая кровь |
Лейкоцитоз со сдвигом влево, лимфоцитопения |
Лейкопения, относительный лимфоцитоз |
Возможен лимфоцитоз |
Лейкоцитоз со сдвигом влево, лимфоцитопения |
|
СОЭ |
Высокая |
Нормальная или повышенная |
Умеренно повышенная |
Высокая |
|
Эффективный антибиотик |
Пенициллин, цефалпориныос |
|
Тетрациклины, эритромицин |
Эритромицин, тетрациклины,рифампицин |
Идентификация возбудителя пневмоний. Точный этиологический диагноз является основой успешного лечения больного пневмонией. Около 30% случаев пневмоний остаются этиологически неидентифицированными, несмотря на использование адекватных методов исследования. 4.4.1. Причинами отсутствия этиологического диагноза пневмонии могут быть: - - отсутствие микробиологического исследования; - неправильно собранный материал для исследования; - предшествующее лечение антибиотиками (до забора материала на исследование); - отсутствие этиологически значимого возбудителя в момент исследования; - неопределенное клиническое значение выделенного возбудителя (носительство, контаминация бактериями ротоглотки, суперинфекция на фоне антибактериальной терапии); - наличие новых, еще не идентифицированных возбудителей; - использование неадекватного метода исследования. 4.4.2. Основные методы верификации возбудителей пневмонии: - микробиологическое исследование мокроты, бронхиального смыва, бронхоальвеолярного лаваша плеврального выпота, крови с количественной оценкой содержания микрофлоры; - иммунологические исследования: выявление бак-териальных агентов с помощью иммунных сывороток в реакции латекс-агглютинации, встречного иммуноэлектрофореза (зависит от чувствительности используемых иммунных сывороток); выявление специфических антител с помощью иммуноферментного анализа (наиболее чувствительный метод), реакции непрямой иммунофлюоресценции (наиболее эффективный метод), реакции непрямой гемагглютинации, связывания комплемента; иммунофлюоресцентный метод выявления вирусных компонентов. 4.4.3. Наряду с проведением микробиологического и других исследований или при отсутствии такой возможности необходима бактериоскопия мокроты, окрашенной по Граму (доступно любому медицинскому учреждению). Грамположительные микроорганизмы окрашиваются в сине-фиолетовые тона. Это исследование позволяет ориентировочно определить принадлежность возбудителя к грамположительным или грамотрицательным микроорганизмам, что в известной мере облегчает выбор антибиотика. Критерии адекватности препаратов (принадлежности к мокроте), окрашенных по Граму: - количество эпителиальных клеток (основной источник - ротоглотка) менее 10 на 100 просчитанных клеток; - преобладание нейтрофилов над эпителиальными клетками; количество нейтрофилов должно составлять 25/100 и выше; - преобладание микроорганизмов одного морфологического типа (80% всех микроорганизмов в нейтрофилах или вокруг них);
Внебольничная пневмония. Этиология. Диагностика. Диагностические критерии. Лечение. Показания к госпитализации. Профилактика.
Этиология и патогенез внебольничной пневмонии
Наиболее часто выявляемыми возбудителями внебольничной пневмонии являются: Streptococcus pneumoniae, Haemophilus influenzae, Chlamydia pneumoniae и Mycoplasma pneumoniae. Клинические проявления хламидийных и микоплазменных пневмоний не отличаются от таковых при пневмониях, вызываемых другими микроорганизмами.
Среди вирусов, в большинстве случаев приводящих к развитию пневмоний, выделяют: респираторно-синцитиальный, аденовирус, вирусы гриппа (у пожилых пациентов), парагриппа (у детей), метапневмовирусы.
Основные симптомы
Симптомами пневмонии являются: слабость (сопровождается потливостью), кашель, одышка, боль в грудной клетке. У старших детей и взрослых кашель продуктивный, у маленьких детей и пожилых пациентов - кашель сухой, непродуктивный. Одышка умеренная, развивается при физической нагрузке; редко в покое. Боль в грудной клетке связана с плевритом и возникает на стороне поражения. Пневмония может манифестировать с болей в животе, если очаг поражения локализован в нижней доле легкого.
Клинические проявления пневмонии зависят от возраста пациента: у маленьких детей первыми симптомами заболевания могут быть беспокойство и раздражительность, у пожилых людей может быть спутанность сознания и притупление болевой чувствительности.
Все ранние симптомы развивающейся пневмонии можно разделить на две группы:
1. общеинтоксикационные - повышение температуры тела, ознобы, головная боль, общая и мышечная слабость
2. бронхолегочные: боли в грудной клетке, кашель, одышка, отделение мокроты.
Основные клинические проявления пневмонии
Кашель - вначале бывает сухим, но, как правило, вскоре становится продуктивным, с выделением гнойной мокроты, иногда с примесью крови
Одышка - обычно при физической нагрузке, но при усилении дыхательной недостаточности частота дыхания может достигать 20-45/мин
Боль в груди - возникает при дыхании, на стороне поражения (плеврит). Боль может иррадиировать и при воспалении нижней доли легкого вызывать подозрение на гнойный процесс в брюшной полости.
Повышенная температура тела - температура быстро повышается до 39-40° C
Слабость - кроме слабости и общего недомогания пациента с пневмонией беспокоят и другие симптомы: тошнота, рвота, мышечные боли
Повышенное потоотделение по ночам.
Подозрение на пневмонию должно возникнуть, если у пациента имеется лихорадка, в сочетании с жалобами на кашель, одышку и/или боли в грудной клетке. В этом случае необходимо провести аускультацию и рентгенологическое исследование легких.
Цели диагностики
Подтвердить диагноз пневмонии.
Определить локализацию и распространенность процесса.
Определить показания к госпитализации (для внебольничной пневмонии).
Оценить степень тяжести и факторы риска развития осложнений для последующего определения схемы антибактериальной терапии.
Методы диагностики
Анамнез
Клинические симптомы пневмонии достаточно неспецифичны. Лихорадка, кашель, слабость наблюдаются при разных инфекциях органов дыхания. Появление на фоне этих симптомов одышки при физической нагрузке, а также болей в грудной клетке (характерных для плеврита) более типично для развития пневмонии. Возникновение одышки в покое свидетельствует о прогрессировании заболевания.
Развитие озноба может свидетельствовать о пневмококковой пневмонии. Острое начало болезни и быстрое ухудшение симптомов заболевания более характерны для бактериальной пневмонии.
При пневмонии, вызванной разными возбудителями, диагностическое значение имеет оценка мокроты. Так, при пневмококковой пневмонии мокрота - с примесью крови, или имеет "ржавый" оттенок. При пневмониях, вызванных Pseudomonas, гемофильной палочкой, мокрота приобретает зеленый цвет. У пациентов с инфекцией, причиной развития которой являются анаэробные микроорганизмы, мокрота имеет неприятный запах. В мокроте больных пневмонией, вызванной клебсиеллами, могут появляться сгустки крови.
Физикальное исследование
При физикальном обследовании больного пневмонией выявляют следующие признаки
При аускультации выслушивается локальное бронхиальное дыхание, звучные мелкопузырчатые хрипы или инспираторная крепитация. - нормальное дыхание, - крепитации, характерные для пневмонии.
Притупление перкуторного звука над пораженным участком легкого.
Усиление бронхофонии и голосового дрожания.
Физикальные симптомы могут отсутствовать примерно у 20% больных.
Рентгенологическое исследование
Рентгенография органов грудной клетки, выполненная в двух проекциях, является основным методом диагностики пневмонии.
Оценивают следующие критерии, свидетельствующие о характере заболевания
Наличие очаговых и инфильтративных теней.
Локализация и распространенность инифльтрации.
Наличие или отсутствие полости деструкции.
Наличие или отсутствие плеврального выпота.
Изменение легочного рисунка.
Крупозная
левосторонняя нижнедолевая
пневмония.
Стадия
опеченения. Интенсивное затемнение,
соответствующее пораженной доле. Границы
затемнения четко выражены, что
соответствует междолевой плевре.
Междолевая плевра уплотнена (плеврит).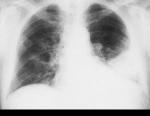
Интерстициальная
пневмония.
Усиление
и деформация легочного рисунка по
ячеистому типу. Усиление легочного
рисунка ограничено (что типично для
интерстициальной пневмонии) средними
и нижними отделами. Поражение двустороннее,
но картина асимметричная (что также
типично для интерстициальной пневмонии).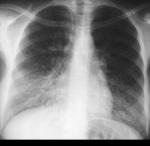
Анализ крови
Лейкоцитоз > 10-12х10 9 /л указывает на высокую вероятность бактериальной инфекции, а лейкопения < 3х10 9 /л или лейкоцитоз > 25х10 9 /л являются неблагоприятным прогностическим признаками пневмонии. Лейкопения < 5х10 9 /л - симптом возможного сепсиса. У пожилых пациентов лейкоцитоза может и не быть, однако это обстоятельство не снижает вероятность наличия пневмонии у таких больных.
Биохимический
анализ крови показан у больных с тяжелым
течением.![]()
Микроскопическое исследование мокроты
Микроскопическое исследование мокроты с окраской по Грамму может служить ориентиром в определении возбудителя и выборе антибактериальных препаратов. Диагностическая ценность результатов исследований мокроты может быть оценена как высокая при выделении потенциального возбудителя в концентрации более 105 КОЕ/мл.
Посев венозной крови
Посев венозной крови выполняется при тяжелой пневмонии до начала антибактериальной терапии двукратно (кровь берется из разных вен с интервалом в 10 мин. и более). Положительные результаты исследования получают редко, даже при пневмококковой пневмонии.
Фибробронхоскопия
Фибробронхоскопия применяется с целью получения материала для микробиологического исследования у пациентов с тяжелыми нарушениями иммунитета и при проведении дифференциальной диагностики.
План диагностики при пневмонии
При всех вариантах пневмонии обязательным является проведение общеклинического обследования (анамнез и физикальные данные), рентгенологического исследования, клинического анализа крови.
При тяжелой пневмонии дополнительно проводят посев венозной крови, микробиологическое исследование мокроты. При неэффективности проводимой терапии, для уточнения этиологии заболевания, проводят фибробронхоскопию с целью получения материала для микробиологического исследования.
У пациентов с нарушениями иммунитета дополнительно выполняют: посев венозной крови, микробиологическое исследование мокроты, фиброброхоскопию. Во время бронхоскопии получают образец легочной ткани как для гистологического исследования, так и для посева. Биопсия под прямым визуальным контролем дает возможность получать материал для исследования непосредственно из пораженных участков и обеспечивает самые точные диагностические результаты. В частности, откашливаемая мокрота не подходит для выявления анаэробов, поэтому материал для микробиологического исследования получают путем транстрахеальной аспирации или биопсии.
Диагноз внебольничной пневмонии устанавливается на основании сочетания изменений на рентгенограмме (долевая или очаговая инфильтрация) с двумя из следующих признаков
Остролихорадочное начало заболевания (температура выше 38° С).
Кашель с мокротой.
Одышка (чатота дыхания более 20/мин)
Аускультативные признаки пневмонии (влажные мелкопузырчатые хрипы и/или крепитация) .
Лейкоцитоз более 10*10 9 /л и/или палочкоядерный сдвиг более 10%
Лейкопения менее 4*10 9 /л
Цели лечения
1. подавление возбудителя инфекции
2. купирование симптомов заболевания
3. разрешение инфильтративных изменений в легких
4. устранение и профилактика осложнений.
Задачи лечения
проведение антимикробной терапии (центральная задача лечения).
проведение дезинтоксикационная терапии
улучшение дренажной функции бронхов
лечение осложнений.
Лечение пневмонии предпочтительно проводить в стационаре, но при внебольничной пневмонии легкого течения терапия может проводиться в домашних условиях.
Показания для обязательной госпитализации при внебольничной пневмонии
Госпитализация необходима при невозможности обеспечить в домашних условиях надлежащий уход и лечение. Показаниями к госпитализации служат следующие критерии тяжести состояния.
Физикальные данные
частота дыхания более 30/мин
диастолическое АД менее 60 мм рт.ст.
систолическое АД менее 90 мм рт.ст.
ЧСС более 125 /мин
температура тела ниже 35,5° С или более 40° С
нарушения сознания.
Лабораторные показатели
лейкоциты периферической крови < 4х10 9 /л или > 25х10 9 /л
гематокрит < 30% или гемоглобин < 90 г/л
SaO 2 < 92% (по данным пульсоксиметрии), PaO 2 <60 мм рт.ст. и/или PaCO 2 <50 мм рт.ст. (при дыхании комнатным воздухом)
креатинин сыворотки крови > 176,7 мкмоль/л или мочевина крови > 7,0 ммоль/л.
Данные рентгенографии органов грудной клетки
инфильтрация, локализующаяся более чем в одной доле
наличие полости (полостей) распада
массивный плевральный выпот
быстрое прогрессирование очагово-инфильтративных изменений в легких (увеличение размеров инфильтрации > 50% в течение ближайших 2 суток внелегочные очаги инфекции (менингит, септический артрит).
Лечение также предпочтительно проводить в стационарных условиях при следующих ситуациях:
если возраст пациента более 60 лет
при наличии сопутствующих заболеваний
при неэффективности начальной антибактериальной терапии
При тяжелом течении пневмонии, которое может привести летальному исходу, больного следует госпитализировать в отделение реанимации или интенсивной терапии.
Показания для госпитализации в отделение интенсивной терапии
частота дыхания более 30/мин.
тяжелая дыхательная недостаточность и признаки утомления дыхательной мускулатуры
систолическое АД < 90 мм рт.ст.
двусторонняя или многодолевая пневмония
быстрое прогрессирование очагово-инфильтративных изменений в легких
септический шок
необходимость введения вазопрессорных для поддержания артериального давления препаратов более 4 часов
острая почечная недостаточность.
Методы лечения пневмонии
Антибактериальная терапия
Антибактериальная терапия является основным методом лечения. Антибиотики назначают до получения результатов бактериологического исследования.
При внебольничной пневмонии для эмпирической терапии назначают антибиотики с бактерицидным действием и антипневмококковой активностью. О других возбудителях следует подумать при госпитальной пневмонии, а также, если имеются клинические симптомы атипичной пневмонии, или в анамнезе заболевания есть указания на эпидемиологические предпосылки. Парентерально антибактериальные препараты вводят больным с тяжелым течением заболевания, или при наличии факторов риска, способных ухудшить течение пневмонии (сахарный диабет, сердечная или почечная недостаточность, хронические легочные заболевания, пожилой возраст, алкоголизм, курение). Цефалоспорины как препараты первой линии при обычной пневмонии не показаны, так как спектр их действия очень широк, и они могут вызвать серьезные изменения нормальной микрофлоры организма. Большинство хинолонов не назначаются при внебольничных пневмониях, так как они недостаточно эффективны в отношении пневмококков.
Дезинтоксикационная терапия
Внутривенно, капельно вводят солевые растворы (например, изотонический раствор натрия хлорида до 1-2 л за сутки), 5% раствор глюкозы - 400-800 мл в сутки, поливинилпирролидон 400 мл в сутки, альбумин 100-200 мл в сутки.
Улучшение дренажной функции бронхов
Нарушение дренажной функции бронхов у больных пневмониями связаны не только с естественным дренированием очага воспаления и поступлением в бронхи вязкого альвеолярного экссудата, но и частым вовлечением самих бронхов в воспалительный процесс. Этот механизм приобретает особое значение у пациентов с бронхопневмониями различного генеза, а также у больных с сопутствующими хроническими заболеваниями бронхов (хроническим обструктивным бронхитом, бронхиальной астмой, бронхоэктазами, муковисцидозом).
Немедикаментозные методы улучшения дренажной функции легких
Обильное теплое питье способствует уменьшению вязкости и лучшему отхождению мокроты. Кроме того обильное питье обладает умеренным дезитоксикационным эффектом. Рекомендуется выпивать не менее 1,5-2 литров теплой жидкости в день.
Массаж грудной клетки также улучшает дренажную функцию бронхов и способствует удалению мокроты. При выполнении массажа необходимо делать паузы, давая возможность пациенту откашляться.
Дыхательная гимнастика является эффективным средством нормализации дренажной функции бронхов. Глубокие дыхательные движения и дыхание через сопротивление улучшают вентиляцию легких (профилактика застоя и слипания мелких бронхов). Вместе с тем, усилия пациента при выполнении дыхательной гимнастики не должны быть чрезмерными, чтобы не спровоцировать развитие спонтанного пневмоторакса.
Отхаркивающая терапия
Муколитики и мукорегуляторные препараты назначают для улучшения реологических свойств мокроты, облегчающих ее выделение. В настоящее время наиболее эффективными муколитиками являются:ацетилцистеин , месна , бромгексин и амброксол .
План ведения пациента с пневмонией
Длительность лечения обычно составляет 7-10 дней.
При пневмонии микоплазменной или хламидийной этиологии - 14 дней.
При стафилококковой пневмонии, а также пневмонии, вызванной грамотрицательными энтеробактериями, продолжительность терапии должна составлять от 14 до 21 дня.
Критерии достаточности антибактериальной терапии
Температура меньше 37,5° C.
Отсутствие интоксикации.
Отсутствие одышки (частота дыханий менее 20/мин).
Нормализация уровня С - реактивного белка.
Количество лейкоцитов в крови меньше 10 х 10 9 /л, нейтрофилов меньше 80%, юных форм меньше 6%.
Улучшение рентгенологической картины (контрольное рентгенологическое исследование проводят через 2 - 3 недели от начала заболевания).
В большинстве случаев при успешном лечении улучшение самочувствия пациента наступает через 4-5 дней после начала антибиотикотерапии. Сохранение отдельных клинических и/или рентгенологических признаков заболевания не является показанием к продолжению лечения антибиотиками более установленных (в зависимости от клинической ситуации) сроков. Как правило, дальнейшая нормализация рентгенологической картины происходит самостоятельно. Однако, если, несмотря на клиническое улучшение, на рентгенограмме в течение 4 недель сохраняются очагово-инфильтративные изменения, необходимо провести обследование для уточнения причины медленного регресса симптомов.
Симптоматическая терапия
При вязкой, трудно отходящей мокроте применяют отхаркивающие препараты.
При высокой температуре и выраженной интоксикации проводят жаропонижающую ( метамизол натрия ,парацетамол и дезинтоксикационную терапию (внутривенно, капельно вводят солевые растворы: изотонический раствор натрия хлорида до 1-2 л за сутки), 5% раствор глюкозы - 400-800 мл в сутки, поливинилпирролидон 400 мл в сутки, альбумин 100-200 мл в сутки).
При развитии бронхоспастического синдрома применяют бронхолитические препараты.
Мероприятия в случае отсутствия ответа на терапию в течение 2-3 дней
При нетяжелом течении внебольничной пневмонии неизвестной этиологии проводят замену антибиотика на препарат другой группы или более широкого спектра действия.
При ухудшающемся состоянии показана госпитализация, при которой необходимо уточнить этиологию (фибробронхоскопия в сочетании с бронхоальвеолярным лаважем позволяет в 90% случаев определить возбудителя) и исключить осложнения (плевральный выпот, эмпиему, абсцесс легкого). В дальнейшем проводится лечение с учетом выявленной микрофлоры.
У пациентов с неосложненными бактериальными пневмониями прогноз благоприятный. Прогноз ухудшается у больных пожилого возраста, при наличии у пациента сопутствующей патологии, симптомов дыхательной недостаточности; при нейтропении и сепсисе; при заболевании, вызванном клебсиеллами, легионеллами, резистентными штаммами пневмококков.
Смертность пациентов с диссеминированным гистоплазмозом, не получавших терапию, составляет 80%; на фоне лечения этот показатель снижается до 25%. При кокцидиоидомикозе смертность среди ВИЧ-инфицированных больных составляет 70%. Пневмонии, вызванные Aspergillus или Mucor, приводят к летальному исходу в 50-85% случаев среди пациентов, перенесших трансплантацию органов и тканей.
С целью профилактики применяют пневмококковую и гриппозную вакцины.
Пневмококковую вакцину рекомендуют вводить в следующих ситуациях
Лицам в возрасте старше 65 лет.
Лицам в возрасте до 65 лет с сопутствующими заболеваниями (хронические заболевания сердечно-сосудистой системы, хронические легочные заболевания, сахарный диабет, алкоголизм, хронические заболевания печени).
Лицам в возрасте до 65 лет после удаления селезенки.
Лицам в возрасте старше 2 лет с иммунодефицитными состояниями.
Гриппозную вакцину рекомендуют вводить лицам из группы риска.
Кроме того, рекомендуется
Ношение маски как защитного средства при контакте больными инфекционными заболеваниями дыхательных путей.
В качестве профилактики внутрибольничной пневмонии у больных, находящихся на ИВЛ, - проводить аспирацию секрета из подсвязочного пространства гортани.
Больным, находящимся на постельном режиме, - соблюдать полусидячее положение для снижения риска аспирации.
Патогенетические аспекты лечения пневмонии в зависимости от возбудителя и степени тяжести заболевания. Критерии эффективности терапии. Показания к госпитализации больных с пневмонией. Критерии и сроки временной нетрудоспособности. Диспансерное наблюдение больных перенесших пневмонию. Профилактика.

Микробиология внебольничной пневмонии Микробиологическая идентификация возбудителя возможна лишь в 40–60% случаев всех пневмоний. Streptococcus pneumoniae является ведущей причиной внебольничных пневмоний как среди больных с легкой, так и тяжелой пневмонией (около 20%). Среди больных пневмонией с бактериемией, на долю S. pneumoniae приходится до двух третей всех причин заболевания. Второе место по значению среди причин внебольничных пневмоний занимают «атипичные» микроорганизмы – Mycoplasma pneumoniae и Chlamydophila pneumoniae (до 10–20%), распространенность данных возбудителей зависит от сезона, возраста больных, географического региона. Staphylococcus aureus, Legionella pneumophila и грамотрицательные бактерии (Klebsiella pneumoniae, Pseudomonas aeuruginosa и др) играют более скромную роль в генезе внебольничных пневмоний, однако их роль возрастает по мере нарастания тяжести заболевания. Инфекции Legionella spp. встречаются, в основном, в регионах с теплым климатом (страны Средиземноморья), и довольно редко – в странах Северной Европы. Роль анаэробных микроорганизмов в генезе внебольничных пневмоний небольшая, но значительно возрастает при аспирационных пневмониях – до 50% всех причин. Вирусные инфекции являются причиной 5–15% всех внебольничных пневмоний, при этом основное значение имеет вирус гриппа, меньшее – вирусы парагриппа, аденовирусы, респираторно–синтициальный вирус. Вирусные пневмонии имеют сезонное преобладание, преимущественно в осенне–зимнее время. На протяжении последних лет во всем мире наблюдается стремительный рост резистентности возбудителей пневмоний к антибактериальным препаратам. Для некоторых патогенов ситуация резистентности к антимикробным препаратам является сходной во всем мире. Так, например, практически все штаммы Moraxella catarrhalis являются продуцентами b-лактамаз, а атипичные микроорганизмы (микоплазма, хламидия, легионелла) практически не имеют проблем с развитием приобретенной устойчивости к антибиотикам. Однако для S. pneumoniae и H. influenzae пропорция резистентных штаммов значительно варьирует как между странами, так и между регионами одной страны. Значительно увеличилась доля пневмоний, вызываемых штаммами S. pneumoniae, устойчивыми к пенициллину, и к другим антибиотикам (полирезистентные штаммы). Доля штаммов S. pneumoniae, резистентных к пенициллину, в мире варьирует от < 5% до > 50%, что зависит от географического региона, популяции (чаще у детей), локализации инфекции (чаще в назофарингеальной зоне) и клинического окружения (чаще в стационаре) [18]. По данным Российского многоцентрового исследования ПеГАС–1, на долю штаммов S. pneumoniae, устойчивых к пенициллину, приходится 9% (умеренно резистентные – 7%, высоко резистентные – 2%) [2], однако следует учесть, что резистентность штаммов значительно варьирует в каждом регионе. Устойчивость пневмококка к макролидам в России также невелика, в тоже время очень высока резистентность к тетрациклинам (27%) и ко–тримоксазолу (33%). Факторами риска для развития устойчивости пневмококков к антибиотикам являются: возраст больных более 60 лет и менее 7 лет, наличие сопутствующих заболеваний, предшествующая антибиотикотерапия, пребывание в домах ухода. Оценка тяжести и риска летального исхода при внебольничной пневмонии Объективная оценка тяжести состояния больного является необходимым инструментом для принятия решения о тактике ведения больного, решения вопросов о его транспортировке, об оптимальном месте терапии больного (специализированное отделение, отделение интенсивной терапии и др.), для сравнения исходов больных в зависимости от методов терапии, качества оказания помощи. Наиболее актуальной проблемой при первичной оценке больного с пневмонией является вопрос о том, где больной должен получать терапию: в домашних условиях (т.е. госпитализация не требуется), в условиях отделения стационара или в условиях реанимационного отделения. Более простые алгоритмы также позволяют оценить риска летального исхода при тяжелой внебольничной пневмонии, например, при наличии двух из трех признаков: мочевина крови > 20 мг/дл, частота дыхания і 30 мин-1 и диастолическое артериальное давление Ј 60 мм рт.ст. (правило Британского торакального общества), риск развития смертельного исхода повышается в 21 раз по сравнению с больными, у которых отсутствуют данные показатели. Причинный фактор также оказывает влияние на прогноз заболевания: летальность больных значительно повышена при обнаружении таких микроорганизмов как: S. pneumoniae, Legionella spp., P. aeruginosa. Антибактериальная терапия при внебольничной пневмонии Начальный выбор антимикробного препарата производится эмпирически (т.е. до получения результатов микробиологического исследования), так как: – как минимум, в половине случаев ответственный микроорганизм не удается выявить даже при помощи современных новейших методов исследования, а существующие микробиологические методы довольно неспецифичны и малочувствительны; – любая задержка этиотропной терапии пневмоний сопровождается повышенным риском развития осложнений и летальности пневмонии, тогда как своевременная правильно выбранная эмпирическая терапия позволяет улучшить исход заболевания; – оценка клинической картины, рентгенологических изменений, сопутствующих заболеваний, факторов риска и тяжести пневмонии в большинстве случаев позволяет принять правильное решение о выборе адекватной терапии. В то же время необходимо стремиться к уточнению этиологического диагноза, особенно у больных с тяжелой пневмонией, так как такой подход может оказать влияние на исход заболевания. Кроме того, преимуществами «направленной» терапии являются уменьшение количества назначаемых препаратов, снижение стоимости лечения, снижение числа побочных эффектов терапии и уменьшение потенциала селекции резистентных штаммов микроорганизмов. Выбор стартовой терапии зависит от тяжести заболевания, места терапии, клинических и эпидемиологических факторов. Основой терапии легкой пневмонии в амбулаторных условиях являются пероральный амоксициллин 1,0 г каждые 8 часов , и амоксициллина/клавуланат 1,0 г каждые 12 часов. Амоксициллина клавуланат (Амоксиклав) не только оказывает прямое бактерицидное действие на широкий спектр грамположительных, грамотрицательных, аэробных и анаэробных микроорганизмов, включая устойчивые штаммы. В последнее время получены данные о постантибиотическом эффекте и эффекте потенцирования активности полиморфноядерных лейкоцитов и фагоцитоза, выраженных у Амоксиклава достоверно сильнее, чем у амоксициллина. Причем на его примере был впервые описан эффект: клавулановая кислота существенно продлевает постантибиотическое действие амоксициллина. Амоксиклав хорошо проникает в различные ткани и жидкости организма, достигая в большинстве случаев адекватных антибактериальных концентраций. Период полувыведения для обоих компонентов составляет в среднем около 1 ч. Основная доля препарата выводится через почки. По сравнению с другими пенициллиновыми антибиотиками Амоксиклав обладает лучшими фармакокинетическими свойствами, в частности, большей биодоступностью при приеме внутрь, возможностью одновременного приема с пищей, молоком, меньшей степенью связывания белками плазмы и др. Эффективность монотерапии (один антибиотик, один курс) в группе Амоксиклава достоверно выше. Необходимо отметить также более низкую антибактериальную нагрузку в группе Амоксиклава, где курс лечения в среднем требует меньших доз. Также применение орального антибиотика Амоксиклав позволяет получить существенный экономический эффект. Анализ показал, что основное влияние на стоимость лечения оказывают стоимость лечебно–диагностических процедур, инъекций и общая длительность госпитализации больного. Стоимость антибактериальных препаратов играет далеко не ведущую роль. В то же время использование эффективных антибиотиков, наиболее показанных при данной патологии, способствует более быстрой положительной динамике, сокращает длительность антибиотикотерапии и общую продолжительность лечения, что в конечном итоге дает значительный экономический эффект. Относительно более дорогостоящий антибиотик Амоксиклав по сравнению с традиционными препаратами (пенициллин, линкомицин, ампициллин и др.) в итоге оказался более экономичным. При подозрении на пневмонию, вызванную атипичными возбудителями, назначаются пероральные макролиды. Альтернативой макролидам могут быть респираторные фторхинолоны (лефофлоксацин, моксифлоксацин). У госпитализированных больных с нетяжелой пневмонией возможно назначение как парентеральных, так и пероральных препаратов. Показаниями к парентеральной терапии являются: тяжелая пневмония, нарушение сознания, нарушение глотательного рефлекса, функциональные или анатомические причины нарушенного всасывания [9]. При нетяжелой пневмонии возможно использование амоксициллина/клавуланата, ампициллина, парентеральных цефалоспоринов II и III поколений (цефтриаксон, цефуроксим аксетил, цефатаксим), альтернативными препаратами являются внутривенные макролиды (кларитромицин, спирамицин) или респираторные фторхинолоны. При подозрении на аспирационный генез пневмонии назначают амоксициллина/клавуланат или комбинацию b-лактамов с метронидазолом или клиндамицином. При тяжелой пневмонии в качестве стартовой терапии назначают комбинацию цефалоспоринов III поколения (или амоксициллина/клавуланата) и макролидов. По данным нескольких ретроспективных исследований, такой режим терапии может сопровождаться снижением летальности, что объясняется не только активностью комбинации препаратов к типичным и атипичным микроорганизмам, но и способностью макролидов уменьшать противовоспалительный эффект бактериальных продуктов [19]. Альтернативным режимом является комбинация цефалоспоринов III поколения и фторхинолонов (офлоксацин, ципрофлоксацин). При подозрении на инфекцию Legionella spp. к указанным препаратам добавляют парентеральный рифампицин. При высоком риске инфекции P. aeuruginosa (муковисцидоз, бронхоэктазы), эмпирическая антимикробная терапия должна включать цефалоспорины III поколения с антисинегнойной активностью (цефтазидим, цефипим) или карбапенемы (имипенем, меропенем) в комбинации с ципрофлоксацином или аминогликозидами. Ответ на антимикробную терапию зависит от иммунной реактивности организма, тяжести заболевания, причинного патогена, протяженности пневмонии по данным рентгенографической картины. Субъективный ответ на антибиотики обычно наблюдают в течение 1–3 суток от начала терапии. Объективный ответ включает оценку лихорадки, других симптомов, лабораторных показателей и рентгенографических изменений.
Лечение пневмонии легкой и средней степени тяжести лекарственные средства выбора:
Амоксициллин/клавуланат в/в по 1,2 г 3 р/сут 3—4 сут или
Ампициллин в/в или в/м по 1—2 г 4 р/сут 3—4 сут или
Бензилпенициллин в/в по 2 000 ЕД 4—6 р/сут 3—4 сут или
Цефотаксим в/в или в/м по 1-2г. 2-3 р/сут 3—4 сут или
Цефтриаксон в/в или в/м 1—2 г 1 р/сут 3—4 сут или
Цефуроксим в/в или в/м по 0,75 г 3 р/сут 3—4 сут
Альтернативные лекарственные средства:
Левофлоксацин в/в 0,5 г 1 р/сут 3—4 сут или
Моксифлоксацин в/в 0,4 г 1 р/ 3—4 сут
Через 3—4 дня лечения при достижении клинического эффекта (нормализация температуры тела, уменьшение выраженности интоксикации и других симптомов заболевания), возможен переход с парентерального на пероральный способ применения антибиотика. Общая длительность лечения составляет 7-10 сут. Допускается изначальное приме пероральных противомикробных лекарственных средств
Лечение тяжелой внебольничной пневмонии, лекарственные средства выбора:
Кларитромицин в/в по 0,5 г 2 р/сут в течение 10 сут или
Спирамицин по 1 500 000 ME 3 р/сут или
Эритромицин по 0,5—1 г 4 р/сут
+
Амоксициллин/клавуланат в/в 1,2 г 3 р/сут 10 сут или
Цефепим в/в 1—2 г 2 р/сут 10 сут или
Цефотаксим в/в по 1-2 г 2-3 р/сут 10 сут или
Цефтриаксон в/в 1—2 г 1 р/сут 10 сут
Альтернативные антибактериальные средства при лечении тяжелой внебольничной пневмонии:
Левофлоксацин в/в 0,5 г 1—2 р/сут 10 сут или
Моксифлоксацин в/в 0,4 г 1 р/сут
ИЛИ
Офлоксацин в/в по 0,4 г 2 р/сут 10 сут или
Ципрофлоксацин по 0,2—0,4 г 2 р/сут
+
Цефотаксим в/в по 1-2 г 2-3 р/сут 10 сут или
Цефтриаксон в/в 1—2 г 1 р/сут 10 сут
Лечение пневмонии, предположительно вызванной P. auroginosa
Имипенем в/в по 0,5г 3-4 р/сут. или
Меропенем в/в по 0,5г 3-4 р/сут или
Пиперациллин/тазобактам в/в по 4,5 г 3 р/сут или
Тикарциллин/клавуланат в/в по 3,2 г 3р/сут. или
Цефипим в/в или в/м 1-2г 2г/сут или
Цефоперазон/сульбактам в/в по 2-4г 2 р/сут. или
Цефтазидим в/в или в/м по 1-2 г 2-3 р/сут.
Ципрофлоксацин в/в по 0,2-0,4г 2р/сут
+/-
Амикацин в/м или в/в 15-20 мг/кг 1 р/сут 10 сут или
Гентамицин в/м или в/в 3-5мг/кг 1р/сут 10 сут.
Лечение предполагаемой аспирационной пневмонии
Амоксициллин/клавуланат в/в по 1,2 г 3 р/сут 10 сут или
Имипенем в/в по 0,5 г 3—4 р/сут 10 сут или
Меропенем в/в по 0,5 г 3—4 р/сут 10 сут или
Пиперациллин/тазобактам в/в по 4,5 г 3 р/сут 10 сут или
Тикарциллин/клаву ланат в/в по 3,2 г 3 р/сут 10 сут или
Цефоперазон/сулъбактам в/в по 2— 4г2 р/сут 10 сут
ИЛИ
Цефепим в/в 1—2 г 2 р/сут
+
Метронидазол в/в 500 мг 3р/сут в течение 10 сут.
При наличии клинических и/или эпидемиологических данных о микоплазменной или хламидийной этиологии пневмонии, продолжительность лечения увеличивается до 14 сут.
При внебольничной пневмонии, вызванной S.aureus или Enterobacteriaceae, длительность антибактериальной терапии составляет 14-21 сут. При легионеллезной пневмонии длительность лечения составляет 21 сут.
После получения адекватного ответа на парентеральное введение антимикробных препаратов возможен переход на пероральные препараты. Такой подход определяют как «ступенчатая» терапия, если используется один и тот же антибиотик, или как «последовательная» терапия, если производится замена одного парентерального антибиотика на другой пероральный препарат. Использование ступенчатой или последовательной терапии позволяет значительно уменьшить расходы на лечение и сократить длительность пребывания больных в стационаре. Пероральный антибиотик при последовательной терапии должен обладать высокой биодоступностью. Для ступенчатой терапии чаще используют макролиды, фторхинолоны, амоксициллин/клавуланат, цефуроксим. При последовательной терапии возможен переход от в/в ампициллина на амоксициллин, от в/в цефалоспоринов на амоксициллин/клавуланат или другие пероральные цефалоспорины (цефподоксим, цефиксим). Критериями перехода от в/в к пероральной терапии являются: · Разрешение лихорадки > 24 часов · Пульс < 100 мин-1 · Разрешение тахипное (ЧД < 20 мин-1) · Хорошая гидратация, способность к приему жидкости per os · Отсутствие гипотензии · Отсутствие гипоксемии · Снижение лейкоцитоза периферической крови · Отсутствие бактериемии · Отсутствие микробиологических данных за инфекции Legionella spp., Staphylococcus aureus и грамотрицательные бактерии · Адекватная абсорбция из желудочно–кишечного тракта Длительность антимикробной терапии зависит от тяжести заболевания, этиологического фактора, наличия или отсутствия осложнений.
Критерии эффективности антибактериальной терапии внебольничной пневмонии (в амбулаторных условиях):
• температура <37,5°С;
• отсутствие интоксикации;
• отсутствие дыхательной недостаточности (частота дыхания <20/мин);
• отсутствие гнойной мокроты;
• количество лейкоцитов в крови <10 х 109/л, нейтрофилов <80%, юных форм <6%;
• отсутствие отрицательной динамики на рентгенограмме.
Сохранение отдельных клинических, лабораторных или рентгенологических признаков внебольничной пневмонии не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации. Рентгенологическая динамика отмечается медленнее по сравнению с клинической картиной, поэтому контрольная рентгенография грудной клетки не может служить критерием для определения длительности антибактериальной терапии. При длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматике пневмонии необходимо провести дифференциальную диагностику с такими заболеваниями, как рак легкого, туберкулез, застойная сердечная недостаточность и др. Так, сохранение кашля в течение 2 нед требует исключения туберкулеза. Терапия осложнений внебольничной пневмонии Антибактериальные препараты являются основой терапии больных с пневмонией, однако в ситуации ведения больных с тяжелой пневмонией, важнейшее значение играет терапия, направленная на терапию осложнений пневмонии (острая дыхательная недостаточность, септический шок, абсцесс и др.). При умеренной гипоксемии (SpO2 85–90%), при условии достаточного респираторного усилия больного, сохраненного сознании и быстрой обратной динамики инфекционного процесса, возможна коррекция гипоксемии при помощи простой носовой маски (FiO2 до 45–50%) или маски с расходным мешком (FiO2 до 90%). Показания в респираторной поддержке рассматриваются на основании клинической картины с учетом газометрических показателей: · нарушение сознания (сопор, кома); · нестабильная гемодинамика; · признаки дисфункции дыхательной мускулатуры; · частота дыхания > 35 мин-1; · рН артериальной крови < 7,3; · РаО2/FiO2< 250 мм рт.ст. Альтернативой традиционной респираторной поддержке является неинвазивная вентиляция легких (НВЛ) с помощью лицевых масок, НВЛ позволяет улучшить газообмен у 75% больных и избежать интубации трахеи у 60% больных с тяжелой пневмонией. Применение НВЛ при тяжелой пневмонии обосновано у больных с фоновым заболеванием ХОБЛ, при условии хорошего дренирования дыхательных путей и на ранних этапах развития ОДН. Особую сложность представляет проблема проведения вентиляционного пособия больным с ОДН на фоне унилатерального (несимметричного) поражения легких. Предложено несколько подходов для улучшения оксигенации у больного с односторонней пневмонией: использование фармакологических препаратов (альмитрин, ингаляционный оксид азота NO); периодическое придание больному положения на здоровом боку (decubitus lateralis); раздельная вентиляция легких с учетом разного комплаенса и различной потребности РЕЕР в здоровом и «больном» легком. У больных с тяжелым сепсисом и септическим шоком на первом этапе терапии назначают растворы для восполнения объема циркулирующей жидкости (чаще коллоиды). В ряде случаев введения растворов может быть достаточно для коррекции циркуляторных нарушений, в случае их неэффективности назначают допамин, а затем при неэффективности – вазоконстрикторы (норадреналин, адреналин) и инотропные препараты (добутамин). При «рефрактерном» септическом шоке, при подозрении на недостаточность надпочечников (больные с предшествующим приемом стероидов) возможно использование низких доз глюкокортикостероидов (гидрокортизон 100 мг 3 раза в сутки в течение 5–10 дней). Поддерживающая терапия при внебольничной пневмонии Больные с пневмонией, госпитализированные в стационар, особенно, в отделения интенсивной терапии, как правило, нуждаются в проведении поддерживающей терапии, которая включает растворы, электролиты, питание, бронхолитики, отхаркивающие препараты. Тяжелым больным, особенно с ОДН, дегидратацией, наличием в анамнезе тромбоэмболий и не имеющим противопоказаний к терапии прямыми антикоагулянтами, для профилактики венозных тромбозов назначают низкие дозы нефракционированного гепарина (п/к 5.000 ед 2–3 р/сут) или, предпочтительнее, низкомолекулярные гепарины (эноксапарин п/к 40 мг/сут) [20]. Критериями выздоровления от пневмонии являются полное исчезновение физикальных и рентгенологических симптомов, нормализация температуры тела и общего состояния, исчезновение нарушений вентиляции. Больные, перенесшие обычную пневмонию, находятся под диспансерным наблюдением в течение 6 месяцев: первое обследование проводится через 1 месяц, второе - через 3, а третье - через 6 месяцев. Обследование включает клинический осмотр, общий анализ крови и мочи, биохимический анализ крови (С-реактивный белок, фибриноген, сиаловые кислоты). В случае необходимости при третьем посещении делается рентгенологическое обследование грудной клетки. При отсутствии патологии переболевший пневмонией снимается с учета и считается практически здоровым. Лица, перенесшие затяжную пневмонию, наблюдаются в течение 1 года: через 1, 3, 6 и 12 месяцев с полным клинико-лабораторным и рентгенологическим обследованием. По показаниям проводится консультация онколога и фтизиатра.
Ориентировочные сроки временной нетрудоспособности при легкой, среднетяжелой и тяжелой пневмонии следующие: 17-20 дней, 20-23 и 40—48 дней (из них стационарное лечение 30-35 дней) соответственно. При развитии осложнений пневмонии (абсцесс легких, стафилококковая деструкция) эти сроки удлиняются. В целом временная нетрудоспособность при пневмонии зависит от сроков обращаемости, своевременности диагностики и госпитализации, возраста больного, тяжести пневмонии, наличия фоновых заболеваний.
Исходы пневмонии следующие:
выздоровление,
затяжное течение,
ограниченный пневмосклероз,
постпневмонический хронический бронхит,
легочное нагноение (абсцесс),
постинфекционный синдром (выраженная слабость, субфебрилитет и др.).
Прогноз зависит от патогенеза пневмонии, типа возбудителя (например, смертность выше при клебсиелльной пневмонии, стафилококковой после гриппа и ниже - при атипичной пневмонии), наличия положительной культуры крови (это плохой прогностический признак, увеличивающий летальность в 3 раза), возраста больного (у пожилых смертность также выше), тяжести сопутствующих заболеваний, иммунной реактивности, имеющихся осложнений (абсцесс легких, эмпиема плевры). Врачу важно сразу выявить больных с тяжелым течением пневмонии, наличием ряда плохих прогностических признаков и тех, кто требует интенсивного лечения и наблюдения. Прогноз при пневмонии определяетсявзаимодействием всех этих факторов.
Дифференциальная диагностика внебольничных и госпитальных пневмоний. Клинические особенности. Фармакотерапия с позиций доказательной медицины. Критерии эффективности терапии. Осложнения пневмонии, классификация. Терапия осложнений.
Этиология и патогенез внебольничной пневмонии
Наиболее часто выявляемыми возбудителями внебольничной пневмонии являются: Streptococcus pneumoniae, Haemophilus influenzae, Chlamydia pneumoniae и Mycoplasma pneumoniae. Клинические проявления хламидийных и микоплазменных пневмоний не отличаются от таковых при пневмониях, вызываемых другими микроорганизмами.
Среди вирусов, в большинстве случаев приводящих к развитию пневмоний, выделяют: респираторно-синцитиальный, аденовирус, вирусы гриппа (у пожилых пациентов), парагриппа (у детей), метапневмовирусы.
Этиология и патогенез госпитальной пневмонии
Госпитальная пневмония развивается в течение, как минимум, 48 часов после госпитализации в стационар по поводу другого заболевания. Наиболее часто она вызывается грамотрицательными микроорганизмами и Staphylococcus aureus, что определяет выбор антибиотиков, особенно при наличии резистентных штаммов возбудителей. Термин госпитальная пневмония включает в себя: пневмонию после ИВЛ, послеоперационную пневмонию, пневмонию, развивающуюся у пациентов с тяжелыми заболеваниями.
Наиболее частой причиной госпитальной пневмонии является микроаспирация микроорганизмов, колонизирующих ротоглотку и верхние дыхательные пути тяжелобольных пациентов.
Факторы риска развития госпитальной пневмонии
Эндотрахеальная интубация и механическая вентиляция легких являются факторами риска развития пневмонии после ИВЛ, частота возникновения которой составляет 85% от всех госпитальных пневмоний. У 17-23% пациентов, перенесших ИВЛ, развивается пневмония. Эндотрахеальная интубация отрицательно влияет на местные факторы защиты дыхательных путей, нарушает кашлевой рефлекс, повреждает мукоцилиарный транспорт и способствует микроаспирации инфицированного секрета ротоглотки, который накапливается выше места раздутой манжеты эндотрахеальной трубки.
У больных, не перенесших интубацию, факторами риска развития госпитальной пневмонии являются: прием антибиотиков, низкие показатели ph желудочного сока (после лечения стресс-индуцированной язвы), симптомы сердечной, легочной, печеночной и почечной недостаточности.
Основными факторами риска, способствующими развитию послеоперационной пневмонии у пациентов в возрасте старше 70 лет, являются: хирургические вмешательства на органах грудной клетки или брюшной полости.
Вероятные возбудители госпитальной пневмонии
Наиболее часто госпитальную пневмонию вызывают: Pseudomonas aeruginosa (у пациентов с муковисцидозом, нейтропенией, спидом, бронхоэктазами), Enterobacter sp, Кlebsiella pneumoniae, Escherichia coli, Serratia marcescens, Proteus sp, Acinetobacter sp; метициллин-резистентные и метициллин-чувствительные штаммы Staphylococcus aureus.
Пневмококки, Нaemophilus influenzae и Staphylococcus aureus, приводят к возникновению пневмонии, симптомы которой появляются на 4-7 сутки после госпитализации. Сроки развития заболевания, вызываемого грамотрицательными энтеробактериями, определяются продолжительностью интубации.
Предшествующая антибиотикотерапия повышает вероятность возникновения полимикробной инфекции, вызванной Pseudomonas и метициллин-резистентными штаммами Staphylococcus aureus. Инфекции, причиной развития которых являются резистентные возбудители, повышают показатели заболеваемости и смертности.
Прием кортикостероидов в высоких дозах увеличивает вероятность возникновения пневмонии, вызванной Legionella и Pseudomonas.
Критерии диагноза внебольничной пневмонии
Диагноз внебольничной пневмонии устанавливается на основании сочетания изменений на рентгенограмме (долевая или очаговая инфильтрация) с двумя из следующих признаков
Остролихорадочное начало заболевания (температура выше 38° С).
Кашель с мокротой.
Одышка (чатота дыхания более 20/мин)
Аускультативные признаки пневмонии (влажные мелкопузырчатые хрипы и/или крепитация) .
Лейкоцитоз более 10*10 9 /л и/или палочкоядерный сдвиг более 10%
Лейкопения менее 4*10 9 /л
Критерии диагноза госпитальной пневмонии
Появление "свежих" очагово-инфильтративных изменений в легких на рентгенограмме.
Два или более из следующих признаков:
Повышение температуры тела более 39° С.
Бронхиальная гиперсекреция.
Pao 2 менее 70 мм рт. Ст. (при дыхании комнатным воздухом) или pao 2 /fio 2 240 мм рт.ст. (при ИВЛ или ингаляции кислорода)
Два или более из следующих признаков:
Кашель, одышка, аускультативные признаки пневмонии.
Лейкоцитоз более 10*10 9 /л и/или палочкоядерный сдвиг более 10%
Лейкопения менее 4*10 9 /л
Гнойная мокрота или бронхиальный секрет (в мазке полморфноядерные лейкоциты более 25 в поле зрения при малом увеличиении).
Критерии тяжелого течения пневмонии
Для оценки пневмонии как тяжелой необходимо наличие хотя бы одного критерия.
Острая дыхательная недостаточность.
Частота дыхания более 30/мин.
Насыщение кислородом менее 90%
Гипотензия.
Систолическое артериальное давление менее 90 мм рт. Ст.
Диастолическое артериальное давление менее 60 мм рт. Ст.
Двухстороннее или многодолевое поражение легких.
Острая почечная недостаточность.
Нарушение сознания.
Тяжелая сопутствующая патология (застойная сердечная недостаточность 2 - 3 степени, цирроз печени, декомпенсированный сахарный диабет, хроническая почечная недостаточность).
Внелегочный очаг инфекции (менингит, перикардит и др.).
Лейкопения < 3х10 9 /л или лейкоцитоз > 25х10 9 /л.
Гемоглобин менее 100 г/л.
Гематокрит менее 30%
План антибактериальной терапии в зависимости от клинической ситуации
Объем лечения и выбор антибиотиков зависит от клинической ситуации.
Внебольничная пневмония у лиц моложе 60 лет без сопутствующих заболевания легкого - средней тяжести течения
Лекарственные средства первой линии
Амоксициллин ( Флемоксин солютаб ) внутрь по 0,5-1г 3р/сутки 7-10 сут или
Азитромицин ( Сумамед , Азитрал ) внутрь 0,5г 1р в 1-е сутки, далее 0,25г 1р/сут в течение 4 сут или
Кларитромицин ( Клацид ) внутрь по 0,5г 2р/сут 7-10 сут или
Рокситромицин ( Рулид ) внутрь по 0,15г 2р/сут 7-10 сут или
Спирамицин ( Ровамицин ) внутрь по 3 000 000 2р/сут 7-10 сут.
Альтернативные лекарственные средства
Левофлоксацин ( Таваник ) внутрь по 0,5г 1р/сут 7-10 сут или
Моксифлоксацин ( Авелокс ) внутрь по 0,4г 1р/сут 7-10 сут.
Внебольничная пневмония у лиц старше 60 лет и/или на фоне сопутствующих заболевания легкой или средней тяжести
Лекарственные средства первой линии
Амоксициллин / клавуланат ( Амоксиклав , Аугментин ) внутрь по 0,625г 3р/сут или по 1г 2р/сут 7-10 сут или
Цефуроксим (Зинацеф) внутрь по 0,5г 2р/сут 7-10 сут.
Альтернативные лекарственные средства
Левофлоксацин ( Таваник ) внутрь по 0,5г 1р/сут 7-10 сут или
Моксифлоксацин ( Авелокс ) внутрь по 0,4г 1р/сут 7-10 сут или
Цефтриаксон ( Роцефин ) в/м 1-2г 1р/сут 7-10 сут.
Внебольничная пневмония средней тяжести течения с нарастающей негативной динамикой (рекомендуется госпитализация)
Внебольничная пневмония тяжелого течения (требуется госпитализация)
Лекарственные средства первой линии
Проводится лечение одновременно препаратами двух групп: бета-лактамный антибиотик + макролид.
Бета-лактамы
Амоксициллин / клавуланат ( Амоксиклав , Аугментин ) в/в по 1,2г 3р/сут 10 сут или
Цефтриаксон ( Роцефин ) в/в или в/м 1-2г 1р/сут 10 сут или
Цефепим ( Максипим ) в/в 1-2г 2р/сут 10 сут или
Цефотаксим ( Клафоран ) в/в 1-2г 2-3р/сут 10 сут.
В комбинации с макролидами.
Макролиды
Кларитромицин (Клацид) в/в по 0,5г 2р/сут 10 сут или
Спирамицин ( Ровамицин ) по 1 500 000 МЕ 3р/сут 10 сут
Альтернативные лекарственные средства
Проводится лечение одновременно препаратами двух групп: респираторными фторхинолонами и цефалоспоринами.
Респираторные фторхинолоны
Левофлоксацин ( Таваник ) в/в 0,5г 1-2р/сут 10 сут или
Моксифлоксацин ( Авелокс ) в/в 0,4г 1р/сут 10 сут.
В комбинации с цефалоспоринами
Цефалоспорины
Цефтриаксон ( Роцефин ) в/в или в/м 1-2г 1р/сут 10 сут или
Цефотаксим ( Клафоран ) в/в 1-2г 2-3р/сут 10 сут.
Госпитальная пневмония нетяжелого течения у пациентов без факторов риска
Лекарственные средства первой линии
Амоксициллин / клавуланат ( Амоксиклав , Аугментин ) в/в по 1,2г 3р/сут 7-14 сут или
Цефотаксим ( Клафоран ) в/в 1-2г 2-3р/сут 7-14 сут или
Цефтриаксон ( Роцефин ) в/в или в/м 1-2г 1р/сут 7-14 сут.
Альтернативные лекарственные средства
Применяется лечение одновременно препаратами двух групп: респираторными фторхинолонами (или цефалоспоринами) и аминогликозидами.
Респираторные фторхинолоны (или цефалоспорины).
Левофлоксацин ( Таваник ) в/в 0,5г 1р/сут 7-14 сут или
Моксифлоксацин ( Авелокс ) в/в 0,4г 1р/сут 7-14 сут или
Цефепим ( Максипим ) в/в 1-2г 2р/сут 7-14 сут.
В комбинации с аминогликозидами.
Аминогликозиды
Амикацин ( Амикацин ) в/в 15-20мг/кг 1р/сут 7-14 сут или
Гентамицин ( гентамицин ) в/в 3-5мг/кг 1р/сут 7-14 сут.
Госпитальная пневмония нетяжелого течения у пациентов у пациентов с факторами риска
Лекарственные средства первой линии
Имипенем в/в 0,5г 3-4р/сут 7-14 сут или
Меропенем ( Меронем ) в/в 0,5г 3-4р/сут 7-14 сут или
Цефипим ( Максипим ) в/в 1-2г 2р/сут 7-14 сут.
Альтернативные лекарственные средства
Левофлоксацин ( Таваник ) в/в 0,5г 1р/сут 7-14 сут или
Моксифлоксацин (Авелокс) в/в 0,4г 1р/сут 7-14 сут.
Госпитальная пневмония тяжелого течения и у пациентов, находящихся на ИВЛ
Лекарственные средства первой линии
Имипенем ( Тиенам ) в/в 0,5г 3-4р/сут 7-14 сут или
Цефепим ( Максипим ) в/в 1-2г 2р/сут 7-14 сут или
Цефтазидим ( Фортум ) в/в 2г 3р/сут 7-14 сут.
Лекарственные средства, применямые при неэффективности первой линии
При неэффективности (отсутствие положительной клинической динамики в течение 3 суток) стартовой терапии необходимы данные микробиологического исследования о микрофлоре и ее чувствительности/резистентности. При отсутствии данных микробиологического исследования применяют комбинацию препаратов:
Меропенем ( Меронем ) в/в по 0,5г 3-4р/сут +
Амикацин ( Амикацин ) в/в 15-20мг/кг 1р/сут +
Ванкомицин (медленно, не менее 60 мин на инфузию) в/в по 1г 2р/сут.
При неэффективности второго этапа терапии к лечению добавляют Флуконазол ( Дифлюкан ) в/в 400мг 1р/сут.
Общие принципы лечения
Первая задача, которую необходимо решить, это определение места лечения пациента. От степени тяжести заболевания зависит объем различных лечебно-диагностических мероприятий. Критерии внебольничной пневмонии, требующей госпитализации в стационар: Возраст > 70 лет; Наличие хронического инвалидизирующего заболевания (ХОБЛ, застойная сердечная недостаточность, хроническая печеночная или почечная недостаточность, сахарный диабет, алкоголизм или наркомания, иммунодефицитные состояния, включая ВИЧ) ; Отсутствие ответа на предшествующую антибактериальную терапию в течение 3 дней ; Снижение уровня сознания ; Возможная аспирация ; Частота дыхания > 30 в минуту ; Нестабильная гемодинамика ; Сепсис или метастатическая инфекция ; Вовлечение в процесс нескольких долей легкого ; Значительный плевральный выпот ; Образование полостей ; Лейкопения (< 4,000 клеток/мм3) или выраженный лейкоцитоз ( > 20,000 клеток/мм3) ; Анемия (гемоглобин < 90 г/л) ; Острая почечная недостаточность (мочевина крови > 7 ммоль/л). Критерии внебольничной пневмонии, требующей госпитализации в отделение интенсивной терапии: Острая дыхательная недостаточность: гипоксемия (pao2 / fio2 < 250 мм рт.ст. < 200 мм рт.ст. У больных ХОБЛ); признаки утомления диафрагмы; потребность в искусственной вентиляции легких Нестабильная гемодинамика: шок (систолическое АД < 90 мм рт.ст. Или диастолическое АД < 60 мм рт.ст.); потребность в вазопрессорах более 4 часов; диурез < 20 мл/час (при отсутствии гиповолемии) Острая почечная недостаточность, требующая проведения диализа ДВС-синдром Менингит Кома .
Антибиотикотерапия
Отсутствие простого, быстро выполнимого, чувствительного, специфичного и недорогого метода микробиологического определения возбудителя бронхолегочной инфекции обуславливает причину частого применения эмпирического метода антибиотикотерапии, базирующегося на эпидемиологических и семиотических данных в популяции больных и на индивидуальной переносимости (т.н. Стратегия "ex juvantibus"). При назначении антибиотика следует учитывать современные сведения об устойчивости возбудителей к наиболее распространенным препаратам. Так, 30 % штаммов пневмококка резистентны к пенициллину, прогрессивно увеличивается количество штаммов, не чувствительных к цефалоспоринам.
Принципы рациональной антибиотикотерапии:
- Лечение следует начинать, не дожидаясь результатов микробиологического исследования, т.е. Эмпирически. По существующим мировым стандартам антибиотик должен быть назначен не позже 8 часов после госпитализации. При получении бактериологических данных лечение корректируют в случае его недостаточной эффективности; - При выборе антибактериального лечения целесообразно использовать также результаты исследования мокроты по Граму; - Исследовать гемокультуру не позже, чем в течение 24 часов после госпитализации; - Перед началом терапии получить образцы для микробиологического исследования, "слепое" назначение антибиотиков при лихорадке неясного генеза обычно приводит к дальнейшим трудностям в постановке диагноза; - При выборе антибактериальных препаратов следуют учитывать: тип возбудителя (вероятный, определяемый по клиническим данным), степень тяжести заболевания, потенциальную токсичность препаратов и возможные противопоказания, а также аллергологический анамнез; - Необходимо решить вопрос о применении монотерапии или комбинации нескольких антибактериальных препаратов; - Очень важно учитывать резистентность микробной флоры к антибактериальной терапии; - Доза и частота введения препарата должны быть соизмеримы с интенсивностью патологического процесса; - Использование пероральной антибактериальной терапии при легких и среднетяжелых формах, ступенчатой терапии при тяжелых пневмониях; - Следует контролировать терапевтическое действие препарата и отслеживать возможные побочные реакции; - При неосложненной пневмонии предпочтительно лечение антибиотиками (лучше - одним препаратом) не более 5-7 дней при условии быстрой нормализации температуры. Сохраняющиеся рентгенологические изменения в виде усиления легочного рисунка и др. Не являются показанием к продолжению антибиотикотерапии; - Нельзя игнорировать стоимость используемого препарата. Существует некоторая разница в подходах к лечению внебольничных пневмониях легкого течения между Американскими и Европейскими регламентирующими структурами. Так в США основными препаратами при лечении амбулаторных больных являются доксициклин, макролиды и "респираторные" фторхинолоны (левофлоксацин, моксифлок-сацин и др.). В европейских и российских рекомендациях препаратами выбора являются аминопенициллины. Не исключается возможность применения других групп антибиотиков (например, макролидов), но только при высокой частоте атипичных возбудителей в регионе или при непереносимости пенициллинов. Таблица 3 Основные препараты, применяемые при лечении внебольничных пневмоний [14]
|
Рекомендации |
Течение | |
|
Легкое и среднетяжелое |
Тяжелое | |
|
Американское общество инфекционных болезней |
Азитромицин, клартромицин, доксициклин, фторхинолоны III поколения |
Цефотаксим (цефтриаксон) ±кларитромицин или азитромицин |
|
Европейский комитет по изучению внебольничных пневмоний |
Аминопенициллины, в т.ч. ИЗП* или бензилпенициллин ± макролид |
Цефотаксим (цефтриаксон) +макролид |
|
Комиссия по антибиотической политике Минздрава РФ |
Аминопненициллины, в т.ч. ИЗП*, макролиды, фторхинолоны III поколения |
Цефотаксим (цефтриаксон) +макролид фторхинолоны |
* - ингибиторзащищенные пенициллины Принимая во внимание относительно низкую частоту пенициллинорезистентности пневмококков в России, последний подход представляется более рациональным. Кроме того, существует мнение о более сдержанном отношении к широкому использованию препаратов (макролиды, тетрациклины), устойчивостьs. Pneumoniae к которым развивается быстрее, чем к пенициллинам, назначаемым в адекватных дозах. Вместе с тем, правильное назначение тетрациклинов, учитывающее фармакокинетические особенности (высокую липофильность) и необходимость применения высокой насыщающей дозы (в первые 3 суток по 200 мг 2 раза в сутки, затем 200 мг в сутки однократно), способно преодолеть дальнейшее развитие резистентности и, по данным ряда исследований, позволяет отнести доксициклин к препаратам выбора . В нашей стране при лечении внебольничных пневмоний легкого и среднетяжелого течения широко используются фторхинолоны (ципрофлоксацин и офлоксацин), обладающие высокой эффективностью против гемофильной палочки, моракселлы, представителей семейства Enterobacteriaceae и легионеллы. В то же время они характеризуются существенно более сниженной, в сравнении с беталактамами и макролидами, активностью в отношении преобладающего патогена- пневмококка. По этой причине их следует исключить из числа препаратов первого ряда в лечении внебольничных пневмоний . Вместе с тем, фторхинолоны последних генераций ("респираторные" фторхинолоны, а также препарат IV поколения - моксифлоксацин) имеют весьма высокую антипневмококковую активность, что делает их весьма привлекательными для лечения этой категории больных. Кроме того, моксифлоксацин имеет и антианаэробную направленность . У больных пневмониями тяжелого течения следует назначать антибиотики широкого спектра действия, максимально перекрывающие как грамположительную, так и грамотрицательную предполагаемую флору "ингибиторзащищенные" пенициллины (ампициллин/сульбактам, пиперациллин/тазобактам, тикарциллин/клавуланат), цефалоспорины III-IV поколений, фторхинолоны, карбапенемы. В ряде случаев используется комбинация аминогликозидов с цефалоспоринами (синергичное действие против синегнойной палочки), макролидами и рифампицином (при подозрении на легионеллезную пневмонию). Продолжительность антимикробной терапии до 14-20 дней. При выборе антибиотика следует учитывать его фармакодинамические свойства. Аминогликозиды накапливаются в легочной ткани в недостаточном количестве, в то время как макролиды нового поколения и фторхинолоны создают в ней высокую концентрацию препарата. Вероятно, именно с концентрацией антибиотика в легких связан так называемый постантибиотический эффект - способность препарата оказывать антибактериальное действие после его отмены. Наличие у антимикробного препарата постантибиотического эффекта, как, например, у азитромицина, позволяет назначать последний в течении короткого срока (3-5 дней) Результаты последних исследований заставляют несколько пересмотреть устоявшееся отношение к аминогликозидам. Крайне высокий уровень резистентности пневмококка к гентамицину вынуждает полностью исключить этот препарат из практики лечения внебольничной пневмонии. Учитывая то, что аминогликозидные антибиотики обладают относительно небольшой способностью к пенетрации их также никогда не следует использовать для монотерапии при лечении грамотрицательной легочной инфекции. При этом следует отдавать предпочтение препаратам последних генераций (амикацин, тобрамицин). И наконец, в настоящее время большинство специалистов едины во мнении о недопустимости монотерапии пневмоний ко-тримоксазолом . Следует считаться с затратами на антибактериальную терапию, которые могут быть весьма значительными. Стоимость парентеральных антибиотиков значительно выше, чем таблетированных форм, и для их введения требуются расходуемые материалы (шприцы, иглы, капельницы и т.п.). В последние годы успешно применяется так называемая ступенчатая (step-down) терапия. При использовании этой методики лечение начинается с внутривенного применения антибиотика. При достижении клинического эффекта (обычно через 2-3 суток), когда парентеральная антибактериальная терапия обеспечила улучшение состояния больного, сопровождающееся снижением или нормализацией температуры тела, уменьшением лейкоцитоза, возможен переход на пероральное применение антибиотиков, если предполагается хорошая всасываемость. На этом этапе предпочтительными являются препараты, показатели фармакокинетики которых позволяют применять антибиотик 1-2 раза в сутки.
Лечение госпитальных пневмоний
Принципиально терапия госпитальных пневмоний (ГП) не отличается от таковой при лечении внебольничных пневмоний. Однако особенности этиологии (нозокомиальная инфекция), целый ряд отягощающих течение болезни факторов существенно влияют на спектр применяемых антибактериальных препаратов и объем средств патогенетической терапии. Для удобства выбора начальной антибактериальной терапии предложено подразделять ГП на 2 подгруппы. 1. Пневмонии, развивающиеся у пациентов в отделениях общего профиля без факторов риска, или ранние респиратор-ассоциированные пневмонии, развивающиеся у больных в отделениях интенсивной терапии и реанимации. Препаратами выбора для эмпирической терапии могут быть парентеральные цефалоспорины III поколения (цефотаксим или цефтриаксон) в максимальных дозах, а в качестве альтернативы следует рассматривать фторхинолоны. При высоком риске псевдомонадной этиологии ГП целесообразно назначить антисинегнойные цефалоспорины III-IV поколений (цефтазидим, цефоперазон, цефепим) в сочетании с аминогликозидами (амикацин, тобрамицин). Следует и в данном случае учитывать, что гентамицин в данном случае менее эффективен в связи с растущей резистентностью возбудителей ГП к данному препарату во многих регионах. 2. Поздние респиратор-ассоциированные пневмонии и пневмонии, возникающие у пациентов в отделениях общего профиля при наличии факторов риска (предшествующая антибактериальная терапия или антибиотикопрофилактика). У этой категории больных особенно высока вероятность этиологической роли псевдомонад и полирезистентных (госпитальных) штаммов энтеробактерий, стафилококков, энтерококков. Могут быть следующие варианты эмпирической терапии: карбапенемы внутривенно (меропенем 1 г 3 раза; имипенем 0,5 г 4 раза), антипсевдомонадные цефалоспорины IV поколения + аминогликозиды, антипсевдомонадные пенициллины (мезлоциллин, азлоциллин, пиперациллин, пиперациллин/тазобактам, тикарциллин/клавулановая кислота) + аминогликозиды, азтреонам + аминогликозиды, ципрофлоксацин (например, в комбинации с аминогликозидами); при подозрении на легионеллезную инфекцию - макролиды (эритромицин, азитромицин, мидекамицин и др.); при высокой вероятности стафилококковой или энтерококковой инфекции - гликопептиды (ванкомицин); при неэффективности предшествующей терапии, включавшей гликопептиды - противогрибковые препараты (амфотерицин В, флюконазол). При аспирационных ГП высока вероятность этиологической роли анаэробов, поэтому в схему лечения включают антианаэробные препараты широкого спектра действия (защищенные b-лактамы, цефокситин, цефотетан, цефметазол, карбапенемы) или узкой направленности (метронидазол, тинидазол, линкомицин, клиндамицин) в комбинации с другими антибиотиками. Таблица 4 Программа эмпирической антибактериальной терапии госпитальной пневмонии в отделениях общего профиля [17]
|
Группа больных |
Наиболее вероятные возбудители |
Препараты 1-го ряда1 |
Препараты 2-го ряда (резерв)2 | |
|
Основные средства |
Альтернативные средства | |||
|
I. Нетяжелое течение, отсутствие факторов риска, без предшествующего применения антибиотиков |
S.pneumoniae (PS); S.aureus (MS); H.influenzae; Enterobacteriaceae |
Цефуроксим + гентамицин; Амоксициллин /клавуланат + гентамицин |
Цефотаксим Цефтриаксон |
Цефепим3 Тикарциллин /клавуланат ±аминогликозиды Фторхинолоны 3,4 |
|
II. Тяжелое течение или наличие факторов риска или предшествующее применение антибиотиков |
Enterobacteriaceae S.aureus (MS, MR) S.pneumoniae (риск PR) Acinetobacter spp. |
Цефепим 3,5 |
Тикарциллин/клавуланат Пиперациллин/тазобактам |
Имипенем5 Меропенем5 Фторхинолоны 4 |
|
III. Любое течение при наличии факторов риска P.aeruginosa |
Те же + P.aeruginosa |
Цефтазидим5 Цефоперазон5 (+аминогликозид ) |
Цефепим5 Ципрофлоксацин5 (+ аминогликозид) |
Имипенем5 Меропенем5 |
|
IV. Риск аспирации или абсцедирование |
S.aureus K.pneumoniae Анаэробы |
Линкомицин ± аминогликозид Амоксициллин/клавуланат |
Цефалоспорин III + линкомицин или метронидазол Тикарциллин/клавуланат |
Цефепим или Фторхинолон (+ метронидазол) Имипенем Меропенем |
Примечание: 1 - отнесение препаратов в разряд основных или альтернативных средств должно быть обосновано с учетом локальных данных антибиотикорезистентности и курсовой стоимости лечения (с учетом непрямых затрат); 2 - назначаются при неэффективности стартовой терапии средствами 1-го ряда; 3 - при риске аспирации добавляют линкомицин или метронидазол; 4 - левофлоксацин, офлоксацин, ципрофлоксацин; 5 - при выделении S.aureus ( MR) назначают ванкомицин или линезолид или рифампицин; PS - пенициллинчувствительные штаммы; PR - пенициллинрезистентные штаммы; MS - метиициллинчувствительные штаммы; MR - метициллинрезистентные штаммы. Длительность антибиотикотерапии при ГП, определяеемая обычно индивидуально, варьирует в зависимости от характера течения и колеблется от 7-10 до 14-21 дня. Клиниче-ское улучшение не бывает явным в течение первых 48-72 часов и, следовательно, выбранную схему антимикробного лечения в этот период не следует менять; корректировать терапию лишь тогда, когда будет отмечено прогрессирующее ухудшение или будут получены соответствующие результаты первичного микробиологического исследования. Основным критерием завершения антибиотикотерапии является стойкая (в течение 3-4 дней) нормализация температуры. Сохранение отдельных клинических, лабораторных и/или рентгенологических признаков заболевания не является абсолютным показанием к про-должению антибактериальной терапии или ее модификации. В подавляющем большинстве случаев их разрешение происходит самопроизвольно или под влиянием патогенетической и симптоматической терапии.
Осложнения пневмоний
Выделяют легочные и внелегочные осложнения пневмонии, влияющие на клиническое течение и план лечения.
Легочные осложнения
дыхательная недостаточность
плеврит и/или эмпиема плевры
абсцесс легких
острый респираторный дистресс-синдром
пневмоторакс.
Внелегочные осложнения
инфекционно-токсический шок
сепсис
Кроме того возможны поздние осложнения (после клинического выздоровления), влияющие на дальнейший прогноз
пневмосклероз
эмфизема легких
хронический бронхит и бронхиолит
пневмоторакс.
Шок У больных с тяжелым течением пневмонии наблюдаются два вида шока: Истинный гиповолемический шок (при недостаточном потреблении жидкости на фоне увеличения ее потери), который характеризуется низким значением ДЗЛА, уменьшением сердечного выброса и компенсаторным увеличением общего периферического сопротивления сосудов (ОПСС). Септический шок (возникающий при дилатации резистивных сосудов под воздействием эндотоксина грамотрицательных микроорганизмов), в этом случае наблюдается снижение ОПСС, компенсаторное увеличение сердечного выброса и низкое (реже нормальное) ДЗЛА. Септический шок нередко диагностируется только при наступлении нарушения сознания, так как даже при низком АД конечности больного остаются парадоксально теплыми, а такие симптомы, как тахикардия и тахипноэ относятся на счет основного заболевания. Поэтому больным с тяжелым течением пневмонии необходимо частое (каждые 1–2 ч) проведение тонометрии, контроль диуреза. Снижение АД (систолического АД<90, а диастолического АД<60 мм рт. ст.) наряду с уменьшением диуреза (<20 мл/ч) свидетельствуют о развитие шока. Развитие шока нередко сопровождается развитием РДСВ и острой почечной недостаточности. Терапия у больных в шоковом состоянии проводится под контролем ЦВД (желательно определение ДЗЛА), должно проводиться почасовое измерения АД и диуреза. Объем инфузионной терапии определяется в зависимости от тяжести гиповолемического шока. При септическом шоке не приходится ожидать быстрого положительного эффекта инфузионной терапии (как при гиповолемическом). При низком или даже нормальном ДЗЛА показано проведение инфузионной терапии для поддержания средней величины АД>60 мм рт. ст. При шоке инфузионная терапия (5% раствор альбумина, полиглюкин, физиологический раствор) всегда предпочтительнее сосудосуживающих средств. Применение коллоидных и кристаллоидных растворов для купирования септического шока дает одинаковый результат. Показателем безопасности инфузионной терапии является величина ДЗЛА<15 мм рт. ст., суточный объем инфузии при септическом шоке может достигать 8–12 л. При недостаточной эффективности инфузионной терапии можно рекомендовать назначение дофамина или добутамина. Применение ГКС при септическом шоке в настоящее время не рекомендуется (уровень рекомендаций Е).
Респираторный дистресс-синдром взрослых Патофизиологические механизмы этого состояния недостаточно известны. Основной патогенетический механизм заключается в массивном пропотевании плазмы и форменных элементов крови в интерстициальные и альвеолярные пространства, что приводит к гипоксии, не корригируемой ингаляцией кислорода (экссудат занимает практически всю поверхность легких), с последующим развитием воспаления с исходом в тяжелый интерстициальный фиброз с развитием тяжелой рестриктивной дыхательной недостаточности. Клинически отмечается резко выраженная одышка, которая развивается в 1–2-е сутки после манифестации исходного заболевания (тяжелая пневмония, аспирация содержимого желудка, при травме грудной клетки, шок, ожоги и т.д.). Диагностическими критериями РДСВ являются:
острое начало одышки;
РаО2/FiО2<200;
двусторонние инфильтраты на прямой рентгенограмме легких;
ДЗЛА<18 мм рт. ст. (при отсутствии недостаточности кровообращения – НК). Основным симптомом является выраженная гипоксемия, при оценке ГАК РаО2 крайне низкое, а Рсо2 остается нормальным или несколько повышено. Появление рентгенологических изменений – диффузной двусторонней инфильтрации (более демонстративной на периферии) – может на несколько часов отставать от функциональных сдвигов. Тяжесть гипоксемии, как правило, такова, что уже в течение первых 48–72 ч возможности респираторной поддержки оказываются исчерпанными, величина РаО2/FiО2 (FiO2 – концентрация кислорода во вдыхаемой смеси) уменьшается до 80 и требуется проведение ИВЛ. На рентгенограмме – феномен "снежной бури" и часто признаки плеврита. Необходимо проводить дифференциальную диагностику с отеком легких, ТЭЛА и пневмоцистной пневмонией. Формирование фиброза происходит в том случае, если повреждение ткани легкого продолжается более 14 сут. Имеются неподтвержденные данные об эффективности в этом случае ГКС (уровень рекомендаций II). При лечении этого состояния следует добиваться поддержания SaO2 на уровне 90% и сердечного выброса (при его снижении), для чего используют добутамин 5–15 мкг/кг/мин. Может потребоваться гемотрансфузия для поддержания гемоглобина на уровне не ниже 100 г/л. При необходимости применения токсических (FiO2 выше 60%) концентраций кислорода применяют ИВЛ в режиме положительного давления конца выхода (ПДКВ, около 5 мм вод. ст.) газовой смесью с высоким (60–80%) содержанием кислорода. В последующем снижение концентрации кислорода во вдыхаемой смеси производят постепенно под контролем ГАК. Часто развитие РДСВ сопровождается развитием гиповолемии, для инвазивного мониторинга ДЗЛА показана катетеризация подключичной вены. При ДЗЛА<15 мм рт. ст. показана инфузия жидкости, а при ДЗЛА>18 мм рт. ст. требуется применение инотропных средств (добутамин 5 мкг/кг/мин, возможно увеличение дозы при сохранении высокого ДЗЛА). Применение диуретиков и ГКС, а также инфузии концентрированных растворов альбумина оказалось клинически неэффективным (уровень рекомендаций D).
Абсцесс легкого Наиболее частыми возбудителями, вызывающими деструкцию легочной ткани, являются стафилококки, стрептококки, K. pneumoniae, анаэробная флора. Средний срок образования абсцесса при пневмонии составляет 5–7 сут, а при пневмонии, вызванной K. pneumoniae, – 3–4 сут. Сохранение высокой температуры и массивное отделение мокроты позволяют заподозрить абсцедирование. Прорыв абсцесса в плевральную полость приводит к развитию эмпиемы плевры. Постаспирационные абсцессы, как правило, локализуются в верхнем сегменте нижней доли или заднем сегменте верхней доли. Гематогенная диссеминация S. aureus приводит к множественным абсцессам обоих легких. Для абсцессов, вызванных K. pneumoniae, характерна верхнедолевая локализация. При анаэробной пневмонии и при пневмонии, вызванной K. pneumoniae, мокрота имеет специфический запах. При абсцедировании необходимо увеличить дозы антибактериальных средств, улучшить дренажную функцию бронхов, посредствам проведения постурального дренажа и бронхоскопического санирования. В тех случаях, когда не удается добиться дренирования абсцесса, показано хирургическое лечение. При каждом случае абсцедирования необходимо проводить серию анализов мокроты на туберкулез.
Плеврит и эмпиема плевры Лечение больных с неинфицированным плевральным выпотом при отсутствии тенденции к увеличению его объема, как правило, консервативное. Обязательным условием является бактериологическое и цитологическое исследование экссудата после проведения диагностической плевральной пункции тонкой иглой. Для неосложненного плеврита характерны уровень рН>7,3, глюкозы более 40 мг/дл и ЛДГ меньше 1000 МЕ. При парапневмоническихплевритах с подобными характеристиками можно ограничиться проведением антибактериальной терапии. При осложненных плевритах (рН 7,1–7,29, глюкоза менее 40 мг/дл и ЛДГ>1000 МЕ) рекомендуется дополнить антибактериальную терапию введением в плевральную полость фибринолитических препаратов. Хирургическое лечение показано в случае эмпиемы плевры (рН<7,1).
Дыхательная недостаточность Развитие инфильтрата и выключение из нормального газообмена участков легких приводит к гипоксии, которая проявляется диффузным (так называемым теплым) цианозом, тахипноэ, одышкой, а на поздних стадиях – удушьем (как отражение "усталости" перенапряженной дыхательной мускулатуры), изменением ЧСС и АД. Направление этих изменений зависит от степени гипоксии: • при умеренной гипоксии – тахикардия и повышение АД; • по мере прогрессирования нарушений дыхания – брадикардия и гипотония. При выраженной гипоксии отмечаются нарушения ментального статуса – заторможенность, энцефалопатия, психическая или эмоциональная неадекватность (часто больной некритичен к своему состоянию, реже развиваются гипоксические и/или интоксикационные психозы – оба состояния крайне неблагоприятны в прогностическом отношении), коматозное состояние. Назначение кислородной смеси у больных с гипоксией ограничивается токсическим действием кислорода и снижением величины сердечного выброса на фоне назначения оксигенотерапии. Токсичность кислорода увеличивается пропорционально увеличению содержания кислорода во вдыхаемой смеси, поэтому FiO2 желательно поддерживать на уровне не более 60%. Кроме того, способность ингаляций кислорода снижать сердечный выброс может приводить к ситуации, при которой с увеличением содержания кислорода в артериальной крови не происходит улучшение тканевой оксигенации. Ужесточенные (с учетом токсического действия кислорода) рекомендации Института сердца, легких и крови (США) предусматривают проведение кислородотерапии при острых состояниях с РаО2<60 мм рт. ст. либо снижением насыщения гемоглобина артериальной крови кислородом SaО2<90% (уровень рекомендаций С). При величине SaО2, близкой 90%, дальнейшее увеличение насыщения гемоглобина кислородом возможно лишь при значительном (и опасном вследствие токсического эффекта) увеличении объема вдыхаемого кислорода, так как кривая диссоциации оксигемоглобина в области, соответствующей насыщению кислородом 90–100%, располагается практически горизонтально. Таким образом, значительное увеличение концентрации вдыхаемого кислорода обеспечивает лишь незначительное увеличение SaO2, поэтому не следует добиваться ее увеличения более 90%. Оптимальной является прерывистая схема ингаляции под контролем ГАК. При любом методе ингаляции (носовые катетеры, маски, маски с расходным мешком или ИВЛ) обязательно увлажнение (при возможности и согревание) газовой смеси. При снижении РаО2<60 мм рт. ст. либо при уменьшении насыщения гемоглобина артериальной крови кислородом свыше 90% следует немедленно начать ингаляцию кислорода через носовые катетеры или маску – контроль эффективности оксигенотерапии проводится путем повторных измерений ГАК и SaO2 пульсоксиметром. Если первоначальная оксигенотерапия эффективна и показатели ГАК стабилизировались на приемлемом уровне, следует подобрать минимальную концентрацию кислорода во вдыхаемой смеси, обеспечивающую адекватный газовый состав крови. В любом случае не следует назначать смесь с содержанием кислорода более 60%, а если для поддержания адекватной (более 90%) SaO2 требуется большая концентрация кислорода, то переходят к использованию кислородных масок или к аппаратной поддержке положительным давлением газовой смеси. Если, несмотря на описанные выше мероприятия, частота дыхания больного превышает 24–25 в 1 мин, в акте дыхания принимает участие дополнительная мускулатура и(или) не удается поддержать РаО2 на уровне выше 60 мм рт. ст. и SaО2 на уровне более 90%, следует проводить самостоятельное дыхание с постоянным положительным давлением в дыхательных путях, а при неэффективности – поддержку давлением через лицевую маску. В последнем случае можно повысить FiО2 до 0,8–1,0 в продолжении 4–6 ч при давлении смеси 25–30 см вод. ст.. При неэффективности предыдущих методов или возникновении хотя бы 2 состояний из перечисленных ниже показана интубация трахеи и перевод на ИВЛ. При сохранении тяжелой острой дыхательной недостаточности (ОДН), несмотря на проведение ИВЛ, приходится прибегать к экстракорпоральной оксигенации (Extracorporeal membrane oxygenation – ECMO) или ИВЛ в брадипноическом режиме с малым (6–9 мл/кг) дыхательным объемом в сочетании с экстракорпоральной элиминацией углекислоты (Extracorporeal carbon dioxide removal – ECCO2R). Показания к ИВЛ при пневмонии (уровень рекомендаций С) 1. Апноэ. 2. Острые нарушения ритма дыхания (периодическое дыхание). 3. ЧД>40 (если это не связано с гипертермией выше 38,5°С или гиповолемией). 4. Клинические признаки гипоксемии и(или) гиперкапнии, если они не исчезают после консервативных меропрятий – поддержки давлением через лицевую маску. 5. Снижение ЖЕЛ<12 мл/кг и ОФВ<10 мл/кг. 6. Прогрессирующее снижение PaO2<60 мм рт. ст. при FiO2=1,0. 7. Присоединение гиперкапнии с PaCO2>45 мм рт. ст. 8. Нарушения сознания и психики. Примечание. Каждый пункт по отдельности является относительным показанием к ИВЛ. Наличие 2 и более критериев является абсолютным показанием к проведению ИВЛ.
Синдром системного воспалительного ответа Пневмония тяжелого течения может сопровождаться развитием сепсиса, который в этом случае следует рассматривать как ее осложнение. Согласно Консенсусу Американской коллегии врачей и Общества критической медицины США под термином сепсис понимают системный ответ организма на инфекцию. Считается, что помимо бактериемии в основе септических состояний лежит системный воспалительный ответ, при этом присутствию МО в крови уже не отводится первостепенная роль. Многообразные клинические проявления при сепсисе в первую очередь являются результатом ответной реакции организма на инфекцию. Эти реакции могут расцениваться как приспособительные, но вместе с тем их чрезмерная активность носит повреждающий характер. Например, активация нейтрофильных факторов фагоцитоза и лизиса МО (оксидазы, протеазы, свободные радикалы), с одной стороны, способствует уничтожению возбудителя заболевания, но с другой – приводит к повреждению эндотелия сосудов и как следствие – к дисфункции внутренних органов. Клинические критерии сепсиса (согласно Консенсусу Американской коллегии врачей и Общества критической медицины США) не обязательно включает наличие бактериемии. Кроме того, бактериемия часто имеет непродолжительный характер, что приводит к частым ложноотрицательным результатам при исследованиях гемокультуры. Ключевым признаком для диагностики сепсиса является лихорадка, обусловленная присутствием в крови медиаторов воспаления (в первую очередь простагландина Е2). При сепсисе (и реже при ССВО) у пожилых пациентов с нарушениями механизмов терморегуляции может отмечаться гипотермия. Течение сепсиса на ранних этапах обычно сопровождается гипервентиляцией с развитием дыхательного алкалоза и утомления дыхательной мускулатуры. Другим клиническим признаком, отмечающимся уже на ранней стадии сепсиса, является снижение ОПСС на фоне увеличения сердечного выброса с развитием гипотонии. Дальнейшие изменения гемодинамики больного могут проявляться снижением сердечного выброса, падением ОПСС или же, напротив, вазоконстрикцией, в каждом из этих случаев обычно сохраняется артериальная гипотензия. Прогрессирование гемодинамических нарушений, нарушение системы гемостаза, микротромбозы и повреждение эндотелия сосудов в конечном счете приводят к развитию полиорганной недостаточности, нарастанию лактат-ацидоза и развитию ДВС-синдрома. О полиорганной недостаточности свидетельствуют:
бради- и тахипноэ (более 30 в мин–1);
шок, брадикардия, желудочковые аритмии, острый инфаркт миокарда;
олигурия, увеличение креатинина и мочевины сыворотки;
гипербилирубинемия (>50 ммоль/л), повышение АСТ и АЛТ в 2 раза и больше;
ДВС;
стрессовые язвы, кровотечения из ЖКТ, перфорация кишечника;
нарушение сознания.
Терапия сепсиса представляет собой сложную задачу и складывается из нескольких направлений (уровень рекомендаций C) :
Антибактериальная терапия сепсиса. Оптимальным является выбор комбинации нескольких антибактериальных средств, что обеспечивает максимально широкий спектр антибактериальной активности. В ходе исследований было показано, что применение нескольких антибиотиков (благодаря синергическому эффекту) дает лучшие результаты при лечении сепсиса, чем монотерапия. Следует отдавать предпочтение лекарственным средствам с минимальными токсическими эффектами.
Стабилизация гемодинамики заключается в коррекции гиповолемии, при неэффективности инфузионной терапии – использование вазопрессорных аминов.
Респираторная поддержка.
Средства, модулирующие воспалительный ответ при сепсисе – НПВС, пентоксифиллин, антиоксиданты (в настоящее время проводятся исследования эффективности ацетилцистеина), моноклональные антитела к эндотоксину бактерий.
Оценка эффективности и безопасности лечения Оценка эффективности антибактериальной терапии проводится на основании клинической, микробиологической эффективности, динамики данных лучевой и лабораторной диагностики. Согласно рекомендациям Европейского руководства по оценке эффективности антибактериальных лекарственных средств, ее следует проводить неоднократно: во время лечения, при отмене препарата, при выписке больного из стационара и через 4 нед после завершения лечения. Единого критерия эффективности лечения пневмонии не существует. Считается, что в случае бактериальной пневмонии лучшими критериями эффективного лечения являются нормализация температуры и снижение уровня С-реактивного белка плазмы крови (уровень доказательности С). Наряду с ними можно опираться на динамику симптомов пневмонии (кашель, одышка), показатели газов артериальной крови, количество лейкоцитов в периферической крови, данные рентгенографии. Обычно у больных с неосложненной пневмококковой пневмонией в случае если терапия оказалась эффективной, температура тела нормализуется в среднем через 2, 5 дня после начала лечения, а при наличии вторичной бактериемии – через 6–7 дней. При этом изменения на рентгенограмме могут сохраняться в течение 1 мес и более. Если пневмония вызвана Legionella spp., у половины больных изменения на рентгенограмме сохраняются спустя 12 нед. Проведение микробиологического исследования проводится при поступлении больного и по окончании курса антибактериальной терапии. Дополнительные исследования показаны при клинической неэффективности лечения, в случае развития осложнений пневмонии, при недостоверности микробиологической неэффективности предыдущего исследования. При неэффективности проводимой терапии необходимо использовать следующие возможности:
Идентифицировать возбудитель и провести тест на чувствительность к антибиотикам.
Проверить соблюдение пациентом врачебных назначений.
Проверить адекватность дозы, путей и режима дозирования.
Эмпирически назначить комбинацию 2 препаратов, перекрывающих спектр наиболее вероятных возбудителей, или заменить антибиотик на препарат с более широким антибактериальным спектром.
Учесть пробелы в спектре действия ранее назначенных препаратов.
Выявить возможные осложнения пневмонии, развитие которых делает проводимую терапию неэффективной (абсцедирование, плеврит).
Атипичная пневмония. Этиология, патогенез. Клинические особенности заболевания, течение. Патогенетическая терапия с позиций медицины доказательств. Профилактика.
В 1937 году J.G. Scadding описал четыре случая необычного течения инфекции нижних дыхательных путей, употребив для их обозначения термин «диссеминированная фокальная пневмония». Практически одновременно с ним H.A.Reimann (1938) представил наблюдения за 8 пациентами со своеобразной клинической картиной нетяжелого респираторного заболевания, весьма близкой к т.н. диссеминированной фокальной пневмонии: сухой кашель, затрудненное дыхание/одышка, осиплость голоса, цианоз, заторможенность, профузная потливость, диффузная мелкоочаговая пневмоническая инфильтрация. Позже при попытке этиологической верификации этих случаев заболевания, для которых H.A.Reimann предложил использовать термин «атипичная пневмония» (этот термин приобретет широкую популярность значительно позже), был выделен фильтрующийся микроорганизм – т.н. агент Итона (Eaton agent). «Круг» замкнулся в 1962 году, когда культуру агента Итона удалось вырастить на агаре, и возбудитель получил современное та ксономическое название – Mycoplasma pneumoniae.
С момента первых описаний легионеллезной (Legionella pneumophila) и хламидийной (Chlamydia pneumoniae (В соответствии с современной таксономией хламидий (Evertt K.D. et al. Emended description of the order Chlamydiales, proposal of Parachlamydiaceae fam. nov. and Simkaniaceae fam. nov., each containing one monotypic genus, revised taxonomy of the family Chlamydiaceae, including a new genus and five new species, and standarts for the identification of organisms. Inter J Syst Bacterial 1999; 49: 415-440) виды Chlamydia pneumoniae, Chlamydia psittaci и Chlamydia pecorum выделены в отдельный род Chlamydophila, т.е. видовое название Chlamydia pneumoniae заменено на Chlаmydophila pneumoniae) ) пневмоний в 1976 и в 1986 гг. соответственно было обращено внимание, что вызываемый этими возбудителями симптомокомплекс легочного воспаления оказался весьма схожим с микоплазменной пневмонией. Это первоначально подмеченное клиническое впечатление легло в основу концепции синдромного подхода к диагностике пневмонии, т.е. ее разделению на типичную и атипичную.
Сегодня так называемые атипичные микроорганизмы (т.е. возбудители атипичной пневмонии) представляют собой весьма многочисленную группу помимо Mycoplasma pneumoniae, Legionella spp., Chlamydophila (Chlamydia) pneumoniae к ним относят Coxiella burnetti (возбудитель Qлихорадки), респираторные вирусы (прежде всего вирусы гриппа А и В, вирусы парагриппа 1, 2 и 3, респираторный синцитиальный вирус, вирус EpsteinBarr). Сюда же включаются и более редко встречающиеся микроорганизмы возбудители туляремии (Francisella tularensis), лептоспироза (Leptospira spp.), хантавирусы, хламидиеподобный возбудитель Z. Поскольку данный перечень возбудителей становится все более пространным и громоздким, то в современной медицинской литературе более распространена лаконичная трактовка термина атипичные возбудители, включающая только M.pneumoniae, C.pneumoniae и Legionella spp.
Основные трудности, встающие перед врачом при ведении пациентов с атипичной пневмонией, очевидно, лежат в области ее диагностики, а не антимикробной химиотерапии. Традиционно эпидемиологические, клинические и рентгенологические характеристики пневмонии в каждом отдельном случае оказываются ключевыми в этиологической ориентированности заболевания. И, как правило, первым шагом в этом направлении является дифференциация пневмонии на типичную и атипичную.
Типичная манифестация пневмонии характеризуется внезапным началом с ознобами, высокой лихорадкой, плевральными болями, продуктивным кашлем с отхождением ржавой или гнойной мокроты. Демонстративны и физические признаки пневмонической инфильтрации: участок бронхиального дыхания и/или локально выслушиваемая высокотембровая инспираторная крепитация. Рентгенологически визуализируется очаговое затенение легочной ткани в проекции доли (долей) или сегмента (сегментов). В клинической гемограмме часто отмечается лейкоцитоз и нейтрофилез. Streptococcus pneumoniae (пневмококк) наиболее актуальный возбудитель т.н. типичной пневмонии. Нередко сходную клиникорентгенологическую картину могут вызывать и другие пиогенные микроорганизмы Haemophilus influenzae, Staphylococcus aureus, ряд возбудителей семейства Enterobacteriaceae.
В противоположность этому атипичная пневмония, чаще диагностируемая у лиц молодого возраста, начинается с продромальной симптоматики простудного заболевания сухого кашля, мышечных болей, общей слабости, насморка, умеренной лихорадки; стетоакустическая картина в легких менее демонстративна, чем при типичной пневмонии; чаще (в сравнении с типичной манифестацией воспаления легких) в анализах крови регистрируется нормальное количество лейкоцитов.
В последнее десятилетие, с улучшением этиологической диагностики инфекций нижних дыхательных путей и углублением наших знаний в отношении факторов, влияющих на формирование клинической картины болезни, синдромный подход с разделением пневмонии на типичную и атипичную утратил немалое число своих сторонников. Так, в частности, эксперты Британского торакального общества, 2001 [1] и Американского торакального общества, 2001 [2] полагают, что само синдромологическое деление пневмонии на типичную и атипичную лишено особого клинического значения, предлагая при этом сохранить разделение всех потенциальных возбудителей пневмонии на типичные и атипичные или внутриклеточные (строго говоря, M.pneumoniae в равной степени может быть отнесена как к внеклеточным, так и к внутриклеточным возбудителям, поскольку является мембранотропным микроорганизмом).
Действительно, современные исследования свидетельствуют, что клинические проявления пневмонии определяются не только биологией возбудителя, но и такими факторами, как возраст больного, наличие или отсутствие сопутствующих заболеваний и т.д. В этой связи атипичная пневмония (прежде всего легионеллезная) нередко имеет проявления типичной и, напротив, пневмококковая пневмония может в части случаев характеризоваться атипичной симптоматикой. Сравнение различных проявлений типичной и атипичной пневмоний зачастую свидетельствует об отсутствии достоверных различий в частоте отдельных симптомов и признаков заболеваний, и, напротив, о значительных клинических пересечениях (табл. 1).
Впрочем, доминирующая в настоящее время точка зрения такова. Признавая очевидные трудности в предсказании этиологии заболевания на основе анализа клинических и рентгенологических данных, а значит, и условность разделения пневмоний на типичную и «атипичную», полагают, что подобный синдромный подход оправдан, особенно у лиц моложе 40 лет [4].
Микоплазменная пневмония
Воспаление легких, вызываемое M.pneumoniae, наиболее часто диагностируется у детей и лиц молодого возраста, достигая среди указанных контингентов 2030% от числа всех этиологически верифицированных внебольничных пневмоний. Напротив, в старших возрастных группах микоплазменная пневмония диагностируется, как исключение (13%). Наряду со спорадическими случаями наблюдаются и групповые (эпидемические) вспышки заболевания в основном в организованных коллективах (школьники, военнослужащие).
Микоплазменная пневмония, как правило, сопровождается ознобом, мышечными и головными болями, симптомами инфекции верхних дыхательных путей. Напротив, кровохарканье и боли в груди весьма нетипичны.
При стетоакустическом обследовании удается получить зачастую весьма скудную информацию: локально выслушиваются мелкопузырчатые хрипы или незвучная инспираторная крепитация при отсутствии укорочения (притупления) перкуторного звука. Нередко определяются шейная лимфаденопатия, полиморфные кожные сыпи, гепатоспленомегалия.
При рентгенографии органов грудной клетки обнаруживается неоднородная инфильтрация легочной ткани, локализующаяся преимущественно в нижних долях легких, причем в 1040% случаев процесс имеет двусторонний характер. Массивная очаговосливная инфильтрация, полостные образования, плевральный выпот для микоплазменной пневмонии не характерны. Нередко даже в случаях своевременно назначенной адекватной антибактериальной терапии пневмоническая инфильтрация разрешается спустя многие недели, существенно отставая от клинического выздоровления.
Известно, что M.pneumoniae инициирует выраженную поликлональную пролиферацию лимфоцитов. Именно этим обстоятельством можно объяснить многообразие внелегочных иммунологически опосредованных проявлений заболевания кожных, суставных, гематологических, гастроинтестинальных, неврологических и др. В свое время особое внимание в диагностике микоплазменной инфекции уделялось феномену высокого титра холодовых гемагглютининов с субклиническим гемолизом (положительная проба Кумбса, ретикулоцитоз). Однако, как было установлено в последующем, данная лабораторная находка не является специфичной для микоплазмоза и с разной частотой обнаруживается при цитомегаловирусной инфекции, легионеллезе, эпидемическом паротите и особенно при инфекционном мононуклеозе.
Выделение культуры Mycoplasma pneumoniae чрезвычайно трудоемкий и длительный процесс (микроорганизм растет крайне медленно, требует 714 сут., часто и гораздо более длительных сроков инкубации, а также специальных сред, содержащих все предшественники, необходимые для синтеза макромолекул, способных обеспечить микоплазмы источниками энергии) см. табл. 2.
Определение антигена микоплазмы может быть достигнуто несколькими методами. Использование поликлональной антисыворотки характеризуется очень малой специфичностью, поскольку значительное число индивидов являются здоровыми носителями инфекции. Обнаружение антигена в мокроте с использованием реакции иммуноферментного анализа (ИФА) демонстрирует вариабельную чувствительность (40–81%) и специфичность (64–100%), если при этом в качестве референс–метода рассматривается выделение культуры возбудителя. Имеющиеся в арсенале современных лабораторий коммерческие ДНК–РНК–пробы, дающие возможность идентифицировать M.pneumoniae в мазках из зева, характеризуются высокой специфичностью, но низкой чувствительностью. В настоящее время все большее внимание привлекает технология полимеразной цепной реакции (ПЦР), однако для дифференциации активной и персистирующей инфекции необходимо проведение серологических тестов.
Тест холодовой агглютинации ввиду его низкой чувствительности и специфичности в настоящее время в клинической практике не используется. Реакция связывания комплемента демонстрирует вариабельную чувствительность (5090%) и субоптимальную специфичность. Наиболее приемлемым стандартом серологической диагностики микоплазменной инфекции сегодня является ИФА с обнаружением специфических IgG и IgM. ИФА демонстрирует высокую чувствительность и специфичность 92% и 95% соответственно. Время сероконверсии, т.е. четырехкратного возрастания титра антимикоплазменных антител при последовательном исследовании проб крови, взятых в остром периоде заболевания и в периоде реконвалесценции, обычно составляет 38 недель.
Хламидийная пневмония
Каждый из трех известных в настоящее время видов хламидий способен вызывать воспаление легких: Chlamydia trachomatis отдельные случаи пневмонии у новорожденных; Chlаmydophila psittaciпоражение легких при пситтакозе (орнитозе); Chlamydophila pneumoniae весьма распространенный возбудитель пневмонии и острого бронхита у взрослых и детей. Собственно C.pneumoniae, как уже говорилось выше, и рассматривается как один из актуальных возбудителей атипичной пневмонии. Этиологический вклад Chlamydia pneumoniae в развитие внебольничной пневмонии, преимущественно у лиц молодого возраста, составляет 310%.
Клиническая картина респираторного хламидиоза, ввиду его недостаточной изученности, представляется менее определенной, нежели, например, микоплазменной инфекции. Установлено весьма распространенное бессимптомное или малосимптомное течение С.pneumoniaeинфекции. Так, при обследовании военнослужащихновобранцев было подтверждено, что только у 10% из числа лиц с серологически верифицированной активной хламидийной инфекцией обнаруживались клиникорентгенологические признаки пневмонии. Наверное, именно этот факт и объясняет значительную частоту бессимптомных серопозитивных лиц (2586%), причем с возрастом частота циркуляции антихламидийных антител в популяции возрастает. Бессимптомное назофарингеальное носительство C.pneumoniae определяется примерно у 57% обследуемых здоровых детей, что предполагает возможность передачи инфекции от человека к человеку с респираторными секретами.
Клиническая картина хламидийной пневмонии часто оказывается схожей с таковой при микоплазменной пневмонии. Лихорадка и малопродуктивный приступообразный кашель встречаются в 5080% случаев. Выраженная гиперемия зева и боли при глотании, часто сопровождаемые осиплостью голоса, наблюдаются более чем у трети больных, нередко являясь дебютными и/или наиболее демонстративными признаками заболевания.
При рентгенографии органов грудной клетки чаще визуализируется мелкоочаговая (размером 23 см), нередко многофокусная инфильтрация. Лобарная инфильтрация, образование полостей в легких и плевральный выпот нетипичны для хламидийной пневмонии. Количество лейкоцитов и лейкоцитарная формула в периферической крови обычно нормальные.
Хламидийная пневмония характеризуется, как правило, нетяжелым, но нередко затяжным течением.
Первоначально для выделения культуры C. pneumoniae использовались 67дневные куриные эмбрионы (возбудитель наиболее интенсивно размножается в эктодермальных клетках оболочки желточного мешка). Впрочем, затем выяснилось, что этот метод демонстрирует низкую чувствительность. В конечном счете выбор был сделан в пользу перевиваемой линии клеток человека (Hеlа, La 229), до того использовавшейся для выделения респираторного синцитиального вируса (табл. 3).
Определенное распространение в клинической практике получил метод иммунофлюоресценции с целью прямого обнаружения C.pneumoniae. Однако наибольшей популярностью (ввиду широкой доступности) пользуется сегодня метод серологической диагностики. Первым методом серодиагностики была реакция связывания комплемента (РСК) с использованием липополисахаридного антигена. Вероятный диагноз пситтакоза как раз и основывался на результатах этого теста. Однако при проведении РСК невозможно дифференцировать C.trachomatis,C.psittaci и C.pneumoniae. Более того, при острой C.pneumoniae–инфекции РСК оказывается положительной только в 30% случаев. В настоящее время «золотым стандартом» серологической диагностики этой инфекции является тест микроиммунофлюоресценции (МИФ). МИФ продемонстрировала высокую чувствительность и специфичность в сравнении с референс–методом диагностики (выделение культуры возбудителя). Этот метод позволяет идентифицировать специфические иммуноглобулины G, А и М.
Обычно вначале проводят определение IgG, предваряя этим тестом определение IgM. Таким образом, исключается ложноположительное определение IgM в случаях наличия ревматоидного фактора, особенно у пожилых пациентов. Свидетельствами активной хламидийной инфекции являются четырехкратное нарастание титров IgG или IgA в парных сыворотках крови, взятых с 24недельным интервалом в остром периоде заболевания и в периоде реконвалесценции, или однократно определяемый высокий титр антихламидийных антител (например, IgG>=1:512).
В настоящее время активно обсуждается перспектива клинического применения ПЦР в диагностике хламидийной инфекции. Однако относительная сложность в проведении и высокая цена сдерживают масштабное распространение этой диагностической технологии. Впрочем, ПЦР позволяет осуществить быструю диагностику, что может в части случаев оказаться полезным в плане выбора соответствующей антимикробной химиотерапии.
Легионеллезная пневмония
Легионеллезная пневмония (болезнь легионеров) вызывается грамотрицательной палочкойLegionella pneumophila. Спорадическая заболеваемость колеблется от 1,5% до 10% среди всех этиологически верифицированных пневмоний. Эпидемическая заболеваемость связывается с контаминацией возбудителем водных систем и чаще наблюдается в больших зданиях (гостиницы, больницы). Важно отметить, что легионеллезная пневмония наиболее актуальна для лиц среднего и пожилого возраста и практически не встречается у детей.
Клинический дебют болезни характеризуется появлением в первые дни немотивированной общей слабости, анорексии, заторможенности, упорных головных болей. Симптомы поражения верхних дыхательных путей, как правило, отсутствуют. После непродолжительного продромального периода появляются кашель, обычно непродуктивный, фебрильная лихорадка и одышка. Кровохарканье и плеврогенные боли в груди наблюдаются с одинаковой частотой у каждого третьего больного. В первых публикациях, посвященных ォболезни легионеровサ (как правило, при описании эпидемических вспышек), в качестве нередкого дебютного признака болезни упоминалась диарея. В настоящее время, однако, этот признак, скорее, относят к категории экзотических, особенно при спорадической заболеваемости. Нередко весьма демонстративны неврологические расстройства заторможенность, дезориентация, галлюцинации, периферическая нейропатия.
Физическая симптоматика легионеллезной пневмонии, как правило, убедительна: локальная крепитация, признаки консолидации легочной ткани (бронхиальное дыхание, укорочение перкуторного звука). Рентгенологические данные неспецифичны визуализируется очаговая пневмоническая инфильтрация, локализующаяся обычно в пределах одной доли легких. Нередко одновременно обнаруживается и ограниченный плевральный выпот и, напротив, нечасто, обычно на поздних стадиях болезни, формируются полостные образования в легких. Процесс нормализации рентгеновской картины занимает обычно длительное время, иногда несколько месяцев.
Данные лабораторных исследований, хотя и несут неспецифическую информацию, но, указывая на полисистемность поражения, могут быть использованы, как определенный диагностический критерий. Так, в анализах мочи определяется гематурия и протеинурия; в крови часто выявляются повышенная активность щелочной фосфатазы, креатинфосфокиназы, аминотрансфераз, гипербилирубинемия. В клинической гемограмме обнаруживаются лейкоцитоз с нейтрофилезом и абсолютная лимфопения, значительное увеличение СОЭ.
L.pneumophila чрезвычайно трудный для культивирования микроорганизм (табл. 4). Метод выделения культуры возбудителя демонстрирует широкий диапазон чувствительности от 11 до 80% (в сравнении с детекцией антигена).
Тест прямой иммунофлюоресценции наиболее популярен в клинической практике. Он очень быстр в выполнении, но его чувствительность вариабельна и относительно невысока (18–75%). Чувствительность прямой иммунофлюоресценции возрастает до 80%, если этот метод подкрепляется культуральным или если респираторные секреты (трахеальный аспират или жидкость бронхоальвеолярного лаважа) предварительно обработаны. Специфичность теста может достигать 94%. Спустя 4–6 дней после начала адекватной антибактериальной терапии определение антигена становится невозможным.
Антиген L.pneumophila может быть также обнаружен в моче радиоиммунологически, с использованием ИФА или в реакции латексной агглютинации. Однако следует иметь в виду, что легионеллезный антиген может персистировать в течение многих месяцев после выздоровления, а ИФА пригоден только для идентификации L.pneumophila, 1й серогруппы.
Наиболее популярная сегодня диагностика легионеллеза предполагает идентификацию специфических антител непрямая иммунофлюоресценция, ИФА и микроагглютинация. В типичных случаях сероконверсия (четырехкратное нарастание титра специфических антител) наблюдается через 48 недель, однако у лиц старших возрастных групп этот временной интервал может достигать 14 недель. Следует также учитывать тот факт, что 2030% пациентов, переносящих острую легионеллезную инфекцию, не демонстрируют нарастания титра антител. ИФА характеризуется высокой специфичностью (95%) и приемлемой чувствительностью (85%) при определении специфических IgG и IgM. Описываются отдельные наблюдения перекрестных реакций сPseudomonas aeruginosa, Chlamydia/Chlamydophila spp., Mycoplasma pneumoniae и Campylobacter spp.
Лечение атипичной пневмонии
Очевидно, что у больных с атипичной пневмонией диагностические проблемы преобладают над лечебными. Диагностировать в повседневной клинической практике микоплазменную, хламидийную или легионеллезную инфекции нижних дыхательных путей в остром периоде заболевания практически невозможно (исключение составляет определение антигена L.pneumophila в моче c использованием ИФА). Что же касается серологических методов исследования, то это не актуальный, а эпидемиологический (ретроспективный) уровень диагностики. Иными словами, заподозрить одну из упомянутых инфекций можно лишь, ориентируясь на известное клиническое своеобразие (ォатипизмサ) болезни и отдельные детали эпидемиологического анамнеза. Утвердившись в атипичном (с клинических позиций) течении пневмонии и предприняв доступные усилия для ее последующей этиологической верификации, следует без промедления начать адекватную антимикробную химиотерапию (рис. 1).

Рис. 1. Алгоритм эмпирической антибактериальной терапии нетяжелой внебольничной пневмонии (по A.Ortqvist, 2002 [4], с изменениями)
Перечень антибиотиков, подходящих для лечения обсуждаемых инфекций (напомним, что они являются внутриклеточными), хорошо известен. Это антибактериальные препараты, характеризующиеся высокой липофильностью, легко проникающие через клеточную стенку и создающие высокие внутриклеточные концентрации, существенно превосходящие минимальные подавляющие концентрации актуальных возбудителей атипичной пневмонии. К их числу относятсямакролиды, тетрациклины (доксициклин), фторхинолоны и рифампицин (табл. 5). С учетом особенностей спектра антимикробной активности, удачного фармакокинетического профиля и накопленного клинического опыта макролиды рассматриваются, как препараты выбора при «атипичной» пневмонии. Еще одной привлекательной стороной макролидов (например, по сравнению с тетрациклинами) является их профиль безопасности, а при лечении новорожденных, детей, кормящих матерей и беременных альтернативы макролидам нет.
При нетяжелом течении атипичной пневмонии (вероятнее всего, микоплазменной или хламидийной этиологии) макролиды следует назначать внутрь в среднетерапевтических дозах – эритромицин по 250–500 мг каждые 6 часов; кларитромицин по 250 мг каждые 12 часов; азитромицин по 500 мг 1 раз в день в течение 3–х дней или по 250 мг 2 раза в день в 1–й день и по 250 мг 1 раз в день со 2–го по 5–й дни.
При тяжелом течении атипичной пневмонии (как правило, легионеллезной этиологии) макролиды вначале назначаются внутривенно в высоких дозах (эритромицин до 4,0 г в сутки), а затем переходят на оральный прием антибиотика. Весьма популярна комбинированная терапия легионеллезной пневмонии эритромицином и рифампицином, хотя роль последнего в данном случае окончательно не установлена. Эффективны при лечении болезни легионеров и другие макролиды, в т.ч. имеющие лекарственные формы для парентерального введения спирамицин, кларитромицин и др.
В последние годы была показана и высокая клиническая эффективность новых фторхинолонов в лечении легионеллезной пневмонии (левофлоксацин, 500 мг один раз в сутки в течение 1014 дней) [8].
Продолжительность антибактериальной терапии атипичной пневмонии составляет не менее 2-3х недель; минимизация сроков лечения несет в себе реальный риск рецидива инфекции. При этом следует еще раз напомнить, что зачастую клиническое выздоровление при микоплазменной, хламидийной или легионеллезной инфекциях нижних дыхательных путей существенно опережает более позднее рентгенологическое, которое порой затягивается на многие недели или даже месяцы.
Острый бронхит. Современные аспекты этиологии, патогенеза. Классификация. Особенности клиники, диагностические обследования. Патогенетические аспекты терапии, критерии эффективности. Профилактика.
Острым бронхитом называется воспалительное заболевание бронхов, вызываемое различными инфекционными агентами и некоторыми неинфекционными факторами, клинически проявляющееся остро возникшей респираторной симптоматикой, чаще всего — кашлем и одышкой, при отсутствии в анамнезе легочного заболевания.
Патогенез. При остром бронхите различают две стадии развития заболевания. Первая фаза носит название реактивно-гиперемической, или нервно-рефлекторной. Во время этой фазы в результате воздействия патогенных факторов рефлекторно возникают патологические сосудистые рефлексы , которые приводят к нарушения кровообращения в стенке бронха и развитию активной венозной гиперемии его слизистой оболочки. Вследствие венозного стаза увеличивается выделение слизи, снижается барьерная роль реснитчатого эпителия, нарушается моторная и эвакуаторная функция бронхов. Вторая фаза развития острого бронхита – инфекционная, обусловлена воздействием патогенных микроорганизмов. Патоморфология. Для острого бронхита чаще всего характерно катаральное воспаление слизистой оболочки бронхов, которое проявляется ее гиперемией и отеком вследствие расширения сосудов и переполнения их кровью. Поверхность слизистой оболочки бронхов покрыта серозным, слизистым и или слизисто-гнойным экссудатом. В клетках ресничного эпителия возникают дегенеративные процессы, происходит его метаплазия – превращение в ороговевающий многослойный сквамозный эпителий. Повышенная секреция слизи бокаловидными клетками приводит к нарушению проходимости мелких бронхов и бронхиол, при полной их закупорке возникают ателектазы соответствующих участков легкого, при наличии вентильного механизма появляется эмфизема. В зависимости от характера воспалительного процесса острые бронхиты делят на катаральные, слизистые, слизисто-гнойные, гнилостные, фибринозные, геморрагические и некротические, обычно встречаются первые три формы. При легких формах острого бронхита после выздоровления слизистая оболочка бронхов полностью восстанавливается. При тяжелых формах воспалительный процесс может захватывать все слои стенки, особенно в области бронхиол и мелких бронхов. В ряду случаев воспаление распространяется на паренхиму легкого и возникает острая пневмония (бронхопневмония). Источником развития острой пневмонии могут быть также инфицированные мелкие ателектазы.
Классификация острого бронхита
Острый бронхит в зависимости от этиологии бывает:
Инфекционного происхождения (вирусный, бактериальный, вирусно-бактериальный);
Обусловленный ингаляционным воздействием химических факторов;
Смешанного происхождения (например, вследствие сочетания химических факторов с инфекцией).
По патогенезу бронхиты делятся на:
Первичные бронхиты — самостоятельное заболевание;
Вторичные бронхиты — осложняют другие патологические процессы.
Взависимости от уровня поражения трахеобронхиального дерева различают:
Трахеобронхиты;
Бронхиты с подавляющим поражением бронхов среднего калибра;
Бронхиолиты.
По характеру воспалительного процесса различают:
Катаральный бронхит;
Гнойный бронхит.
В зависимости от типа функциональных нарушений легочной вентиляции острый бронхит бывает:
Необструктивный (без признаков нарушения легочной вентиляции) с относительно благоприятным течением;
Обструктивный (с легочной недостаточностью по обструктивному типу), сопровождающийся вовлечением в патологический процесс мелких бронхов и бронхиол; имеет преимущественно затяжное и рецидивирующее течение.
Кроме бронхита с типичным течением, который завершается выздоровлением в течение 2—3 нед, различают также затяжной (до 2 мес) и рецидивирующий (симптоматика возникает три и более раза на протяжении года) бронхиты.
Клиническая картина острого бронхита включает два основных синдрома: интоксикационный и мукоцилиарной недостаточности. В первые 2—3 сут заболевания температура тела повышается до 37—38,5 °С, иногда остается нормальной. Типичными являются признаки обшей интоксикации: нарушение самочувствия, недомогание, слабость, озноб, артралгии, боль в спине и конечностях, в редких случаях — за грудиной. Одновременно может быть боль в горле при глотании, осиплость голоса. Основной симптом мукоцилиарной недостаточности — кашель, который держится на протяжении всей болезни. Кашель в начале заболевания сухой и болезненный. Он возникает в результате раздражения чувствительных нервных окончаний при воспалительном поражении рефлексогенных зон слизистой оболочки трахеи и бронхов. Спустя несколько суток кашель становится мягким и влажным, начинается выделение мокроты слизистого или слизисто-гнойного характера. Появление одышки свидетельствует о присоединении бронхиальной обструкции, обусловленной вовлечением в патологический процесс мелких бронхов. Чаще всего это бывает при бронхиолите. При пальпации грудной клетки можно выявить некоторую болезненность между ребрами и над проекцией прикрепления диафрагмы к грудной клетке. Перкуторно над легкими чаще всего определяется легочный звук. Тимпани- ческий оттенок перкуторного звука свидетельствует о поражении мелких бронхов и бронхиол с возникновением острой эмфиземы легких. Аускульта- ция выявляет жесткое везикулярное дыхание и, в зависимости от характера мокроты (жидкая или вязкая), вовлечения в процесс крупных или мелких бронхов, — влажные или сухие рассеянные хрипы. При воспалении бронхов крупного и среднего калибра, наличии в них вязкого секрета выслушиваются сухие хрипы низкого тембра — жужжащие хрипы. Воспаление бронхов мелкого калибра с отеком слизистой оболочки, сужением их просвета, наличием вязкого секрета обусловливает возникновение сухих хрипов высокого тембра — свистящих хрипов. Больной при обструктивном бронхите или бронхиолите может чувствовать одышку при выполнении обычной для него физической нагрузки или даже в состоянии покоя. В этом случае появляется цианоз видимых слизистых оболочек, сухие хрипы в виде "свистящего дыхания" выслушиваются дистанционно.
Диагностические критерии острого бронхита.
I. Анамнестические: заболевание в большинстве случаев развивается после острых респираторных вирусных инфекций.
II. Клинические:
Респираторный синдром: гиперемия слизистой оболочки ротоглотки, ринит, кашель, вначале сухой, постепенно становится влажным, мокрота отделяется легко, имеет слизистый, реже слизисто-гнойный характер (при бактериальном характере воспалительного процесса).
Синдром дыхательной недостаточности отсутствует или выражен умеренно на высоте воспалительного процесса.
Бронхолегочный синдром: неизмененный перкуторный звук или коробочный оттенок; жесткое дыхание, сухие, крупно- и среднепузырчатые влажные хрипы, выслушиваемые с обеих сторон на вдохе, количество которых изменяется при кашле, иногда выслушиваются единичные мелкопузырчаты двухсторонние влажные хрипы.
Симптомы интоксикации: в виде снижения эмоционального статуса (капризность, негативные реакции), легкой бледности кожи. Температура может быть нормальной или субфеброильной. Длительность лихорадки не превышает 2-3 дней, но при микоплазменной и аденовирусной инфекции может сохраняться до 8-10 дней.
III. Параклинические:
Рентгенограмма легких (исследование проводится не всем детям: при подозрении на пневмонию, инородное тело и др.): усиленный легочный рисунок при отсутствии очаговых теней, малоструктурность корней легких;
Анализ крови: нормальное или незначительное увеличение количества лейкоцитов, но может быть и лейкопения, лимфоцитоз, моноцитоз (относительный), СОЭ не изменена у большинства больных.
Основные цели лечения острого бронхита: • устранение симптомов поражения дыхательных путей в максимально короткие сроки; • уменьшение степени выраженности симптомов интоксикации; • предупреждение развития осложнений. Лечение в большинстве случаев проводится в амбулаторных условиях. Рекомендуется обильное питье, горячие ножные ванны. Фармакотерапия В большинстве случаев показано симптоматическое лечение, основная роль в котором принадлежит противокашлевым средствам. Бронхолитические, муколитические, противомикробные лекарственные средства применяются по показаниям. Назначают также комбинированные лекарственные средства, в состав которых входят противокашлевые, муколитические, бронхолитические, противомикробные и сосудосуживающие лекарственные средства в различных сочетаниях.
Принципы и характер лечебных мероприятий при острых бронхитах определяются ведущими клиническими синдромами: наличием гипертермии, судорог, токсикоза, бронхиальной обструкции, дыхательной недостаточности. В терапии острых бронхитов используют:
• симптоматическое лечение, в т. Ч. Местное (снижение температуры тела, лечение ринита, облегчение горла и т. Д.); • противовирусные и антибактериальные средства (по строгим показаниям); • муколитики, отхаркивающие и противокашлевые средства; • антигистаминные препараты (только при наличии аллергических проявлений); • противовоспалительные средства (особенно при крупе, бронхообструктивном синдроме); • немедикаментозные методы; • средства иммунокоррекции (по необходимости).
Противовирусная терапия может включать:
• химические средства – арбидол, римантадин, амиксин (у детей старше 7 лет); • интерфероны и их индукторы – лейкоцитарный интерферон, рекомбинантный интерферон (виферон), циклоферон и неовир.
Показано, что эффективность профилактического назначения арбидола существенно возрастает при его сочетании с селен-активом, т. К. При этом одновременно осуществляется воздействие не только на иммунный, но и на метаболический статус организма. Не осложнённые бактериальной инфекцией бронхиты не требуют антибактериальной терапии! Антибактериальная терапия показана только при бронхитах, осложнённых бактериальной инфекцией (наличие соответствующей клинической картины и гематологических сдвигов, обусловленных бактериальной или атипичной флорой). При наличии показаний к назначению системного антибиотика выбор стартового препарата осуществляют эмпирически с учётом вероятной этиологии и лекарственной чувствительности предполагаемого возбудителя. При этом всегда предпочтительна монотерапия пероральным лекарственным препаратом. Правильность выбора антибиотика подтверждается быстрой положительной клинической динамикой. При отсутствии таковой в течение 2-х дней решают вопрос о смене антибиотика или используют комбинацию препаратов для расширения антибактериального спектра. В настоящее время в качестве антибактериальных препаратов первого выбора наиболее широко в амбулаторной практике при лечении бронхитов используют три группы антибиотиков, так называемые препараты «золотого стандарта»: бета-лактамные антибиотики (ингибиторозащищенные пенициллины, цефалоспорины II–III поколения) и макролиды. Для создания комбинированных «защищённых» препаратов наиболее часто используется сочетание амоксициллина и клавуланата. Добавление ингибитора b-лактамаз (клавулановой кислоты) к амоксициллину значительно повышает эффективность антибактериальной терапии, поскольку клавулановая кислота не только связывается с b-лактамазами, но и препятствует выработке этих энзимов. Наиболее эффективны новые формы этого антибиотика с повышенным содержанием амоксициллина и уменьшенным содержанием клавулановой кислоты – 7 : 1 (таблетки, содержащие 875 мг амоксициллина и 125 мг клавуланата; суспензии, содержащие 400 мг амоксициллина и 57 мг клавуланата или 200 мг амоксициллина и 29 мг клавуланата в 5 мл). Таким образом, преодолевается основной негативный эффект амоксициллин/клавуланата – диарейный синдром, связанный с побочными эффектами клавулановой кислоты. Эффективность двукратных режимов дозирования препарата не уступает приёму амоксициллин/клавуланата 3 раза в сутки. Цефалоспорины имеют широкое применение в клинической практике благодаря высокой эффективности и низкой токсичности. Цефаклор и цефуроксим аксетил являются самыми распространёнными в мире цефалоспоринами II поколения для приёма внутрь и в настоящее время считаются эталонными пероральными препаратами для лечения инфекций дыхательных путей. Пероральные цефалоспорины III поколения (цефексим, цефтибутен) широко используются в терапии бронхитов средней тяжести. Для лечения тяжёлых форм бронхитов используются парентеральные цефалоспорины III поколения (цефотаксим, цефтриаксон, цефтазидим). Несомненным преимуществом цефтриаксона является его уникальная фармакокинетика, что позволяет применять этот препарат 1 раз в сутки. Кроме того, при парентеральном введении цефтриаксон прекрасно проникает в лёгочную ткань, где бактерицидные концентрации в отношении чувствительных респираторных патогенов сохраняются в течение 23–53 часов. Эмпирическая антибиотикотерапия инфекций нижних дыхательных путей в большинстве случаев может быть успешна при использовании бета-лактамных антибиотиков. Неэффективность стартовой терапии бета-лактамами может свидетельствовать как о резистентности микрофлоры, так и об атипичной этиологии бронхита. В этом случае показано назначение макролидов. Макролиды также используются в качестве альтернативных при неэффективности или непереносимости бета-лактамных антибиотиков. Высокая эффективность использования макролидных антибиотиков в терапии бронхитов связана со спектром их антимикробной активности, включающим большинство респираторных патогенов, в том числе и атипичных возбудителей (хламидии, микоплазмы), устойчивостью к b-лактамазам, а также со способностью создавать в очагах воспаления высокие концентрации, превышающие таковые в сыворотке крови. Практически ценным является то, что макролиды относятся к препаратам с минимальным количеством нежелательных реакций. Низкая токсичность макролидов позволяет использовать их в педиатрии для лечения детей всех возрастных групп.Они высокоэффективны при пероральном применении. Кларитромицин, по сравнению с другими макролидами, проявляет наилучший эффект в отношении стрептококков, золотистого стафилококка, легионелл, хламидий. Основной метаболит кларитромицина – 14-гидроксикларитромицин также обладает антимикробной активностью, синергидной с основным препаратом. Азитромицин – единственный антибиотик-макролид, имеющий клинически значимую активность против Н. Influenzae. Азитромицин также превосходит другие макролиды по действию на Мoraxella catarrhalis, Neisseria spp. Спирамицин активен против ряда пневмококков и b-гемолитических стрептококков группы А, резистентных к 14- и 15-членным макролидам. После приёма внутрь антибиотики-макролиды частично разрушаются под действием соляной кислоты. Основное всасывание макролидов происходит в тонком кишечнике. Применение препаратов в виде капсул или гранул с энтерорастворимым покрытием, а также приём антибиотиков за 1 час до или через 2–3 часа после еды существенно повышают их биодоступность.Несомненным достоинством макролидов является их способность создавать высокие и стабильные концентрации в тканях, превышающие уровень препаратов в сыворотке крови. Тканевые концентрации джозамицина, кларитромицина, азитромицина в 10–100 раз выше плазменных, что обусловливает наибольшую эффективность этих препаратов против внутриклеточных возбудителей. Концентрации антибиотиков, создаваемые в лёгочной паренхиме, бронхах, бронхиальном секрете во много раз превышают минимальные подавляющие концентрации для чувствительных микроорганизмов. Высокая тропность макролидов к лёгочной ткани обусловливает эффективность их применения в терапии бронхолёгочных заболеваний. В отличие от многих других антибиотиков, кларитромицин, джозамицин, азитромицин способны проникать в фагоцитирующие клетки и транспортироваться в очаг воспаления. Концентрации этих антибиотиков в тканях длительно сохраняются на терапевтическом уровне в результате медленного их высвобождения из клеток. Установлено, что эти препараты также обладают иммуностимулирующими свойствами. В частности, они повышают фагоцитарную активность и дегрануляцию фагоцитов, активность Т-киллеров, что оказывает дополнительный эффект при лечении инфекций дыхательных путей. Особое место в лечении бронхитов занимают азитромицин и кларитромицин с замедленным высвобождением. Уникальная фармакокинетика и фармакодинамика (высокая биодоступность, низкое связывание с белками сыворотки, способность создавать в тканях концентрации, значительно превышающие сывороточные, длительный период полувыведения и постантибиотический эффект), удобный режим дозирования (1 раз в сутки), хорошая переносимость (при таком режиме дозирования реже отмечаются гастроинтестинальные нарушения) обеспечивают их высокую клиническую эффективность и комплаентность. При среднетяжёлом и, особенно, при тяжёлом течении бронхита хорошо зарекомендовал себя метод «последовательной» (sequential therapy) или «ступенчатой» (step-down therapy) терапии. При использовании этого режима лечение начинается с парентерального введения антибиотика. При достижении клинического эффекта (обычно через 3–5 суток), когда парентеральная терапия обеспечила улучшение состояния больного, возможен переход на пероральный приём антибиотика. Такая пошаговая терапия осуществляется одним и тем же антибиотиком (например, цефуроксим парентерально – цефуроксим аксетил перорально, амоксициллин/клавуланат парентерально – перорально) или разными антибиотиками (например, цефотаксим или цефтриаксон парентерально – цефуроксим аксетил, цефтибутен или цефиксим перорально). Преимуществом кларитромицина и спирамицина является наличие двух лекарственных форм (для внутривенного введения и приёма внутрь), что позволяет применять эти препараты в режиме ступенчатой терапии при тяжёлом течении бронхита у госпитализированных больных. Если на фоне терапии состояние улучшилось, снизилась температура, исчезли симптомы интоксикации, появился аппетит, значит, выбор антибиотика был сделан правильно и лечение следует продолжить. Длительность антибактериального лечения, как правило, составляет от 5 до 10 дней. Если улучшения нет или оно незначительно, следует сменить антибиотик. Показаниями для смены препарата или подключения второго препарата (как правило, речь идет о сочетании макролидного антибиотика с цефалоспорином III поколения) является клиническая неэффективность терапии (сохранение лихорадки, дыхательной недостаточности, интоксикации, развитие осложнений). При этом коррекцию терапии следует осуществлять уже с учётом результатов микробиологического исследования мокроты. При бронхообструктивном синдроме используют ингаляции бронхолитиков (беродуал, сальбутамол) через небулайзер, по тяжести состояния – добавляют ингаляции суспензии будесонида (Пульмикорт®) или преднизолон (в/в, в/м, внутрь). Для борьбы с кашлем (если это необходимо) используют: противокашлевые препараты центрального действия (наркотические – кодеинсодержащие и ненаркотические – бутамират, глауцина гидрохлорид, окселадина цитрат), а также периферического (либексин, левопронт) действия. Муколитики и отхаркивающие средства Течение респираторных инфекций, как правило, сопровождается нарушением образования, изменением состава и вязкости бронхиальной слизи. Для улучшения реологических свойств секрета, активации механизмов эвакуации мокроты существует большое количество разнообразных муколитических и отхаркивающих средств. Муколитики (мукоактивные препараты прямого действия) – тиолики. Разжижают мокроту за счёт деполимеризации макромолекул секрета вследствие разрыва дисульфидных связей. Оказывают отхаркивающее, секретомоторное, муколитическое, противокашлевое и антиоксидантное действие, стимулируют выработку сурфактанта. Широко известный препарат этой группы: N-Ацетилцистеин (АЦЦ и др.). Секретолитики (мукоактивные препараты непрямого действия) – Бромгексин и Амброксол – производные алкалоида вазицина. Снижают адгезию секрета, деполимеризуют мукопротеиновые и мукополисахаридовые волокна секрета. Оказывают секретолитический, секретомоторный и противокашлевой эффект. Мукорегуляторы (мукоактивные препараты непрямого действия) – Карбоцистеин (Флюдитек®) – производные карбоцистеина. Регулируют выработку секрета железистыми клетками. Нормализуют реологические параметры секрета, ускоряют мукоцилиарный транспорт, оказывают противовоспалительное действие. Традиционные отхаркивающие средства рефлекторного действия активируют гастро-пульмональный мукокинетический рефлекс и тем самым усиливают перистальтику бронхиальной мускулатуры, работу мерцательного эпителия, секрецию бронхиальных желез. В эту группу входят отхаркивающие препараты растительного происхождения. Использование отхаркивающих средств рефлекторного действия внутрь необходимо сопровождать обильным питьем. При острых воспалительных процессах в дыхательных путях это наиболее эффективно. Традиционные отхаркивающие средства на основе глицеринового эфира гвиакола (Гвайфенезин) повышают эффективность кашлевого рефлекса и одновременно улучшают колебания ресничек мерцательного эпителия, в связи с чем ускоряют мукоцилиарный транспорт и оказывают разжижающий эффект. Другие традиционные отхаркивающие средства (резорбтивного действия, мукогидратанты, бронхорроики) стимулируют бронхиальные железы и/или гидратируют секрет, разжижают мокроту. Комбинированные препараты в последнее время довольно популярны и могут включать различные отхаркивающие, противокашлевые, спазмолитические и другие средства. Однако следует иметь в виду, что их назначение требует индивидуального подхода, а сочетания препаратов в них не всегда рациональны. Одним из примеров удачного сочетания компонентов в комбинированном препарате является сироп Аскорил®. Принципы назначения отхаркивающих и мукоактивных средств :
• При использовании большинства отхаркивающих средств лечебный эффект обычно наступает не сразу, а на 2–4-й день лечения. Их эффективность вариабельна и определяется характером и тяжестью бронхолёгочной патологии, индивидуальными особенностями больного ребёнка. • Наличие бронхиальной обструкции всегда ухудшает эвакуацию мокроты. Поэтому при клинических и функциональных признаках нарушений бронхиальной проходимости необходимо сочетанное назначение отхаркивающих средств с бронхолитиками, обязательное увлажнение дыхательных путей. • Использование атропиноподобных и антигистаминных (I поколения) средств при кашле нецелесообразно, так как обладает «подсушивающим» слизистую оболочку эффектом, сгущает мокроту и затрудняет её эвакуацию. Комбинация отхаркивающих средств с седативными и противокашлевыми препаратами у детей также часто нерациональна. • Для эффективной эвакуации мокроты в комплексе лечения целесообразно использовать ингаляции, постуральный и вибрационный массаж. • Применение отхаркивающих средств должно сочетаться с назначением обильного питья (минеральная вода, чай, компот, морс, отвар сухофруктов и т. Д.). Адекватная гидратация совершенно необходима для эффективного разжижения и эвакуации мокроты. • Иногда при назначении отхаркивающих препаратов происходит непредсказуемо резкое снижение вязкости и значительное увеличение количества отделяемой мокроты, что приводит к ухудшению бронхиальной проходимости. Клинически это проявляется усилением кашля, одышки, ухудшением общего состояния. В этих случаях необходима отмена или снижение дозы отхаркивающих средств. • У детей раннего возраста, а также при выраженном рвотном рефлексе и высоком риске аспирации противопоказаны отхаркивающие препараты, увеличивающие объём секрета, а также усиливающие рвотный и кашлевой рефлексы.
Выбор того или иного мукоактивного средства или их сочетаний должен определяться индивидуальными особенностями больного, характером заболевания, выраженностью кашля, экссудации, характером мокроты и опираться на знания механизмов действия и фармакокинетики лекарственных препаратов. В последнее время всё чаще в терапии ОРЗ используют противовоспалительные средства – с целью уменьшения выраженности воспалительной реакции и сокращения сроков болезни. Широкое распространение получил фенспирид, целесообразность применения которого подтверждается рядом фармакоэкономических исследований. Немедикаментозная терапия, как правило, подключается в комплекс лечения по мере улучшения состояния ребёнка:
• массаж, лечебная физкультура; • физиолечение (в настоящее время имеет ограниченное применение); • тепловые и отвлекающие процедуры (с осторожностью, после стойкой нормализации температуры); • витамины (желательно поливитамины) в комплексе с микроэлементами. В периоде реконвалесценции, особенно часто болеющим детям, рекомендуют назначать адаптогены природного происхождения.
Критерии выздоровления – исчезновение клинических признаков острого бронхита, нормализация лабораторных данных и показателей функции внешнего дыхания. Для полноты суждения о разрешении острого бронхита желательно бронхоскопическое исследование с биопсией и цитологическим исследованием биоптата. Его изучение необходимо у больных с острым рецидивирующим бронхитом, у лиц с затяжным течением заболевания и курящих.
Критерии хронизации острого бронхита. Вопрос о хронизации любого острого процесса в легких можно решить в течение 1 года, иногда 2. В клиническом плане говорить о формировании хронического бронхита можно, если больной кашляет 3 месяца в году на протяжении 2 лет.
Экспертиза трудоспособности. Нетрудоспособность больных с острым бронхитом составляет обычно 7—14 дней. При астматическом бронхите и бронхиолите она может увеличиваться до 4–6 недель.
Профилактика Выздоровление от любой респираторной вирусной инфекции всегда связано с активацией иммунных реакций и формированием иммунитета к возбудителю. Однако в силу высокого разнообразия этиологических агентов, защиты от ОРВИ в дальнейшем это не обеспечивает. Профилактическая вакцинация имеет ограниченное значение. До настоящего времени отношение к ней остаётся неоднозначным. Профилактика связана в основном с предотвращением контактов в эпидемический сезон, закаливанием, а также применением препаратов интерферона и других средств, повышающих неспецифическую резистентность организма, что в последнее время приобретает всё большую популярность. При частых, повторных бронхитах большое значение приобретает выяснение лежащей в основе причины и организация полноценной дифференцированной комплексной реабилитации таких детей [6]. Для профилактики инфекций, вызванных такими возбудителями, как S. Pneumoniae, H. Influenzae, в последнее появились вакцины «Пневмо 23» и «Акт-ХИБ», клиническая целесообразность широкого применения которых обсуждается.
Хронический бронхит (обструктивный и необструктивный) . Этиология, патогенез. Классификация, критерии диагностики, необходимый минимум диагностических обследований. Лечение хронического бронхита. Критерии эффективного контроля заболевания. Диспансеризация больных. Профилактика. Экспертиза нетрудоспособности.
Хронический бронхит – самостоятельное заболевание (протекающее с обострениями и ремиссиями), характеризующееся диффузным поражением дыхательных путей с чрезмерной секрецией слизи в бронхиальном дереве. Так как количество бронхиального секрета невозможно точно измерить, в настоящее время принят клинический критерий заболевания –хронический или рецидивирующий кашель до 3 месяцев на протяжении 2–х лет подряд с выделением мокроты, который нельзя отнести к другим заболеваниям. Последнее подразумевает определение хронического бронхита методом исключения в связи с неспецифичностью его клинических проявлений.
Этиология и патогенез
Основной причиной хронического бронхита является длительное воздействие на слизистую оболочку бронха вредных примесей к вдыхаемому воздуху, в первую очередь, табачного дыма. Существенное значение имеют производственные факторы (запыленность и загазованность рабочих мест), а также общая загрязненность воздушного бассейна. Большую роль в развитии хронического бронхита играет патология ЛОР–органов, возможно, являющаяся проявлением общей пораженности респираторного тракта, и нарушение кондиционирующей функции носового дыхания. Вышеперечисленные факторы приводят к перестройке слизистой оболочки, заключающейся в гипертрофии слизистых желез и увеличении числа слизепродуцирующих клеток бронхиального эпителия, постепенно замещающих ресничные клетки, ответственные за эвакуацию слизи и механическое очищение бронхов от пылевого и микробного загрязнения. Одновременно с гиперсекрецией слизи (гиперкриния) происходит нарушение физико–химических (вязкость, эластичность) и антимикробных свойств (дискриния). Это ведет к застою слизи вместе с содержащимися в ней загрязнениями, обусловливает необходимость ее эвакуации с помощью патологического процесса – кашля и способствует вторичному развитию внутрибронхиальной инфекции, главными возбудителями которой являются пневмотропные микроорганизмы – стрептококк и гемофильная палочка. Внутрибронхиальная инфекция обычно течет с периодическими обострениями, причинамикоторых бывают неблагоприятные погодные условия, охлаждение, заражение вирусной инфекцией. Нарушение защитно–очистительных функций бронхов и персистирование в них инфекции определяют повышенную вероятность развития в легочной ткани инфекционных процессов (острых пневмоний, деструктивных пневмоний), которые у больныххроническим бронхитом наблюдаются в несколько раз чаще, чем у лиц без предшествующей патологии бронхов, и нередко характеризуются затяжным и осложненным течением. У части больных хроническим бронхитом наблюдается прогрессирующее нарушение проходимости преимущественно мелких бронхов. Важную роль в этом играют экспираторный коллапс мелких дыхательных путей, спазм бронхиальной мускулатуры, отек слизистой и другие факторы. В результате обструкции происходит нарушение вентиляционно–перфузионных отношений и развитие гипоксемии. Это, в свою очередь, обусловливает спазм легочных артериол, повышение легочного сосудистого сопротивления, гипертензию и формирование «легочного сердца». Таким образом, обструкция мелких бронхов приводит к дыхательной и сердечной недостаточности, что является причиной инвалидизации и смерти больных. В большинстве случаев обструктивный бронхит сопровождается эмфиземой, усугубляющей функциональные расстройства.
Довольно распространенная классификация, в которой выделялись хронический простой, обструктивный, гнойный и гнойно-обструктивный варианты за последние годы претерпела изменения и на первый план вышло разделение
бронхитов по наличию обструкции, так как от этого фактора в первую очередь зависят тяжесть и прогноз заболевания. Более того, хронический обструктивный бронхит (ХОБ) часто стал подменяться термином ХОБЛ, что не вполне верно. Конечно, наиболее частой причиной ХОБЛ является ХОБ (1), но дело в том, что ХОБЛ кумулятивное понятие, отражающее состояние с медленно и необратимо прогрессирующей обструкцией дыхательных путей, в основе которой лежит не только воспаление и склероз, свойственные для бронхита, но и деструкция ацинарной ткани с потерей эластических свойств легких, что
характерно для эмфиземы. ХОБЛ является собирательным понятием и объединяет в себе такие заболевания как: хронический обструктивный бронхит, эмфизему легких и бронхиальную астму тяжелого течения. Видимо, более верно говорить
о том, что ХОБЛ является заключительным этапом любой обструктивной патологии. Именно поэтому выделение ХОБ имеет важное значение,позволяя при ранней диагностике проводить адекватную терапию, направленную на устранение обратимого компонента бронхиальной обструкции). В связи с этим, при формулировке диагноза в тех ситуациях, когда можно выделить
нозологическую принадлежность заболевания (что характерно для ХОБЛ легкой и средней степени тяжести), термин ХОБЛ следует опустить и ограничиться указанием нозологии, степени тяжести, фазы заболевания и наличия осложнений.
Учитывая вышесказанное, предпочтение следует отдать клинико-функциональной классификации хронического бронхита.
Классификация хронического бронхита:
По функциональной характеристике:
1. необструктивный (простой)
2. обструктивный
По характеру воспаления:
1. катаральный
2. гнойный
По фазе заболевания:
1. обострение
2. ремиссия
По течению:
• фаза ремиссии;
• фаза обострения.
Также при формулировке диагноза необходимо отметить возможные осложнения,характерные для данной патологии, а именно: дыхательная недостаточность (I,II, III степени) и хроническое легочное сердце (14).
Клиническая картина ХБ зависит от распространенности воспаления (проксимальные или дистальные бронхи), от особенностей воспаления (катаральное или гнойное), функциональных нарушений с развитием обструктивного синдрома.
По особенностям клинического течения выделяют хронические необструктивный и обструктивный бронхиты.
Хронический необструктивный бронхит (ХНБ) – это диффузное поражение слизистой оболочки бронхов, обусловленное длительным раздражением различными полютантами и/или повреждением вирусно-бактериальной инфекцией, с развитием воспаления, гиперсекрецией слизи и нарушением очистительной функции бронхов. При этом поражаются, как правило, проксимальные бронхи. В них увеличивается количество бокаловидных клеток и уменьшается количество реснитчатых, появляются участки плоскоклеточной метаплазии эпителия. Изменения имеют обычно поверхностный характер.
В клинической картине основным симптомом является кашель. Обострение чаще наступает в сырое и холодное время года, во время перепадов температуры и на фоне простуды, ОРЗ или гриппа.
В фазу обострения усиливается кашель с мокротой до 100 мл в сутки. Мокрота может быть слизистой при катаральном ХНБ, слизисто-гнойной или гнойной при слизисто-гнойном ХНБ. Характерной особенностью считается утренний кашель с отделением небольшого количества мокроты. В последующее время суток кашель может появляться периодически.
При гнойном бронхите иногда отмечаются некоторые симптомы интоксикации в виде общей слабости, потливости.
Из объективных симптомов характерны низкотональные сухие хрипы при густом экссудате или влажные при жидком секрете на фоне везикулярного дыхания.
Величина функции внешнего дыхания при ХНБ, как правило, остается в нормальных пределах. В этом случае говорят о функционально стабильном ХНБ.
Однако у части больных при обострении ХНБ появляется затрудненное дыхание при кашле, переходе из тепла на холод, в легких начинают прослушиваться сухие свистящие хрипы. Эти симптомы свидетельствуют о нарушении бронхиальной проходимости в связи с переходом воспаления на мелкие бронхи. Если симптомы бронхиальной обструкции носят преходящий характер, это свидетельствует о функционально-нестабильном ХНБ.
Из лабораторных показателей для ХНБ можно отметить повышение СОЭ при гнойном воспалении. Данные рентгеновского исследования не имеют значения в диагностике. При бронхоскопии выявляется гиперемия слизистой оболочки.
Во время ремиссии состояние больных – удовлетворительное, но обычно сохраняется утренний кашель.
По мере прогрессирования воспаления с распространением на мелкие бронхи развивается хронический обструктивный бронхит (ХОБ), который имеет свои клинические особенности.
На 5-м Национальном конгрессе по болезням органов дыхания в Москве в 1995 г. принято следующее определение ХОБ: это заболевание, характеризующееся хроническим диффузным неаллергическим воспалением бронхов, ведущим к прогрессирующему нарушению легочной вентиляции и газообмена по обструктивному типу, и проявляющееся кашлем, выделением мокроты и одышкой, не связанными с поражением других органов и систем.
Обструкция бронхов складывается из обратимого и необратимого компонентов.
Необратимый компонент обструкции – это деструкция эластической и коллагеновой основ мелких бронхов, их фиброз, изменение формы и облитерация бронхиол.
Обратимый компонент обструкции формируется вследствие воспаления слизистой оболочки с ее набуханием и инфильтрацией, сокращения гладкой мускулатуры бронхов и гиперсекреции слизи.
В результате хронического воспаления происходит ремоделирование бронхов за счет увеличения подслизистого и адвентиционного слоев, размеров и числа слизистых и бокаловидных клеток, бронхиальной микрососудистой сети, гипертрофии и гиперплазии мышц воздухоносных путей. Большинство больных ХОБ – это заядлые курильщики.
Основным симптомом при ХОБ остается кашель с небольшим количеством мокроты, особенно в утренние часы. Мокрота может быть слизистой при катаральном воспалении, слизисто-гнойной или гнойной при гнойном воспалении, если присоединяется инфекция.
Для ХОБ характерно появление экспираторной одышки за счет обструкции бронхов. Вначале она может быть в виде нехватки воздуха при стандартных физических нагрузках, при переходе из теплого помещения на холод, во время кашля. В последующем развивается легочная (дыхательная) недостаточность с одышкой в покое.
При гнойном ХОБ вследствие интоксикации появляются потливость, общая слабость, может быть повышение температуры.
У 1/4 больных ХОБ формируется с первоначального воспаления мелких бронхов с характерной одышкой, но в этих случаях у больных отсутствует кашель, так как в мелких бронхах нет кашлевых рецепторов. Это создает определенные трудности в диагностике. Появление кашля в этих случаях свидетельствует о переходе воспаления на более крупные бронхи.
Из объективных симптомов для ХОБ характерны экспираторная одышка, цианоз при нарушении кислородного обеспечения организма, жесткое дыхание и высокие, свистящие сухие хрипы при аускультации легких. Даже если отсутствуют сухие хрипы при спокойном дыхании, при форсированном дыхании появляется свистящий выдох.
При исследовании функции внешнего дыхания определяются вентиляционные нарушения по обструктивному типу. Уменьшается объем форсированного выдоха за 1 с (ОФВ1).
Европейское респираторное общество предлагает определять тяжесть заболевания ХОБ в зависимости от величины ОФВ1:
легкая степень – щ 70 % от должных величин;
средняя –69 – 50 %;
тяжелая -< 50%. Американское торакальное общество в зависимости от величины ОФВ1 выделяет стадии ХОБ: стадия 1 – ОФВ1> 50%; заболевание имеет незначительное воздействие на качество жизни;
стадия 2 – ОФВ1= 35 – 49 %; заболевание значительно снижает качество жизни, требуются частые визиты в лечебное учреждение, наблюдение врача-пульмонолога;
стадия 3 – ОФВ1< 34 %; заболевание резко снижает качество жизни, требуются частые посещения лечебного учреждения и наблюдение пульмонолога.
ХОБ имеет прогрессирующее течение. Об этом судят по уменьшению ОФВ1 более чем на 50 мл в год.
При пикфлоуметрии у больных ХОБ суточные колебания пиковой скорости выдоха не превышают 15%.
Рентгенография легких при ХОБ не является диагностически значимым методом. Можно определить усиление рисунка за счет уплотнения стенки бронхов, уплотнение корней легких.
При бронхоскопии уточняется интенсивность воспаления, мукоцилиарный клиренс. Дополняет бронхоскопию цитологическое исследование смывов. Также можно оценить состояние слизистой оболочки с помощью биопсии.
Цитологическое исследование бронхиального содержимого и мокроты помогает уточнить характер воспаления и его активность. При гнойном воспалении определяется большое количество нейтрофильных лейкоцитов.
На определенном этапе заболевания ХОБ нарушается кислородное обеспечение организма, поэтому необходимо определение газового состава крови для оценки нарушения газообмена в легких и уточнения степени дыхательной недостаточности.
Прогностически неблагоприятными факторами являются пожилой возраст, курение, тяжелая обструкция бронхов, плохой ответ на бронходилататоры, тяжесть гипоксемии, декомпенсированное легочное сердце.
Диагностическими критериями хронического бронхита можно считать следующие:
1. Постоянный кашель с выделением мокроты в течение не менее 3 месяцев на протяжении 2 лет подряд или более (критерии ВОЗ). Если длительность продуктивного кашля не соответствует критериям ВОЗ, а кашель неоднократно рецидивирует, необходимо учесть возможность следующих ситуаций:
кашель курильщика;
кашель в результате раздражения дыхательных путей производственными вредностями (газами, парами, дымами и т. д.);
кашель вследствие патологии носоглотки;
затяжное или рецидивирующее течение острого бронхита;
дыхательный дискомфорт и кашель вследствие контакта с летучими раздражающими веществами;
сочетание названных факторов.
2. Типичная аускультативная картина — грубое жесткое дыхание с удлиненным выдохом, рассеянные сухие и влажные хрипы.
3. Воспалительные изменения в бронхах по данным бронхоскопии (метод используется преимущественно для дифференциальной диагностики).
4. Исключение других заболеваний, проявляющихся многолетним продуктивным кашлем, т. е. бронхоэктатической болезни, хронического абсцесса легких, туберкулеза, пневмокониозов, врожденной патологии бронхопульмональной системы, заболеваний сердечно-сосудистой системы, протекающих с застоем крови в легких.
5. Нарушения бронхиальной проходимости при исследовании функции внешнего дыхания.
