
- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
2. Получение β-аминокислот
2.1. Получение из непредельных кислот. При взаимодействии α, β-ненасыщенных кислот с аммиаком образуются β-аминокислоты:
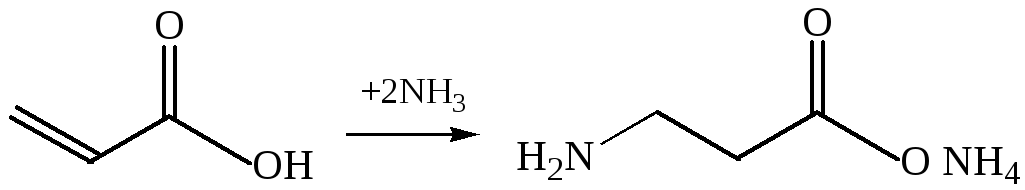
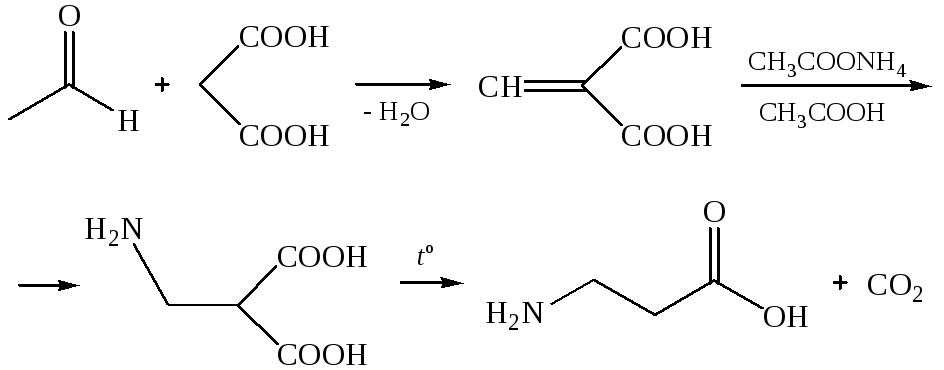
Способ Родионова В. М. Получение из малоновой кислоты и ацетата аммония, реакций с альдегидом:
Получение γ-, δ-, ε-, ω-аминокислот (специфические методы)
3.1. Щелочной гидролиз лактамов:
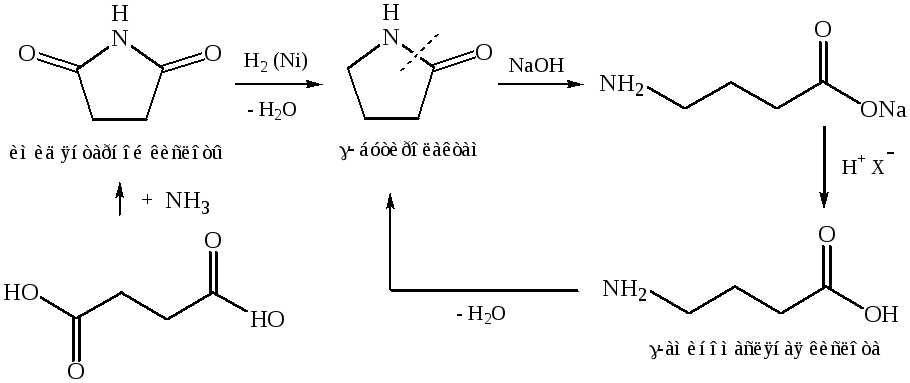
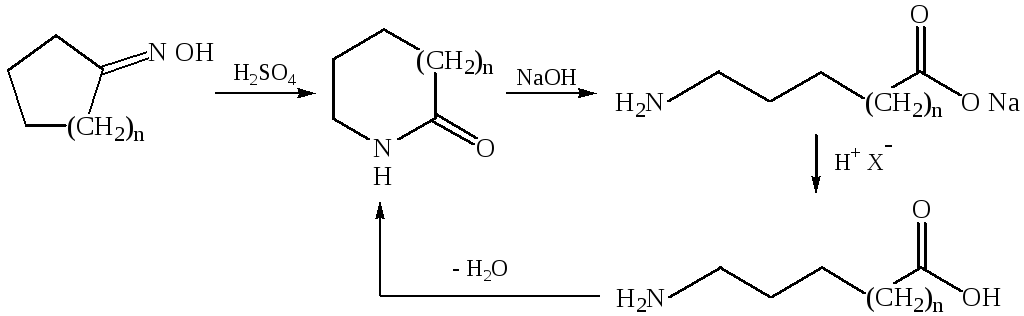
3.2.Перегруппировка оксимов (перегруппировка Бекмана):
3.3. Присоединение аммиака к продуктам теломеризации, (оборванная цепная полимеризация с участием других соединений, образуется смесь продуктов различной массы) этилена и ССl4:
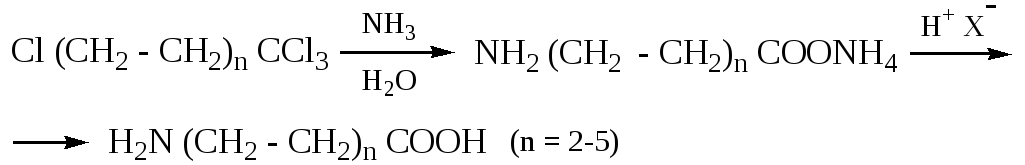
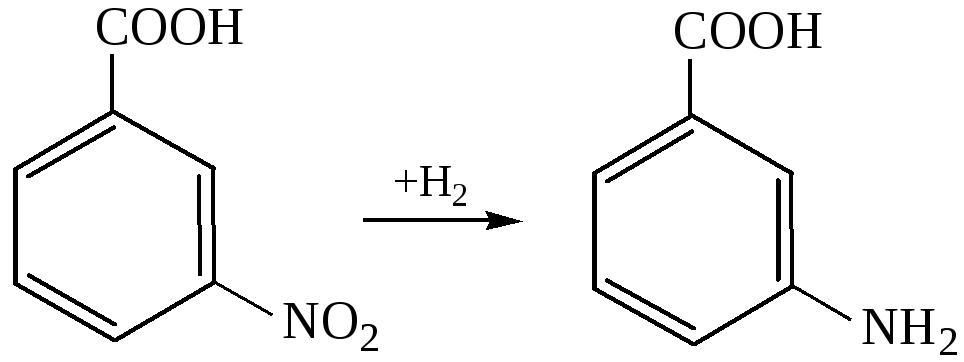
Получение аминоаренкарбоновых кислот:
![]()
Восстановление нитроаренкарбоновых кислот:
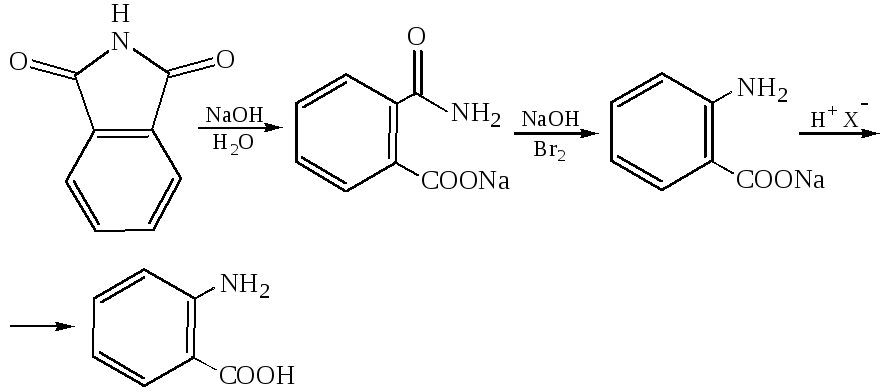
Метод Гоффмана, для получения о-аминоаренкарбоновых кислот используют расщепление имидов:
Физические свойства. Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в воде, трудно растворимые в органических растворителях, с высокой температурой плавления (230–300ºС), с высокой плотностью. Аномально высокие температуры плавления аминокислот связаны с биполярной структурой их твердой фазы.
Таблица – 2 Физические свойства аминокислот
|
Название |
Тплав-ления, оС |
(pI) |
pКа |
Раствори-мость в воде при 25 оС Г / 100 г |
Удельное вращение L-ряда (S) [α]D25 (H2O) |
|
Глицин |
293 |
5,97 |
2,34; 9,60 |
25 |
|
|
Аланин |
297 |
6,02 |
2,35; 9,69 |
16,6 |
+1,8 |
|
Валин |
315 |
5,97 |
2,32; 9,62 |
8,85 |
+5,6 |
|
Лейцин |
337 |
5,98 |
2,36; 9,60 |
2,2 |
–11 |
|
Изолейцин |
284 |
6,02 |
2,36; 9,68 |
4,12 |
+12,4 |
|
Серин |
228 |
5,68 |
2,21; 9,15 |
5 |
–7,5 |
|
Треонин |
253 |
6,53 |
2,63; 10,43 |
20,5 |
–28,5 |
|
Аспарагино-вая кислота |
270 |
2,97 |
2,09 (α-COOH) 3,86 (β-COOH) 9,82 |
0,5 |
+5,0 |
|
Аспарагин |
236 |
5,41 |
2,02; 880 |
2,5 |
–5,6 |
|
Глутамино-вая кислота |
249 |
3,22 |
2,19 (α-COOH) 4,25 (y-COOH) 9,67 |
0,84 |
+12,6 |
|
Глутамин |
185 |
5,65 |
2,17; 9,13 |
4,2 |
+6,3 |
|
Лизин |
224 |
9,74 |
2,18; 8,95(α-NH2) 10,53 (ε-NH2) |
хорошо растворим |
+13,5 |
|
Аргинин |
238 |
10,76 |
2,17; 9,04(α-NH2) 12,48 (ион гуанидия) |
15 |
+12,5 |
|
Гистидин |
277 |
7,58 |
1,82; 6,0 (имидазол); 9,17 |
4,3 |
–38,5 |
|
Фенил-аланин |
275 |
5,98 |
1,83; 9,13 |
|
–34,5 |
|
Тирозин |
344 |
5,65 |
2,20; 9,11 (α-NH2) 10,07 (–OH) |
|
–10 (5М HCl) |
|
Триптофан |
282 |
5,88 |
2,38; 9,39 |
1,14 |
–33,7 |
|
Цистеин |
178 (хлор-гидрат) |
5,02 |
1,71; 8,33 (–SH) 10,78 (α-NH2) |
хорошо растворим |
–16,5 |
|
Цистин |
260 |
5,06 |
1,65; 2,26 (COOH) 7,85; 9,85 (α-NH2) |
0,011 |
–211,9 (1М HCl) |
|
Метионин |
283 |
5,75 |
2,38; 9,39 |
3,5 |
–9,8 |
|
Пролин |
222 |
6,10 |
1,99; 10,60 |
16,2 |
– |
|
Оксипролин |
270 |
5,83 |
1,92; 9,73 |
36,1 |
– |
Аминокислоты лучше растворимы в воде, чем в органических растворителях (например, в этаноле, диэтиловом эфире). Эти свойства указывают на солеобразный характер аминокислот, который является следствием взаимодействия карбоксильных групп с аминогруппами. Многие α-аминокислоты имеют сладкий вкус.
Наличие в молекуле кислотной (-COOH) и основной (-NH2) групп создаёт возможность образования внутренних солей – бетаинов.
![]()
Карбоксильная группа находится в них в неионизированном состоянии.
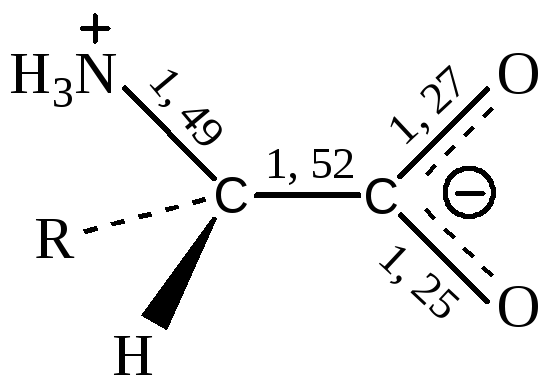
В таком виде существуют и другие аминокислоты (α, β, γ, δ, …) кроме аминоаренкарбоновых кислот.
В водных растворах осуществляют равновесие между катионом и анионом бетаина.
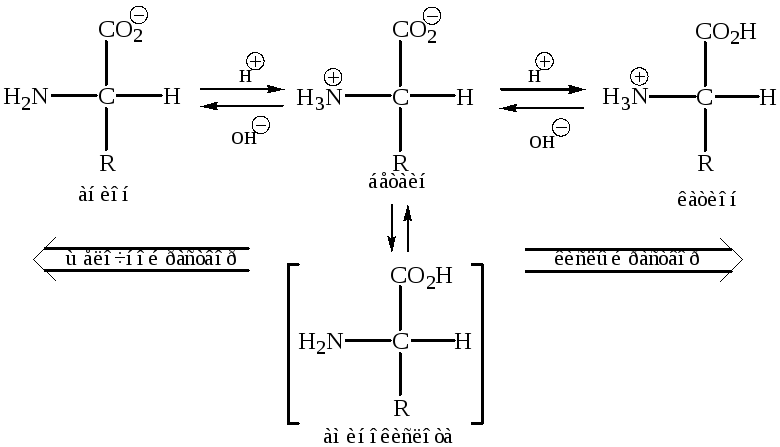
Соотношение определяется константой ионизации. Максимальное содержание бетаина соответствует минимальной электропроводности – называется изоэлектрической точкой – pHi
Особенности физических свойств алифатических аминокислот:
бесцветные высокоплавкие кристаллические вещества;
строение внутренних солей плавятся с разложением в диапазоне от 220 оС (серин, пролин) до 340 оС и выше (валин, тирозин);
растворимость в воде варъирует в широких пределах и определяется природой радикала и главным образом наличием в молекуле гидрофильных и гидрофобных группировок. К первым относятся амино-, гидрокси- и меркаптогруппы, ко вторым – неполярные углеводородные фрагменты;
растворимость в спирте много выше, чем в воде;
практически не растворяются в эфире, хлороформе и других органических растворителях.
Особенности физических свойств ароматических аминокислот:
существуют в основном в неиоизироваррой форме (три изомера аминобензойных кислот);
мало растворимы в воде (0,4–0,6 %, что намного ниже растворимости близкого по структуре, но ионизированного фенилаланина);
значительно лучше растворимы в спирте и эфире (от 2 до 16%).
Химические свойства аминокислот
Реакционная способность гетерофункциональных карбоновых кислот определяется:
реакционной способностью каждой функциональной группы;
взаимным влиянием функциональных групп друг на друга;
участием в реакции обеих функциональных групп.
Аминокислоты как гетерофункциональные соединения вступают в большинство реакций, характерных для карбоновых кислот и аминов. Наличие в молекулах аминокислот двух различных функциональных групп приводит к появлению ряда специфических свойств, которые в общих чертах сходны со свойствами гидроксикислот. Имеющиеся в молекулах аминокислот карбоксильная группа (электрофильный центр) и аминогруппа (нуклеофильный центр) способны взаимодействовать с образованием амидной группировки. Это взаимодействие в зависимости от расположения функциональных групп в молекуле может протекать межмолекулярно или внутримолекулярно.
Кислотно-основные свойства аминокислот
Аминокислоты – амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (–СО2Н), так и основной (–NH2) группы в одной и той же молекуле.
В очень кислых растворах NH2-гpyппa аминокислоты протонируется, и эта кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (известных также под названием диполярных ионов или внутренних солей). В подобных цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе.
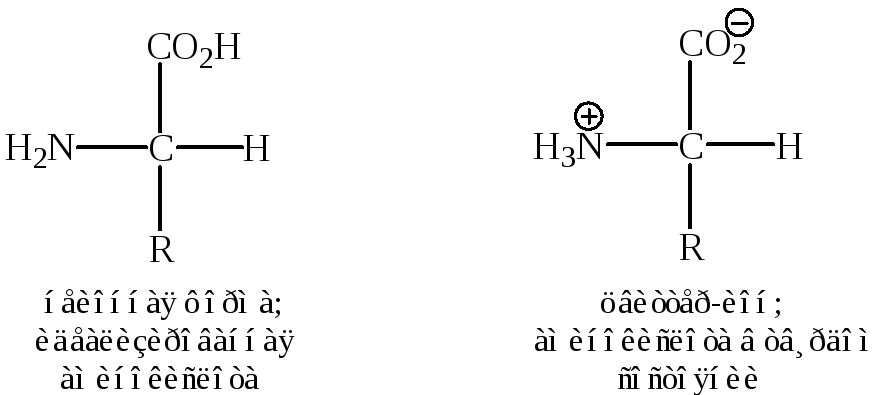
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах – к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к катоду, пи к аноду, так как каждая молекула находится в виде цвиттер-иона (иными словами, она несет как положительный, так и отрицательный заряды). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты (таблица 2). Изоэлектрическая точка аминокислот редко равна 7, так как зависит от кислотности иона алкиламмония, оснoвности карбоксилат-аниона, влияния на них радикала и присутствия любой дополнительной основной или кислотной группы.
При пропускании постоянного тока через раствор, содержащий смесь нескольких аминокислот, каждая из них будет двигаться к катоду или аноду со скоростью, зависящей от природы этой аминокислоты и от рН среды. Разделение и анализ смесей аминокислот, oснованные на этом явлении, называются электрофорезом.
Аминокислоты как биполярные ионы. Хотя аминокислоты обычно изображают как соединения, содержащие амино- и карбоксильную группу H2NCHRCOOH, некоторые их свойства, как физические, так и химические, не согласуются с этой структурой:
в противоположность аминам и карбоновым кислотам аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при довольно высокой температуре;
они не растворимы в неполярных растворителях типа петролейного эфира, бензола или эфира и заметно растворимы в воде;
их водные растворы ведут себя подобно растворам веществ с высоким дипольным моментом;
константы кислотности и основности для групп СООН и NH2 необычайно малы.
Все эти свойства вполне соответствуют структуре диполярного иона для аминокислот H3N+–CHR–COO–. Физические свойства – температура плавления, растворимость, высокие дипольные моменты – отвечают ожидаемым для подобных солей. Кислотно-основные свойства также становятся понятными, если учесть, что измеряемая Ка в действительности относится к кислотности иона аммония RNH3+
![]()

а Кb в действительности относится к основности карбоксилат-иона
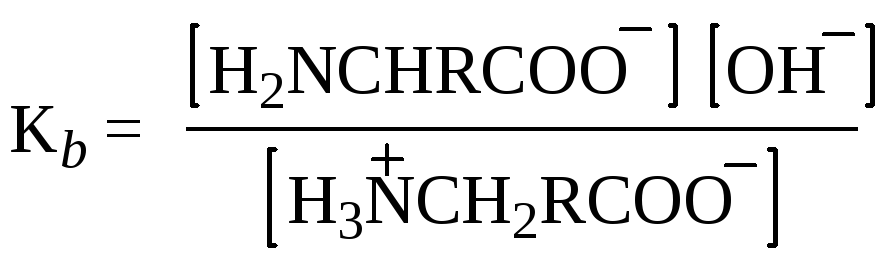
В водном растворе кислотность и основность кислоты и ее сопряженного основания (например, СН3СООН и СН3СОО– или СH3NH3+ и CH3NH2) связаны уравнением Ка·Кb = 10-14. На этом основании можно рассчитать, что Ка = 1,6×10–10 для NH3+-группы глицина означает Кb = 6,3×·10-5для NН2-группы, что кажется вполне приемлемой величиной для алифатического амина. Аналогично Кb = 2,5×10–12 для группы СОО– глицина означает, что Ка = 4×10–3 для СООН-группы, что кажется вполне приемлемой величиной для карбоновой кислоты, содержащей сильную электроноакцепторную (увеличивающую кислотность) NH3+-гpyппy.
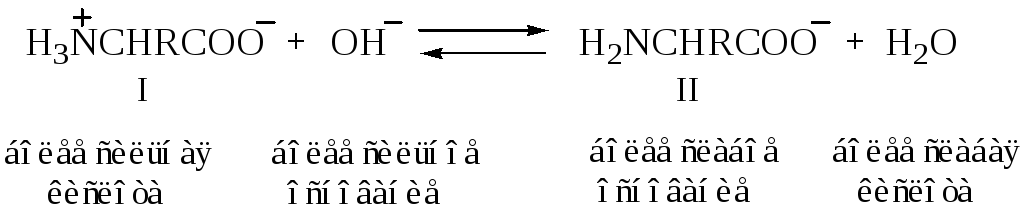
При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II; более сильное основание, гидроксил-ион, отрывает протон от иона аммония и вытесняет более слабое основание — амин
Если подкислить раствор аминокислоты, то диполярный ион I превращается в катион III; более сильная кислота Н3О+ отдает протон карбоксилат-иону и вытесняет более слабую карбоновую кислоту
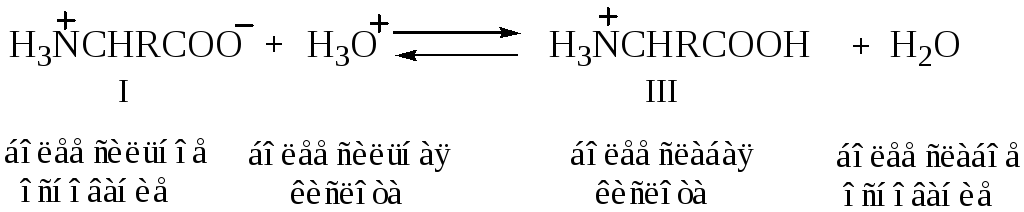
Итак, кислой группой в простых аминокислотах типа глицина является не СООН–, a NH3-гpyппa, а основной — не NH2-гpyппa, а группа COО–.
Необходимо иметь в виду, что ионы II и III, содержащие свободную NH2- или СООН-группу, находятся в равновесии с диполярным ионом I; поэтому аминокислоты вступают в реакции, характерные для аминов и карбоновых кислот. По мере удаления иона II, например при реакции с бензоилхлоридом, равновесие сдвигается в сторону образования иона II, так что постепенно аминокислота полностью бензоилируется.

В тех случаях, когда это возможно, желаемую реакцию можно ускорить, создавая нужную концентрацию кислоты или основания в растворе так, чтобы увеличить концентрацию реакционноспособной частицы.
Изоэлектрическая точка аминокислот
Если раствор аминокислоты поместить в электрическое поле, то в зависимости от кислотности или основности раствора будет наблюдаться различная картина. В сильнощелочном растворе концентрация анионов II превышает концентрацию катионов III и наблюдается миграция аминокислоты по направлению к аноду.
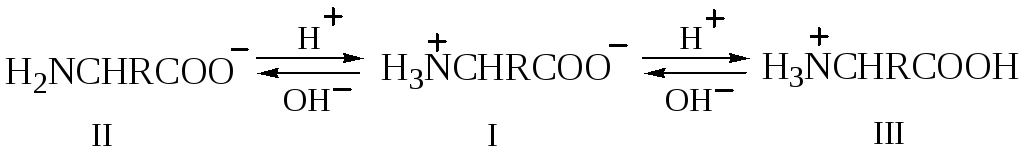
В сильнокислом растворе имеется значительный избыток катионов III и будет наблюдаться миграция аминокислоты к катоду. Если концентрации ионов II и III равны друг другу, то не будет наблюдаться никакого видимого движения; в этих условиях любая молекула одно и то же время проводит в состоянии и катиона и аниона, поэтому любое незначительное смещение в направлении одного из электродов немедленно компенсируется равным смещением в направлении другого электрода. Концентрация ионов водорода, при которой данная аминокислота не движется под влиянием электрического поля, называется изоэлектрической точкой данной аминокислоты.
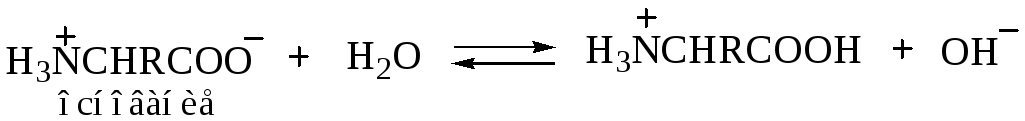
Моноаминомонокарбоновая кислота H3N+CHRCOO– имеет несколько большую величину кислотности по сравнению с основностью (например, для глицина Ка — 1,6 · 10–10, а Кь = 2,5 · 10–12). Если кристаллы такой аминокислоты прибавить к воде, то образующийся раствор будет содержать больше анионов II (H2NCHRCOO–), чем катионов III (H3N+CHRCOOH). Эту «избыточную» ионизацию иона аммония в амин (I < = > II + Н+) можно подавить прибавлением кислоты для того, чтобы была достигнута изоэлектрическая точка, которая вследствие этого будет несколько сдвинута в область кислых значений рН. Например, для глицина изоэлектрическая точка лежит при рН 6,1. Аминокислота обычно обнаруживает самую низкую растворимость в растворе при изоэлектрической точке, поскольку при этом концентрация диполярного иона максимальна. Если же раствор будет более щелочным или более кислым, то тем самым увеличивается концентрация одного из более растворимых ионов (II или III).
Комплексные соли с ионами меди
Аминокислоты с ионами переходных металлов (Сu, Zn, Co, Pb, Ag, Hg) образуют прочные хелатные комплексы (от греч. сhele – клешня). Малорастворимые хелаты меди (II) имеют глубокую синюю окраску, они устойчивы в щелочной среде и используются для обнаружения α-аминокислот.
Образование медной соли аминоуксусной кислоты. В комплексной медной соли аминоуксусной кислоты двувалентная медь связана ковалентными связями с атомами кислорода карбоксильных групп и дополнительными связями с неподелёнными парами электронов аминогрупп. В растворе отсутствуют ионы Cu2+, поэтому при добавлении раствора щёлочи осадка гидроксида меди (II) не образуется. Взаимодействие аминоуксусной кислоты с оксидом меди (II):
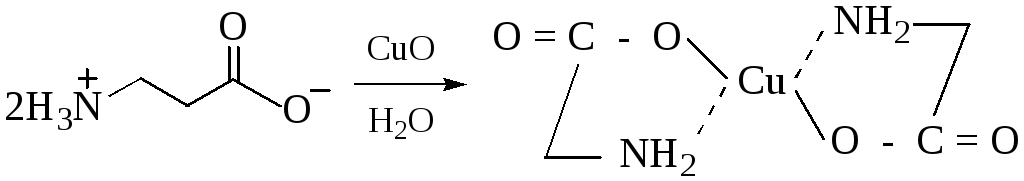
5. Реакции по карбоксильной группе (при защищенной аилированием или солеобразованием аминогруппе) аналогичны реакциям карбоновых кислот, которые образуют соли, сложные эфиры, амиды, ангидриды и т.д.
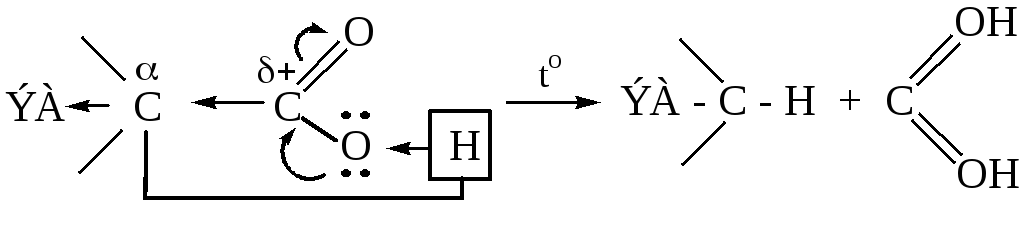
5.1 Декарбоксилирование (элиминирование СО2 из карбоксильной группы) при нагревании аминокислот в присутствии Ba(OH)2 с образованием аминов, легко протекает при наличии в α-положении ЭА-групп
![]()
5.1.1
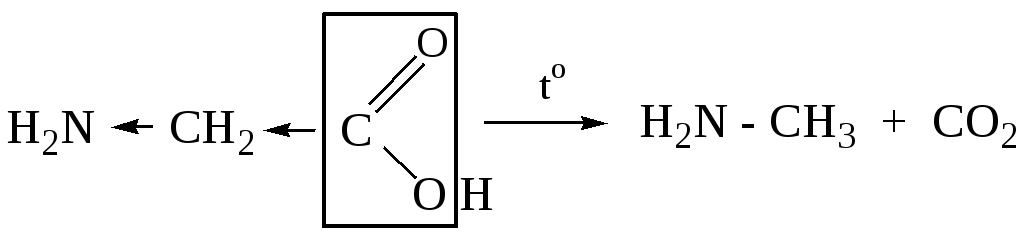
5.1.2
5.1.3
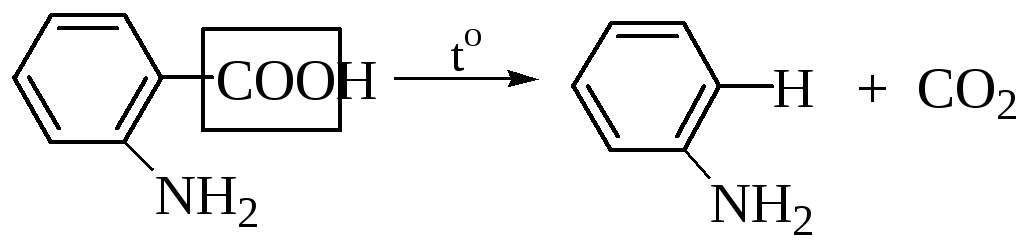
5.1.4 Реакция декарбоксилирования используется для идентификации соответствующих кислот по образованию СО2.
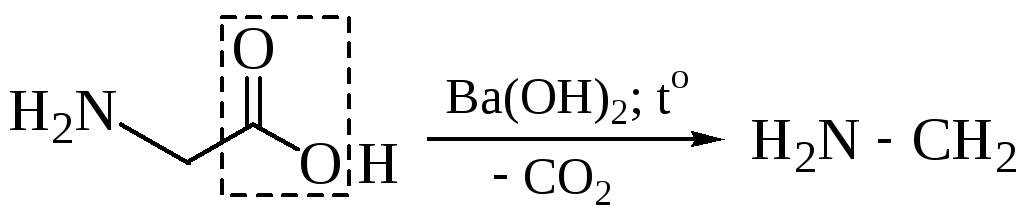
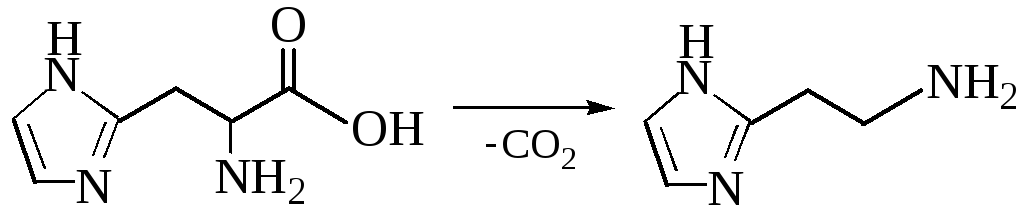
В живых организмах эта реакция протекает под воздействием ферментов-декарбоксилаз. При этом образуются биогенные амины, обладающие высокой физиологической активностью. При карбоксилировании аминокислоты гистидина образуется гистамин, который снижает кровяное давление и усиливает действие желез внутренней секреции:
Декарбоксилирование глутаминовой кислоты приводит к образованию γ-масляной кислоты – главного тормозного медиатора системы.
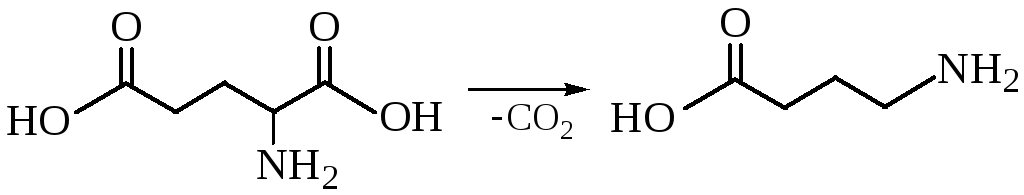
Некоторые амины обладают ярко выраженной биологической активностью, и декарбоксилирование аминокислот служит важным источником их возникновения. Особенно существенным является образование дофамина при декарбоксилировании диоксифенилаланина, поскольку дофамин — это биологический предшественник адреналина.

Декарбоксилирование глутаминовой кислоты играет важную роль, так как возникающую в результате реакции y-аминомасляную кислоту можно рассматривать как природный «транквилизатор».

Декарбоксилаза глутаминовой кислоты нуждается в присутствии пиридоксальфосфата для того, чтобы катализировать превращение глутаминовой кислоты в у-аминомасляную. Животные, пища которых не содержит пиридоксина (предшественника пиридоксальфосфата), страдают судорогами, напоминающими эпилепсию. Потребность живых организмов в «витамине В6» — группе соединений, включающей пиридоксаль, пиридоксин и пиридоксамин, связана с тем, что около двадцати биологических реакций аминокислот нуждаются в пиридоксальфосфате в качестве «кофермента».
Взаимодействие с основаниями. Существование бетаинов даёт возможность образованию обычных солей. В результате взаимодействия глицина с гидроксидом натрия получается соль глицинат натрия и вода.
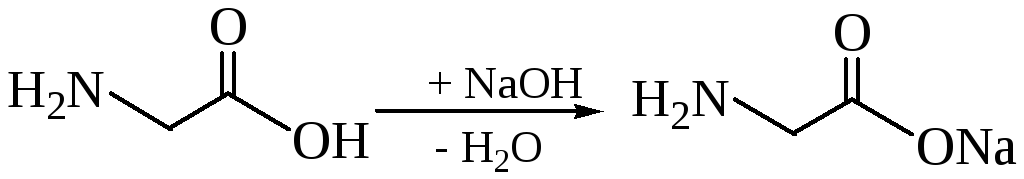
Превращение карбоксильной группы в галогенангидридную. При действии на аминокилоту хлорида фосфора (V) образуются соли её хлорангидрида:
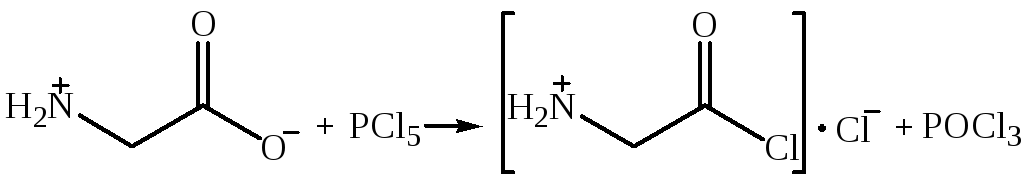
Нейтрализация кислоты (HCl) приводит к образованию очень неустойчивых свободных хлорангидридов.
Образование комплексонов. С ионами тяжёлых металлов образуются соли, в которых возможна внутрикомплексная связь.
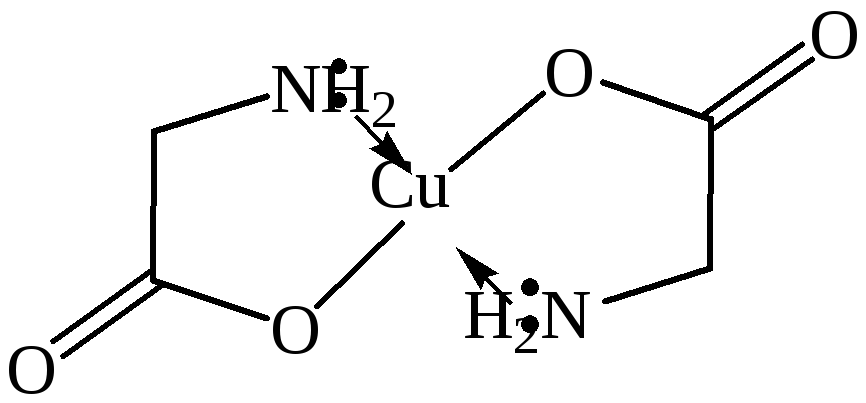
Наиболее известным комплексоном является этилендиаминтетрауксусная кислота.

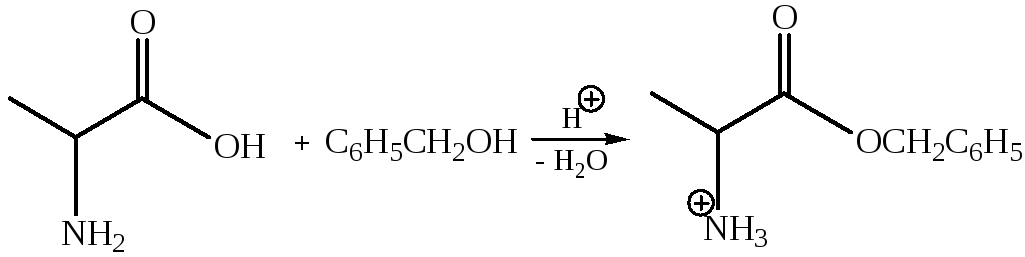
Образование сложных эфиров (этерификация).
Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле.
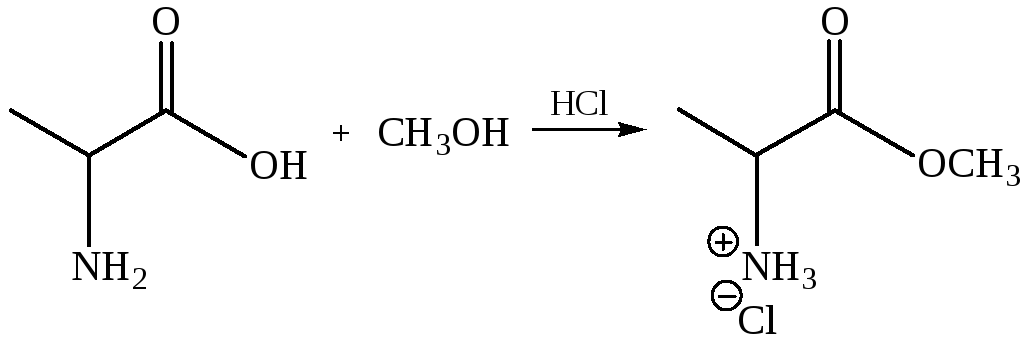
Если спирт не является жидкостью, реакцию можно проводить в инертном растворителе. Воду, которая при этом образуется, отгоняют. Одним из широко применяемых кислотных катализаторов является n-толуолсульфокислота (сильная органическая кислота). В качестве примера ниже показано получение бензилового эфира глицина.
Реакции по аминогруппе:
Они аналогичны превращениям аминов, легко образуют с минеральными кислотами, легко ацилируются и алкилируются.
Ацилирование (образование амидов по аминогруппе). При нагревании с карбоновыми кислотами, их ангидридами и хлорангидридами аминокислоты ацилируются с образованием N-замещенных аминокислот:

Ангидриды и хлорангидриды, как сильные ацилирующие реагенты, вступают в реакцию с аминокислотами при комнатной температуре. Реакции с кабоновыми кислотами протекают в более жестких условиях (при нагревании).
Алкилирование. Подобно аминам, α-аминокислоты можно алкилировать алкилгалогенидами. В этой реакции образуются смеси с различной степенью алкилирования, а также триалкильные производные, которые обладают четвертичным атомом азота и называются бетаинами.
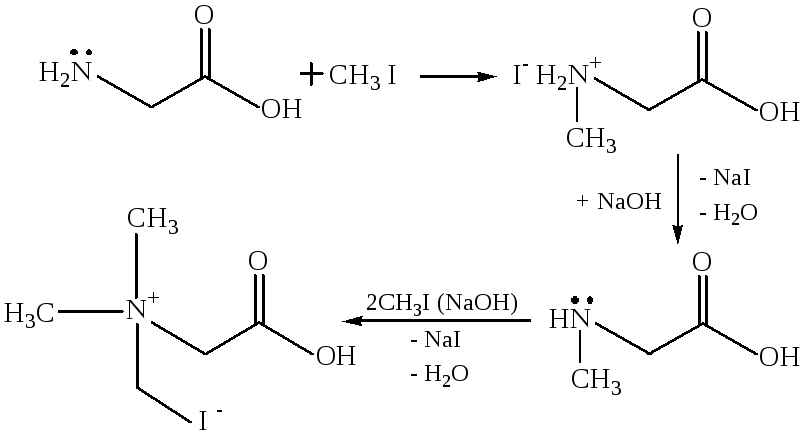
У животных и растений аминокислоты могут подвергаться полному метилированию с образованием бетаинов, которые обладают значительным запасом энергии и являются донорами метильных групп в метаболических процессах, не требующих дополнительного источника энергии. В настоящее время выделены бетаины глицина, триптофана, пролина, y-масляной кислоты.
Взаимодействие с альдегидами. Аминокислоты, подобно певичным аминам, реагируют с альдегидами с образованием оснований Шиффа (азометинов):

Эта реакция лежит в основе титрования аминокислот. Вследствие амфотерности аминокислоты не могут быть оттитрованы щелочью, но после обработки формальдегидом у них остается свободной только СООН-группа, которая может быть количественно оттитрована.
Дезаминирование (диазотирование): Реакция, при которой аминокислота теряет свою аминогруппу.
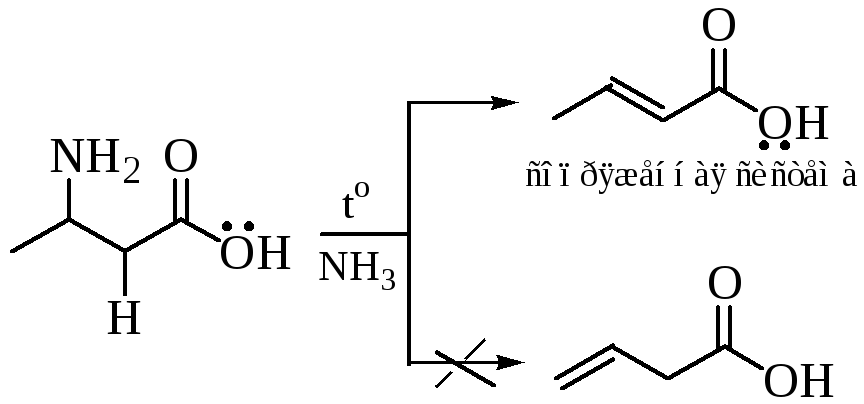
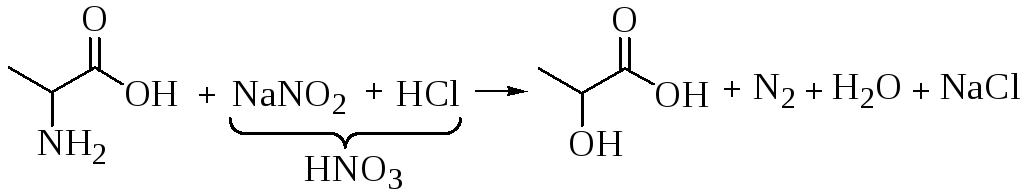
Удаление аминогруппы из молекулы амнокислоты может осуществляться под действием азотистой кислоты, воды, при нагревании, а также ферментативно.
Под действием азотистой кислоты через неустойчивые соли диазония образуются оксикарбоновые кислоты и выделяется молекулярный азот:
Возможно гидролитическое дезаминирование аминокислот:
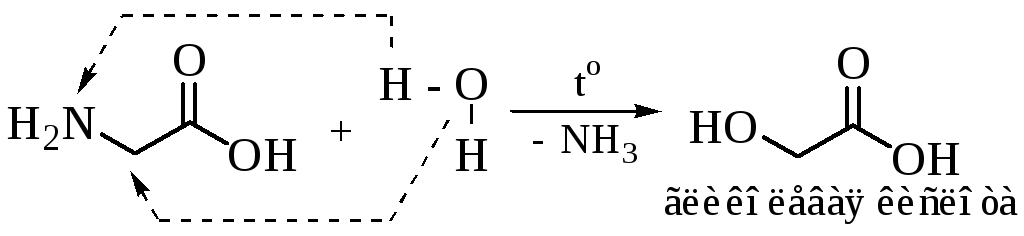
При нагревании некоторые аминокислоты могут отщеплять аммиак с образованием непредельных карбоновых кислот:
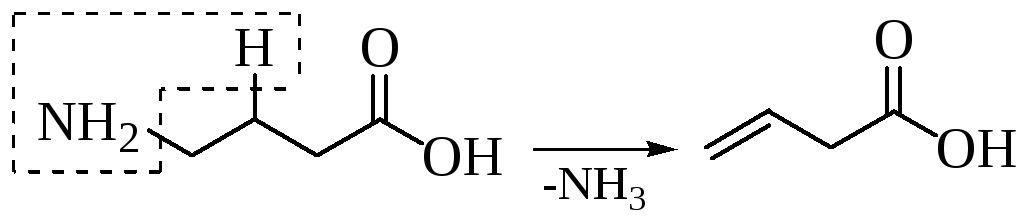
В живых организмах дезаминирование осуществляется под действием ферментов несколькими путями: восстановлением (а), окислением (б) и гидролизом.
Восстановительное дезаминирование. Реакция характерна для некоторых микроорганизмов. В качестве примера можно назвать превращение аспарагиновой кислоты в фумаровую кислоту и аммиак под действием фермента аспартазы.
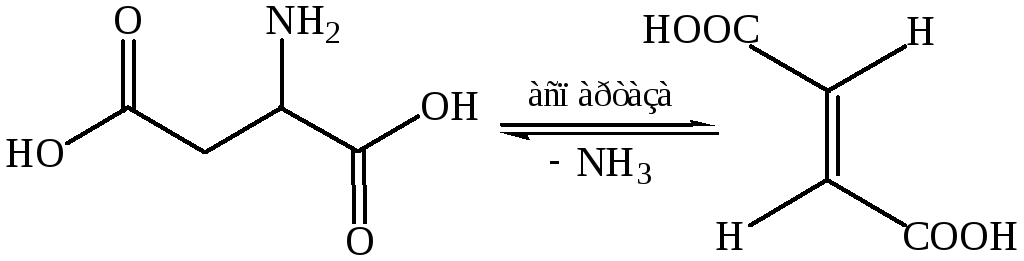
Окислительное дезаминирование – наиболее распространенный (встречается в основном у бактерий и грибов) в природе процесс:
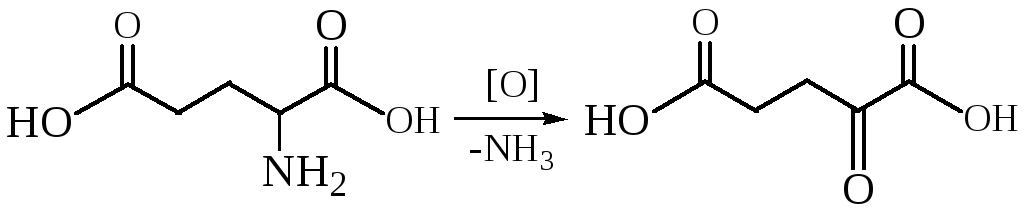
Для того чтобы полностью прошла реакция окислительного дезаминирования, например превращение аланина в пировиноградную кислоту, фермент, катализирующий эту реакцию, нуждается в окислительном (дегидрирующем) агенте. Обычным акцептором водорода в таких системах служит ФАД (флавинадениндинуклеотид), который переходит в восстановленную форму, сокращенно обозначаемую ФАД-Н2. Окислительное дезаминирование осуществляется через образование промежуточного имина. Ниже приведены два уравнения, описывающие дезаминирование аланина до пировиноградной кислоты: первое из них написано химиком-органиком, второе — биохимиком.
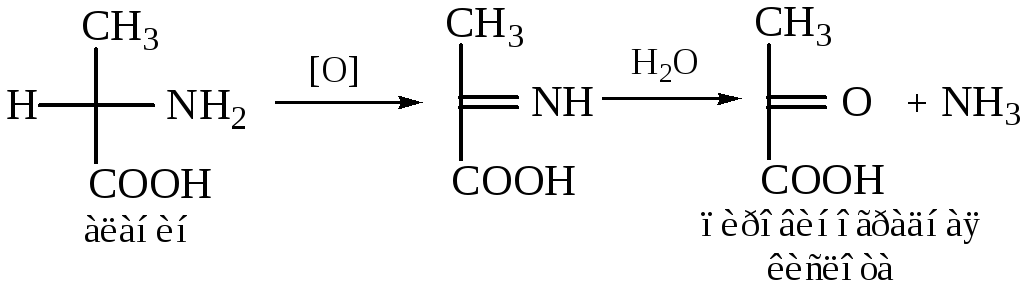
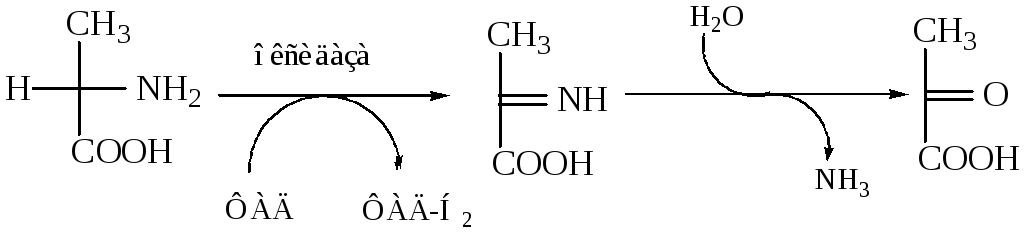
Реакции дезаминирования позволяют организму удалять избыток аминокислот, однако концентрация нежелательных азотистых веществ в системе при этом повышается. Высокие концентрации аммиака токсичны для организма, который стремится поэтому освободиться от аммиака или его производных. Организмы, обитающие в воде, выделяют аммиак непосредственно в окружающую среду. Поскольку наземные организмы лишены такой возможности, они выделяют лишний азот в виде твердых веществ — мочевины или мочевой кислоты.
Взаимодействие с кислотами. В результате получаем солянокислый глицин (соль).
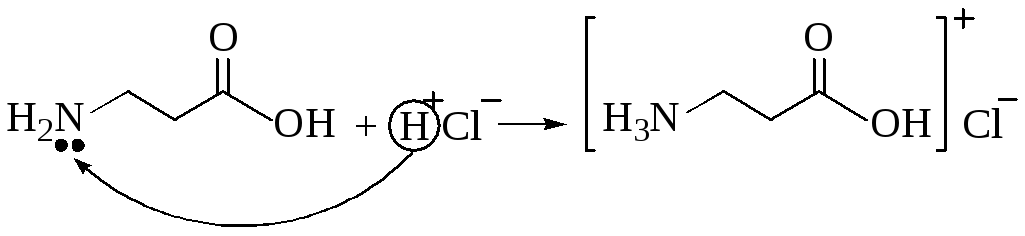
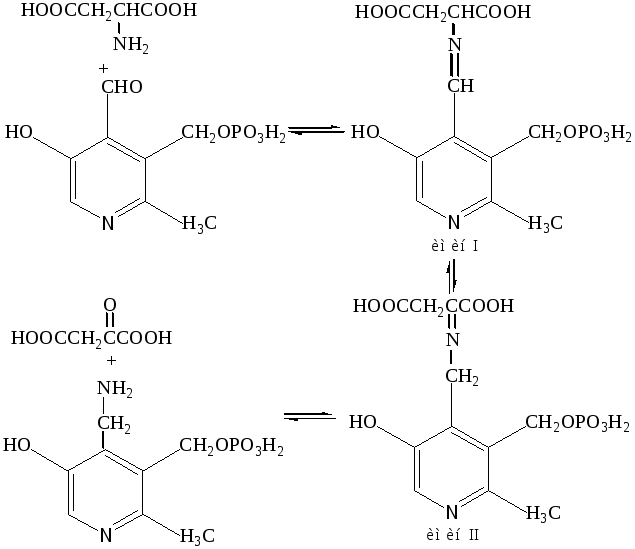
Переаминирование аминокислот с участием пиридоксальфосфата и аминотрансфераз, в результате чего аспарагиновая кислота превращается в щавелевоуксусную кислоту, а пиридоксальфосфат – в пиридоксаминофосфат. Последний участвует в аминировании α-кетокислот, например, при биосинтезе глутаминовой кислоты из D-глюкозы.
Реакции с одновременным участием карбоксильной и аминогруппы:
Межмолекулярная дегидратация (отношение к нагреванию). В зависимости от положения аминогруппы аминокислоты при нагревании ведут себя по-разному.
α-аминокислоты образуют циклические амиды с устойчивым шестичленным циклом – дикетопиперазины (при этом аминогруппа одной молекулы аминокислоты взаимодействует с карбоксильной группой другой молекулы и наоборот), нециклические – пептиды, линейные амиды и полиамиды:
