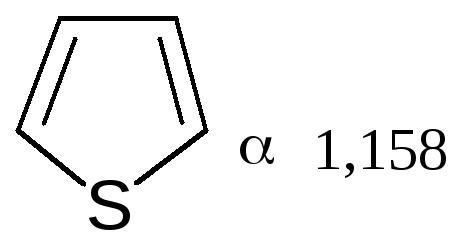- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
4.1 Пятичленные гетероциклы с одним гетероатомом
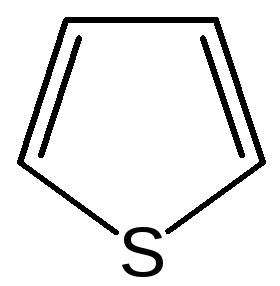
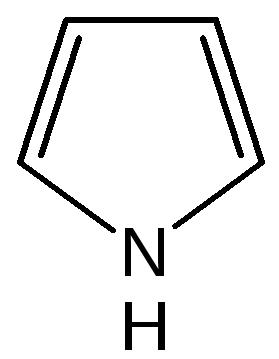
Общая характеристика пятичленных гетероциклов с одним гетероатомом. К простейшим ароматическим пятичленным гетеро-циклическим соединениям с одним гетероатомом относятся фуран, пиррол и тиофен:
|
|
|
|
|
фуран |
тиофен |
пиррол |
Способы получения. Для построения пятичленного гетеро-циклического кольца чаще всего применяют разнообразные реакции замыкания цикла, включающие внутримолекулярное образование σ-связи.
1. Синтез по Паалю–Кнорру. При проведении этого синтеза 1,4-дикарбонильные соединения нагревают в присутствии либо серной кислоты, либо с аммиаком, либо с сульфидом, в зависимости от вещества, которое хотят получить:
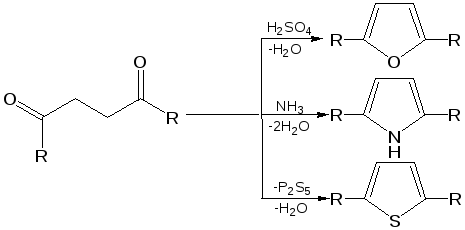
В реакциях Пааля-Кнорра в качестве 1,4-дикарбонильного соединения используют дикетоны, сложные эфиры дикарбоновых кислот, дикарбоновые кислоты или кетокислоты. Используя различные «строи-тельные блоки», этим методом можно синтезировать разнообразные гомологи и производные пятичленных гетероциклов с одним гетероатомом.
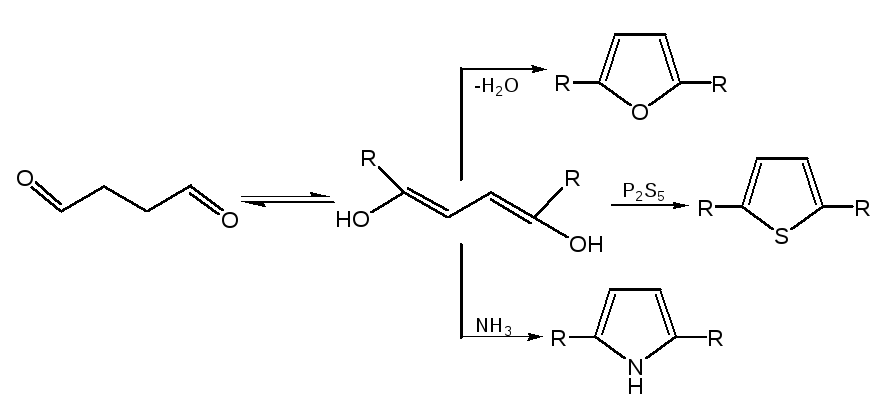
2. Реакция 1,4-диоксосоединенийс водоотнимающими соединениями. Действуют на ароматические гетероциклы с одним гетероатомом исходят из 1,4-диоксосоединений, на которые для получения фурана и его гомологов действуют водоотнимающими веществами (Р2О6, СН3СОСl), для получения тиофена и его гомологов – пятисернистым фосфором, для синтеза пиррола и его производных – аммиаком:
3. Получение пятичленных гетероциклов из продуктов окисления сахаров. Сухая перегонка слизевой кислоты ведет к пирослизевой кислоте (так называется α-фуранкарбоновая кислота), а пиролиз аммониевой соли слизевой кислоты – обычный путь синтеза пиррола. В первом случае происходит потеря одного карбоксила в виде СО2, во втором – полное декарбоксиливование:
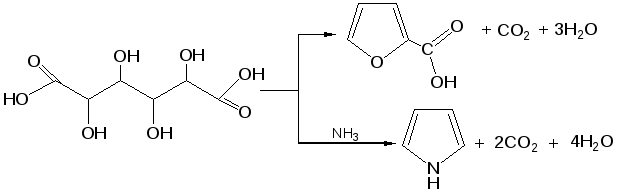
Для синтеза тиофена и его производных этого типа реакция не применяется, но тиофен можно получить, действуя P2S3. нa янтарную кислоту.
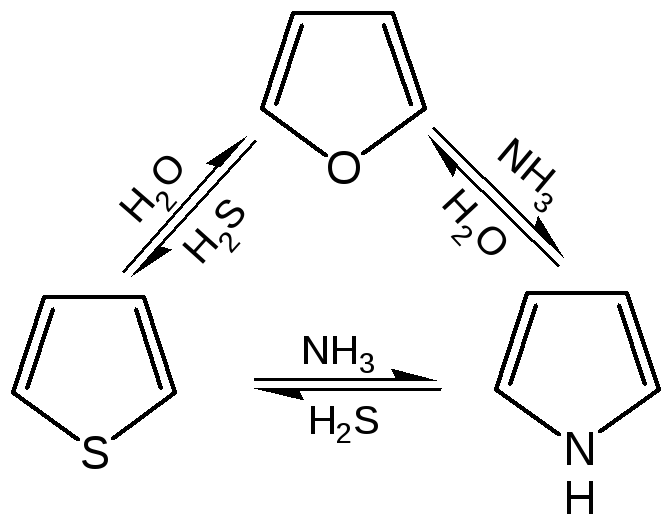
4. Взаимные превращения фурана, тиофена и пиррола. Между фураном, тиофеном и пирролом существует взаимосвязь, открытая советским ученым Ю.К. Юрьевым, которая заключается в превращении указанных гетероциклов друг в друга при температуре 450 С в присутст-вии оксида алюминия (реакция обмена гетероатома):
5. Получение гетероциклов из олефинов. Хьюсген обобщил ряд давно известных реакций (открытых Ганчем, Димротом, Килико и др.) и нашел серию новых реакций «присоединения» к олефинам, ацетиленам, а также нитрилам, ведущих к замыканию пятичленных гетероциклов. По этой причине данный тип присоединения был назван биполярным. Присоединение по кратной связи диполярофила (так по аналогии с диено-филом называется присоединяющий диполярную триаду ацетилен, олефин и т. д.) происходит по следующему типу:
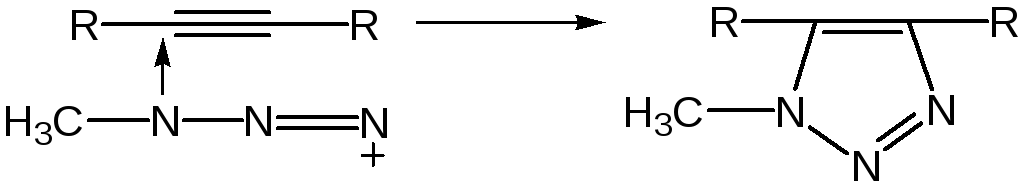
6. Синтез пятичленных гетероциклов с одним гетероатомом из диацетилена (Шульте):
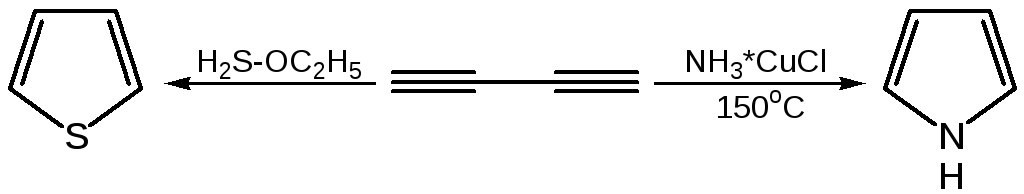
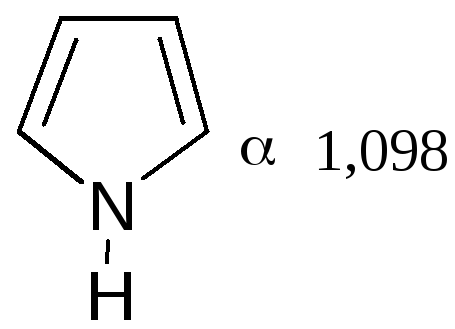
Электронное строениепятичленных гетероциклов на примере пиррола. Молекула пиррола плоская, что свидетельствует о гибридизации как атомов углерода, так и гетероатома азота. Причем три гибридизованные орбитали атома азота, принимающие участие в образованииσ-связей, лежат в плоскости кольца.
Негибридизованная p-орбиталь гетероатома, расположенная перпендикулярно плоскости кольца, несет неподеленную пару электронов. При перекрывании π-орбитали кольцевого азота с негибридизованными π-орбиталями четырех атомов углерода кольца, несущих по одному электрону, образуется единая π-молекулярная система, содержащая в общей сложности шесть электронов (ароматический секстет). Таким образом, пиррол, как и бензол, и пиридин, подчиняется правилу ароматичности Хюккеля.
Гетероциклы фуран и тиофен представляют собой плоские молекулы, имеющие подобный пирролу тип делокализованной структуры, где одна из неподеленных электронных пар гетероатома (кислорода и серы, соответственно) участвует в образовании ароматического секстета.
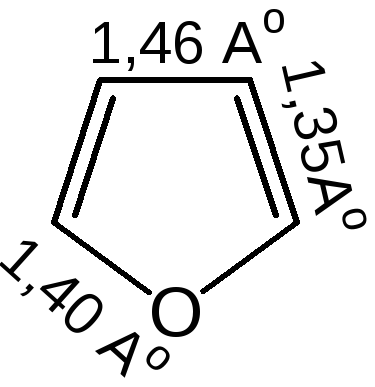
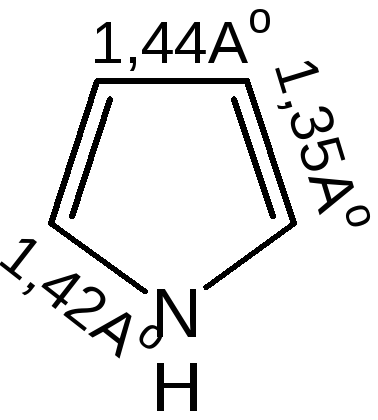
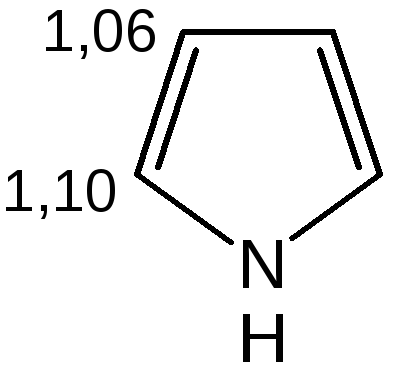
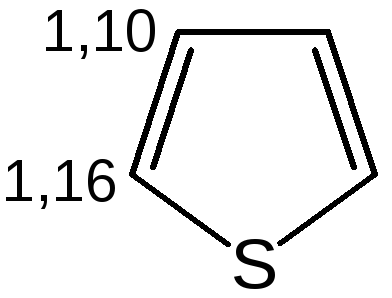
Геометрия молекул и расчеты по методу МО: длины связей в пирроле, фуране и тиофене свидетельствуют об образовании сопряженной системы, т. е. связи короче обычных (длина связи С–С = 0,154 нм, С–N = 0,145-0,147 нм, С–O = 0,140-0,142 нм, С–S = 0,18 нм), но длиннее двойных (длина связи С=С = 0,134 нм):
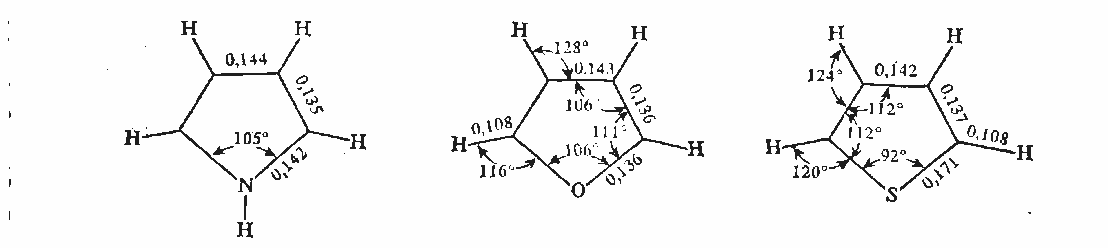
Расчеты по методу МО в приближении Хюккеля свидетельствуют о том, что все эти системы стабилизированы вследствие циклической делокализации л-электронов. Энергия циклической делокализации зависит от электроотрицательности гетероатома и резонансного интеграла связи С–X. При увеличении электроотрицательности гетероатома энергия уменьшается.
В целом следствием высокой электроотрицательности гетероатома кислорода является уменьшение влияния +Мэффекта (р, π-сопряжения), и, вероятно, поэтому фуран имеет менее выраженный ароматический характер, чем пиррол, и склонен к реакциям, характерным для сопряженных диенов.
Если для фурана и пиррола допустима только одна незаряженная предельная структура, то с тиофеном дело обстоит несколько иначе. Наименее ароматичен фуран, у него наиболее выражены диеновые свойства, так как кислород – самый электроотрицательный из трех рассматриваемых элементов, он меньше всего склонен отдавать свою электронную пару на образование ароматического секстета.
Наиболее выражены ароматические свойства у тиофена, он больше всего напоминает бензол, т. к. пара р-электронов атома серы более удалена от ядра и легче смещается для образования сопряженной-электронной оболочки. Пиррол в этом ряду занимает промежуточное положение. Гетероатом, поставляяр-электроны в цикл, теряет долю своей электроотрицательности, в то же время имеет место повышенная нуклеофильность атомов углерода, в особенности соседних с гетероатомом. Свободная электронная пара гетероатома сдвинута на двойные связи цикла и электроны способны переходить из октета одного углеродного атома в октет другого углеродного атома.
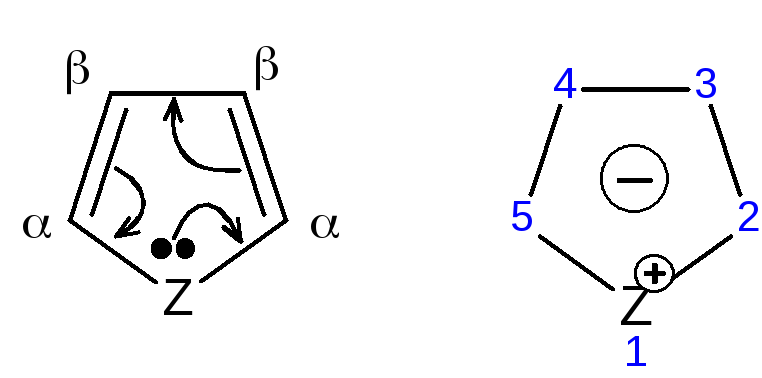
Рисунок 1 – Общая формула пятичленных гетероциклов,
где Z = O, S, NH; 2, 5 – -положения; 3, 4 – -положения
Такая формула объясняет повышенную активность к электрофильному замещению атомов углерода циклов, особенно, в положениях 2, 5(-положения).
На полярную природу этих соединений указывает также наличие дипольных моментов в отличие от бензола, а также отсутствие выравненности углерод-углеродных связей, хотя в результате имеющегося сопряжения двойные связи в них удлинены, а простые укорочены:
Дипольный момент μ (D)
|
|
|
|
|
|
0 |
0,7 |
1,8 |
1,87 |
Степень ароматичности, рассматриваемых гетероциклов, можно выразить с помощью энергии сопряжения:
|
Распределение зарядов |
|
|
|
|
|
Энергия сопряжения (кДж/моль) |
92 |
109 |
118 |
150,7 |
увеличение ароматичности

увеличение диеновой природы

Таблица 4 – Величина энергии резонанса ER.
|
|
Величина электронной плотности |
ЭО гетероатома |
ER, кДж/моль |
|
Тиофен |
|
2,5 |
120 |
|
Пиррол |
|
3,0 |
100 |
|
Фуран |
|
3,5 |
92 |
Таблица 5 – Температура кипения гетероциклов:
|
Представители |
Т. кип., оС |
Молекулярная масса |
|
Фуран |
31,83 |
68,1 |
|
Пиррол |
130,0 |
67,0 |
|
Пирролидин |
86,6 |
71,0 |
Гетероатом (O,S,N) в пятичленных гетероциклах, как правило, не участвует в образовании координационных соединений, поскольку свободная парар-электронов поставляется для образования ароматического секстета. Так, фуран, тиофен и пиррол не образуют оксониевых соединений, сульфоксидов, сульфонов, четвертичных аммонийных оснований,N-окисей. Пятичленные гетероциклы отличаются от бензола и его производных меньшей устойчивостью к агрессивным воздействиям.
Химические свойства. Для пятичленных гетероциклических соединений с одним гетероатомом характерны следующие реакции замещения, присоединения, раскрытия цикла и обмена гетероатома, обусловленные химическим строением данных соединений.
Наиболее характерными реакциями фурана, тиофена и пиррола, как и других ароматических соединений, являются реакции электрофильного замещения. Эти соединения подвергаются галогенированию, сульфированию, нитрованию, ацилированию и т.д. В реакциях электрофильного замещения пятичленные гетероциклы ведут себя активнее бензола, аналогично ароматическим аминам и фенолам. Электрофильное замещение происходит в положения 2,5 (-положения), т. е. по месту наибольшей электронной плотности.
1. Нитрование. Используют «мягкий» нитрующий агент – ацетилнитрит (смесь уксусного ангидрида с азотной кислотой) в пиридине, при этом образуются α-нитропроизводные:
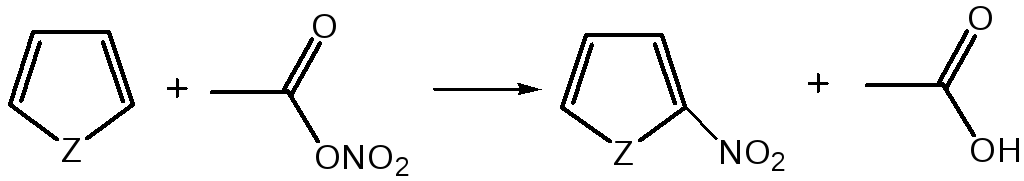
где Z = О, NH, S
2. Сульфирование.Фуран и пиррол осмоляются при действии минеральных кислот (проявляют ацидофобные свойства), т.е. в кислой среде протон связывает неподеленную пару электронов кислорода или азота, образуется оксониевый или аммониевый ион, обладающий свойствами диена с сопряженными двойными связями, который легко полимеризуется и осмоляется:
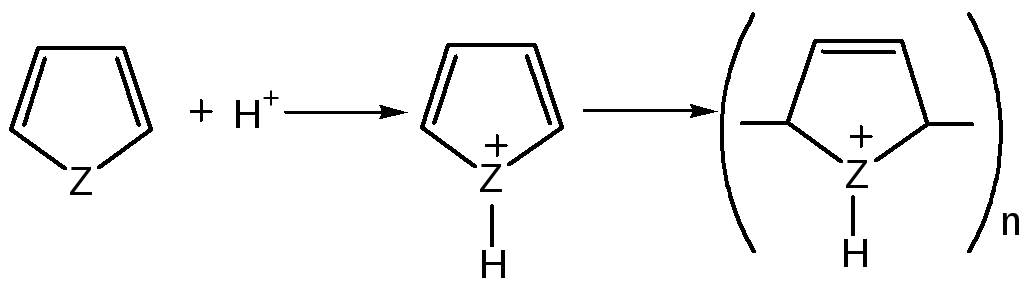
где Z = О, NH
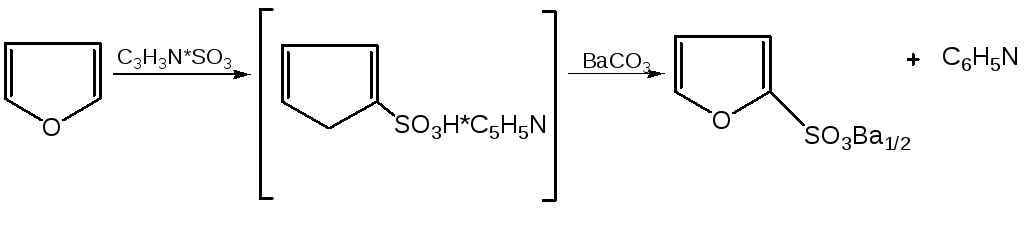
Поэтому сульфируют фуран и пиррол с помощью пиридинсульфотриоксида – комплекс пиридина с оксидом серы (VI) C6H5NSO3:
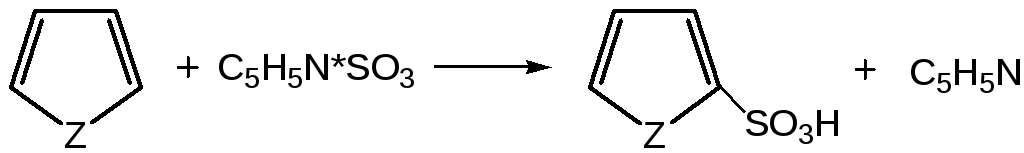
где Z = О, NH
3. Основность ацидофобных гетероциклов (ацидофобность от лат. acidum – кислота, гр. phobos – боязнь).
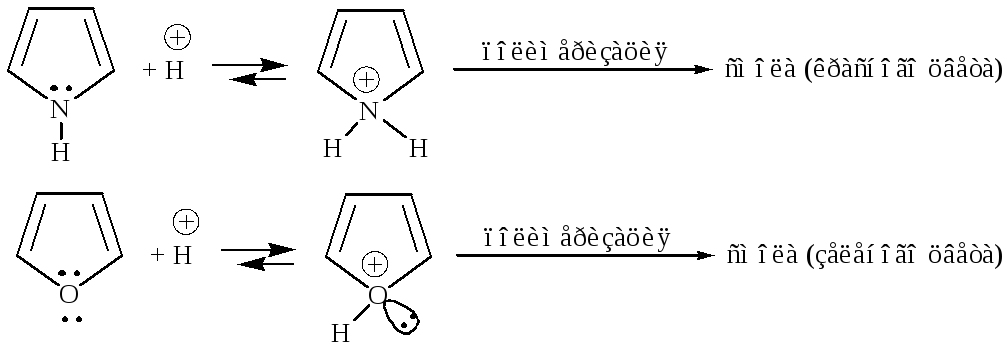
Тиофен неацидофобен, т.к. у него практически отсутствуют основные свойства.
Представители пятичленных гетероциклических соединений с одним гетероатомом
Фуран представляет собой пятичленный ароматический гетероцикл с атомом кислорода в кольце:
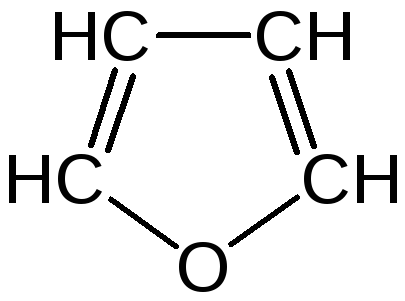
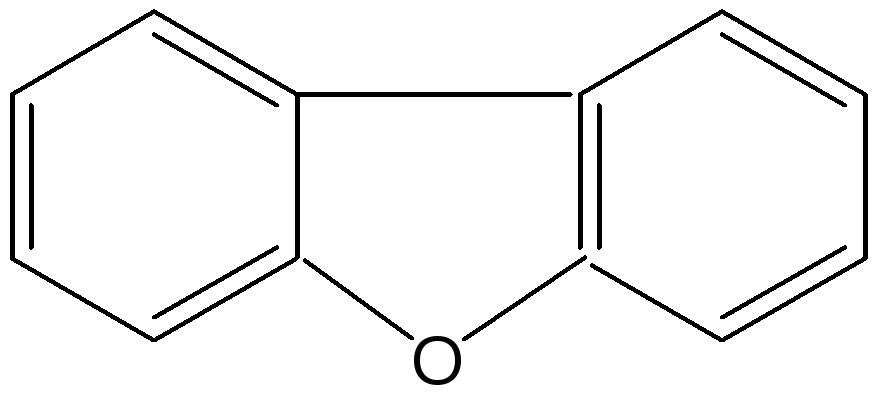
Важное место в ряду фурана занимают бензофуран и дибензофуран – соединения, в которых фурановое кольцо сконденсировано с одним или двумя бензольными кольцами:
|
|
|
|
бензофуран |
дибензофуран |
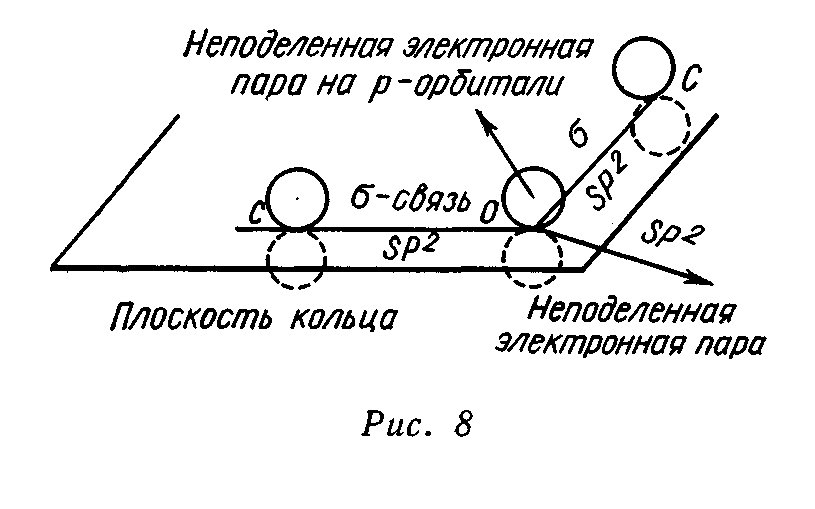
Электронная структура фурана. Фуран является ароматическим соединением с энергией делокализации, равной 92,4 кДж/моль. Ароматические свойства фурана определяются наличием кольцевого секстета π-электронов. Секстет электронов образуется за счет 4 π-электронов двух двойных углерод-углеродных связей и неподеленной пары электронов, поставляемой атомом кислорода. Другая неподеленная пара электронов кислорода остается свободной и в определенных условиях может участвовать в образовании оксониевых соединений. Состояние электронов в атоме кислорода при вхождении его в фурановый цикл соответствует состоянию sp2-гибридизации. Две тригональные гибридные орбитали образуют две δ-связи с соседними атомами углерода. На третьей тригональной орбитали располагается первая неподеленная пара электронов. Все три тригональные орбитали согласно представлениям о sр2-гибридизации лежат в одной плоскости, совпадающей с плоскостью фуранового цикла. Вторая неподеленная пара электронов кислорода находится на чистой р-орбитали, перпендикулярной к плоскости фуранового кольца. Эта неподеленная пара электронов и участвует в сопряжении с π-электронами двойных связей фурана, образуя ароматический секстет электронов. Таким образом, атом кислорода предоставляет для образования фуранового кольца два электрона и одну атомную орбиталь:
Физические свойства. Фуран представляет собой дважды ненасыщенное гетероциклическое соединение, содержащее 4 атома углерода и 1 атом кислорода, значение которых все более возрастает. Это соединение упоминалось ранее под названием фурфуран, но впоследствии за ним твердо укоренилось наименование фуран.
Таблица 6 – Основные физические характеристики
|
Свойства С4Н4О |
Показатели |
|
агрегатное состояние |
жидкость |
|
молярная масса |
68,03 |
|
температура кипения |
31-32оС (760٠мм.рт.ст) |
|
растворимость в воде |
нерастворим |
|
растворимость в спирте и эфире |
легко растворим |
|
запах |
хлороформа |
|
цвет |
бесцветный |
Основные методы получения фурана. В настоящее время известно большое число методов получения фурана и его производных.
1. Замыкание в цикл диенольной формы 1,4-дикарбонильных соединений с выделением молекулы воды:
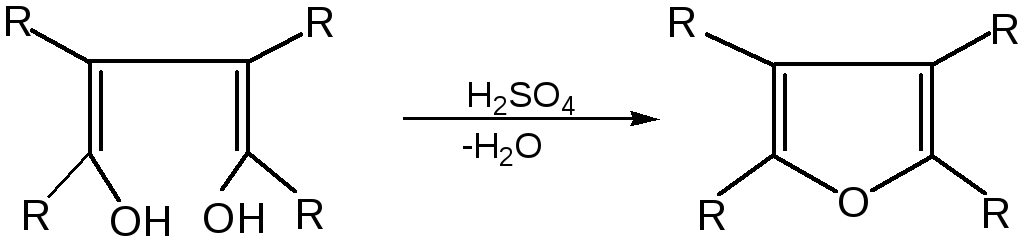
Значение этого метода ограничивается доступностью исходных дикарбонильных соединений.
2. Получение фурана из углеводов. Промышленным сырьем для получения фурана и его производных являются природные углеводы – пентозы, которые могут быть выделены при переработке растительного сырья в различных сельскохозяйственных и текстильных производствах.
Первым продуктом фуранового ряда, получаемым из пентоз, является фурфурол – простейший фурановый альдегид. Фурфурол с хорошим выходом получается при действии разбавленной минеральной кислоты (H2SО4 или Н3РО4) на пентозы: при действии разбавленной минеральной кислоты (H2SО4 или Н3РО4) на пентозы:
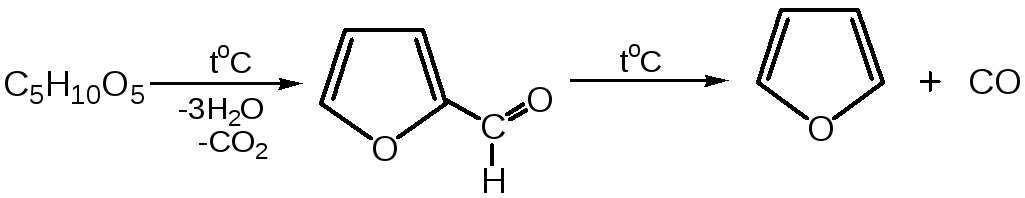
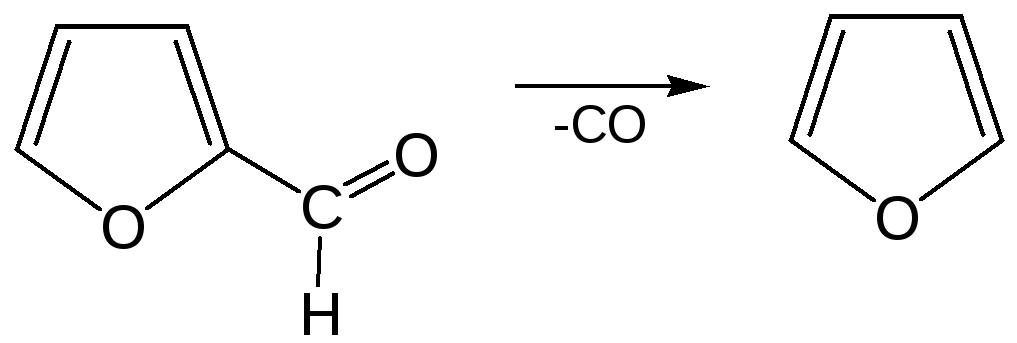
Следующая стадия заключается в декарбонилировании фурфурола. Эта реакция протекает также с хорошим выходом в условиях гетерогенного катализа при температуре 440–460 °С. В качестве катализаторов обычно используются хромит цинка и железа, окись марганца, окись кальция:
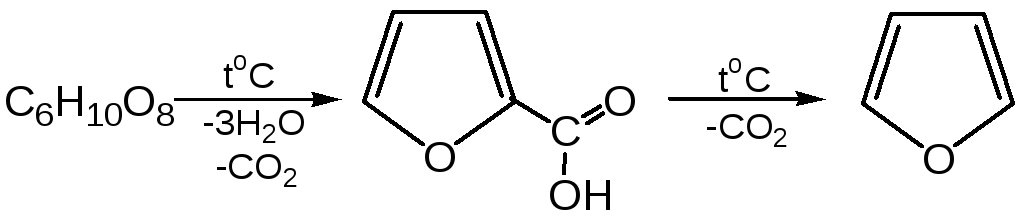
3. Сухая перегонка пирослизевой кислоты.При сухой перегонке слизевой кислоты (2,3,4,5-тетрагидроксигександиовой) образуется пирослизевая кислота, при декарбоксилировании которой (при нагревании в запаянной трубке) получается фуран:
Химические свойства фурана. Наиболее характерными реакциями фурана являются реакции электрофильного замещения. Для фурана характерны реакции галогенирования, сульфирования, нитрования, ацилирования и т.д. Во всех этих реакциях фуран ведёт себя активнее бензола, аналогично ароматическим аминам и фенолам. Электрофильное замещение происходит в положения 2, 5 (-положения), т. е. по месту наибольшей электронной плотности.
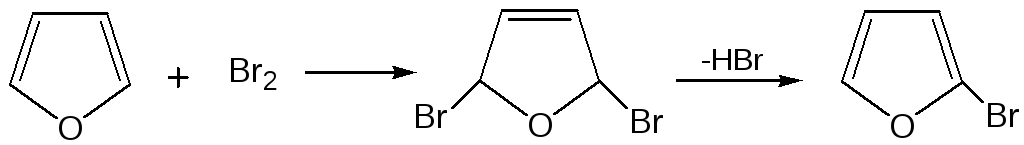
1. Реакция галогенирования. Взаимодействие фурана с галогенами при низкой температуре происходит через промежуточную стадию присоединения молекулы галогена в положения 2, 5 фуранового кольца. Образующиеся продукты присоединения отщепляют галогеноводород и дают -галогенфураны. При повышенных температурах для галогенирования используют комплексы галогенов с пиридином или диоксаном.
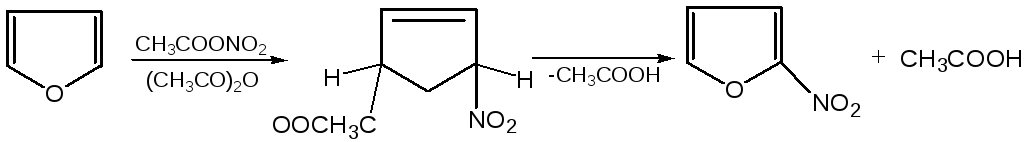
2. Реакция нитрования. Для нитрования используют «мягкий» нитрующий агент – ацетилнитрит (смесь уксусного ангидрида с азотной кислотой) в пиридине, при этом образуются -нитропроизводные:
3.Реакция ацилирования. Реакцию ацилирования по Фриделю-Крафтсу проводят используя более «мягкие» катализаторы (SnCl2, SnCl4, ZnCl2, BF3) и с помощью ангидридов кислот:
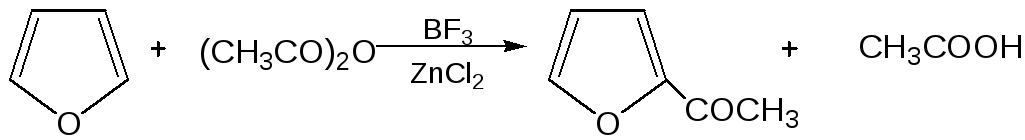
4. Реакция сульфирования. В качестве «мягкого» сульфирующего агента в ряду фурана применяется пиридинсульфотриоксид. Методика применения этого реагента была тщательно разработана А.П. Терентьевым с сотрудниками. При наличии в фурановом кольце электроноакцепторного заместителя можно осуществить сульфирование, применяя непосредственно концентрированную серную кислоту. Фуран-2-карбоновая кислота сульфируется таким образом до фуран-2-карбоновой-5-сульфокислоты с хорошим выходом.
4. Реакция гидрирования. Гидрирование фурана приводит к насыщенным гетероциклическим системам, лишенным ароматических свойств. Фуран гидрируется над никелевым или платиновым катализатором до тетрагидрофурана (ТГФ):
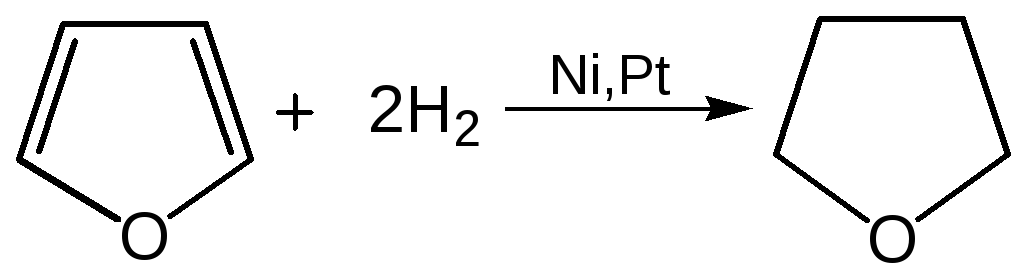
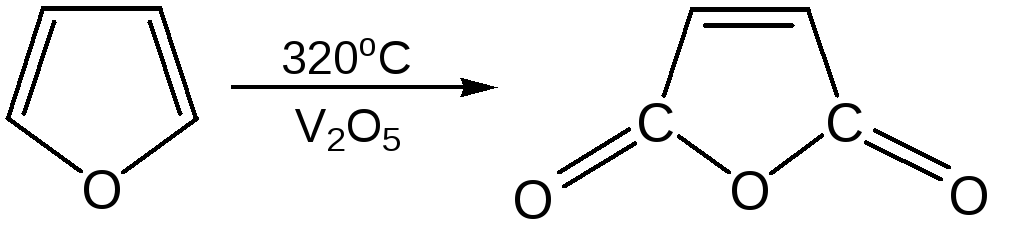
5. Реакция окисления.Фурановое кольцо чувствительно к действию окислителей. Уже на воздухе фуран самоокисляется, одновременно полимеризуясь. В условиях каталитического окисления он с хорошим выходом превращается в малеиновый ангидрид: