
- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
4.4 Шестичленные гетероциклы с несколькими гетероатомами
Пиримидин. Является важнейшим из шестичленных гетероциклов с двумя атомами азота. Пиримидиновый цикл входит в многочисленные природные соединения: нуклеиновые кислоты, витамины, коферменты, является составной частью кольца пуринов, например мочевой кислоты:
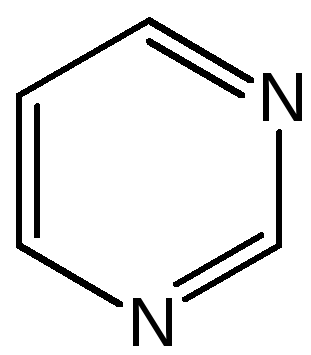
Сопряженная кольцевая система молекулы пиримидина состоит из шести -электронов (4 электрона от атомов углерода и 2 электрона от двух атомов азота) и обеспечивает его высокую ароматичность, энергия сопряжения 109,2 кДж/моль (для бензола 150,7 кДж/моль). Наличие двух электроотрицательных атомов азота в цикле приводит к еще более неравномерному распределению электронной плотности, чем в пиридине. Здесь наблюдается сильное наложение мезомерного и индуктивного эффектов.
В положениях 2,4 и 6, где влияние–I эффекта атомов азота проявляется особенно сильно, будет наибольший положительный электронный заряд, т. е. наименьшая электронная плотность, в то же время положение 5 испытывает наименьшую потерю электронов, где и будет наибольшая электронная плотность. Нуклеофильные реагенты атакуют положения 2, 4, 6, а электрофильные – положение 5 в соответствии с поляризацией этих положений.
Взаимодействие НЭПатомов азота с-электронами в ароматической системе приводит к уменьшению основности атомов азота пиримидина и поэтому она значительно ниже, чем у пиридина. Вследствие этого протонирование по атомам азота пиримидина протекает лишь в очень сильных кислотах и приводит к образованию соли только по одному атому азота. Сам пиримидин инертен к электрофильной атаке. И только введение электронодонорных заместителей (–NH2, –OH, –SH) в положения 2, 4, 6 делает возможным электрофильную атаку положения 5 кольца пиримидина. Пиримидин с двумя электронодонорными заместителями вступает в электрофильное замещение как бензол, а с тремя электронодонорными заместителями в кольце реагирует легко, подобно фенолу. Например, нитрование требует двух электронодонорных групп (при взаимодействии 2 амино-4-гидроксипиримидина с азотной кислотой получается 2-амино-4-гидрокси-5-нитропиримидин):

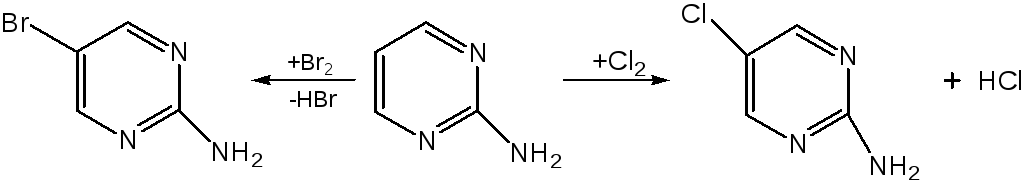
Для галогенирования достаточно одной электронно-донорной группы. Так, 2-аминопиримидин хлорируется и бромируется в положение 5:
Значительно больше распространены в ряду пиримидина реакции нуклеофильного замещения. При этом речь идет о нуклеофильном замещении различных групп, находящихся в положениях 2, 4, 6. Так, при действии амида натрия на 6-метилпиридин образуются 2-амино- и 2,4-диамино-6-метилпиримидин:
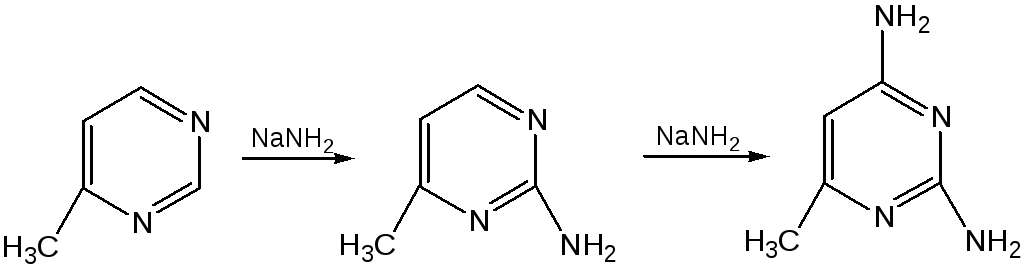
Следует отметить, что алкильные группы в положениях 2, 4 и 6 пиримидина обладают повышенной активностью: легко вступают в конденсацию с альдегидами и в реакцию азосочетания.
Тимин, цитозин, урацил. При гидролизе нуклеиновых кислот получаются три важных производных пиримидина: цитозин (4-амино-2-гидроксипиримидин), тимин (2,4-дигидрокси-5-метилпиримидин) и урацил (2,4-дигидроксипиримидин), которые относятся к группе пиримидиновых оснований. Одним из важных свойств пиримидиновых азотистых оснований является возможность их существования в двух таутомерных формах – лактим-лактамной формах, в зависимости от значения рН среды, при рН 7,0 они находятся в лактамной форме, которая и является главной таутомерной формой. Лактимные и лактомные формы цитозина, тимина и урацила:

Лактимная форма присутствует только в растворах в кислой среде в весьма незначительном количестве. Помимо главных пиримидиновых оснований в составе нуклеиновых кислот открыты минорные пиримидиновые основания: 5-метил и 5-оксиметилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, 4-тиоурацил и др. На долю минорных оснований приходится до 10 % всех нуклеотидов транспортных рибонуклеиновых кислот (т-РНК),что имеет важный физиологический смысл – защита молекулыРНК от действия гидролитических ферментов.
Витамин В1 (тиамин) тоже содержит пиримидиновый цикл, соединенный метиленовой связью с кольцом тиазола:
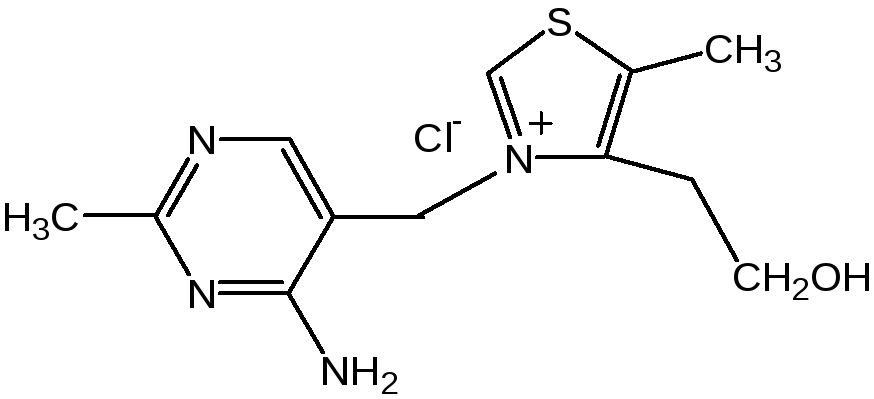
Отсутствие витамина В1 в пище, например, при питании ободранным рисом (он содержится в рисовых отрубях), вызывает известное на востоке нервное заболевание бери-бери. Суточная потребность в витамине В1 для человека – 4 мг. Необходимость в нем связана с тем, что витамин В1 в виде дифосфата ТДФ (тиаминдифосфат) входит в структуру двух сложных ферментных систем: пируват- и -кетоглутаратдегидрогеназных комплексов, катализирующих окислительное декарбоксилирование пировиноградной и -кетоглутаровой кислот и других оксокислот, образующихся при распаде аминокислот с разветвленной боковой цепью. Основное количество витамина В1 человек получает с растительной пищей, а также им богаты печень, почки, мозг.
Диазины. Нуклеофильное замещение галогена в диазинах идет по механизму присоединения – элиминирования (А-Е). Однако существуют примеры нуклеофильного замещения с принципиально другим механизмом. Один из этих процессов – взаимодействие 2-хлоро-4-фенилпиримидина с амидом калия в жидком аммиаке, приводящее к 2-амино-4-фенилпиримидину. Очевидно, что нуклеофильное замещение в данном случае протекает через промежуточное раскрытие цикла. Нуклеофильная атака амид-ионом по положению 6 пиримидин ового кольца объясняет распределение меченых атомов азота в аминопроизводном.
Все хлородиазины более активны, чем хлоропиридины, что обусловлено присутствием второго атома азота, причем факторы скоростей замещения лежат довольно в узком интервале. Наиболее быстро замещение хлора протекает в 2- и 4-хлоропиримидинах, тогда как атом хлора в положении 5 пиримидина наименее активен. Это согласуется с селективной активацией положений 2, 4 и 6 пиримидина, обсужденной выше. Нуклеофильное замещение при С4 в 4-хлоропиримидине протекает через интермедиат, в резонансной стабилизации которого принимают участие два гетероатома.
Пурин. Бициклическая система пурина состоит из двух гетероциклов – пиримидина и имидазола, сконденсированных между собой. Открыл пурин немецкий химик Э. Фишер:
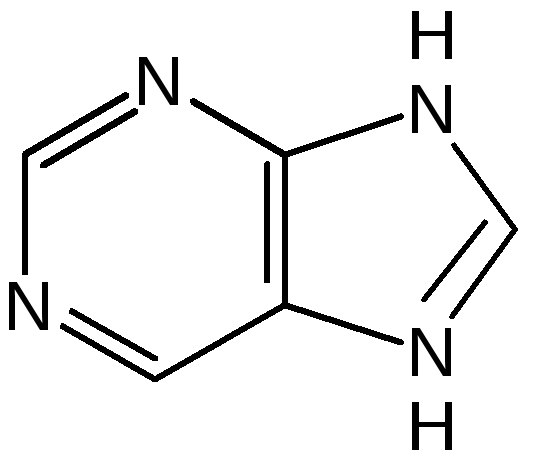
Производные пурина имеют исключительное биологическое значение прежде всего потому, что входят вместе с пиримидиновыми основаниями в структуру нуклеиновых кислот и имеют, таким образом, отношение к программированию синтеза белков и к явлениям наследственности.
Пурин является ароматической системой с энергией делокализации, равной 243,6 кДж/моль (для бензола – 150,7 кДж/моль). Пиримидиновое кольцо в пурине в целом имеет дефицит электронов, а имидазольное кольцо – избыток электронов. Поскольку в пурине имеет место перекрывание -электронных облаков двух моноциклических систем, то электронная плотность в каждом цикле в определенной степени может изменяться в результате перехода электронов из имидазольного цикла в пиримидиновый.
Таким образом, пурин – это ароматическая система сильно делокализованных -электронов, обладающая лабильной «переливающейся» электронной плотностью, в результате чего возможны таутомерные превращения. Кроме этого, эта система является прекрасным донором электронов вследствие низкой энергии высшей заполненной молекулярной орбитали.
Электронно-донорные заместители в кольце пиримидина способствуют восстановлению электронной плотности в имидазольном цикле. Реакции нуклеофильного замещения в пурине идут в основном в положение 8 имидазольного кольца, но возможна атака нуклеофильными реагентами атомов углерода в положениях 2 и 6 пиримидинового цикла. Реакции электрофильного замещения возможны лишь при наличии электронодонорных заместителей в кольце пиримидина, и замещение происходит по углероду С8 имидазольного цикла.
Все реакции пуриновых соединений можно разделить на две группы: реакции по атомам азота и реакции по атомам углерода кольца. Пуриновые основания – сравнительно слабые основания, но электрофильная атака по атому азота весьма распространена, причем выбор атома азота при электрофильной атаке определяется степенью основности того или иного атома азота. В незамещенном пурине таким является N1, в мочевой кислоте алкилированию сначала подвергается N9, а затем N3 и N1; в кислой среде алкилирование замещенных пуринов происходит в основном в положение 9. Аденин, единственный их всех пуринов, показывает небольшую реакционную способность в положении 3.
Аденин (6-аминопурин) является одним из наиболее распространенных пуриновых оснований (амино- и имино-форма):
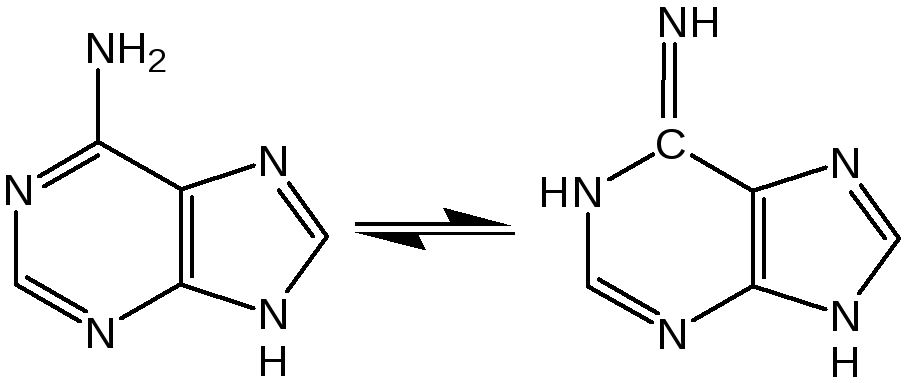
Аденин существует практически в амино-форме, т. к. энергия делокализации для амино-формы наибольшая. В связанном виде аденин содержится в нуклеиновых кислотах и легко получается при их гидролизе. В свободном состоянии встречается в некоторых растениях (чай, сахарная свекла, хмель), в грибах, дрожжах, бактериях и т. д. Аденин является наиболее устойчивым в термодинамическом отношении соединением среди природных пуриновых и пиримидиновых оснований.
Гуанин (2-амино-6-гидроксипурин) вместе с аденином и пиримидиновыми основаниями входит в состав нуклеиновых кислот (лактимная и лактамная формы):
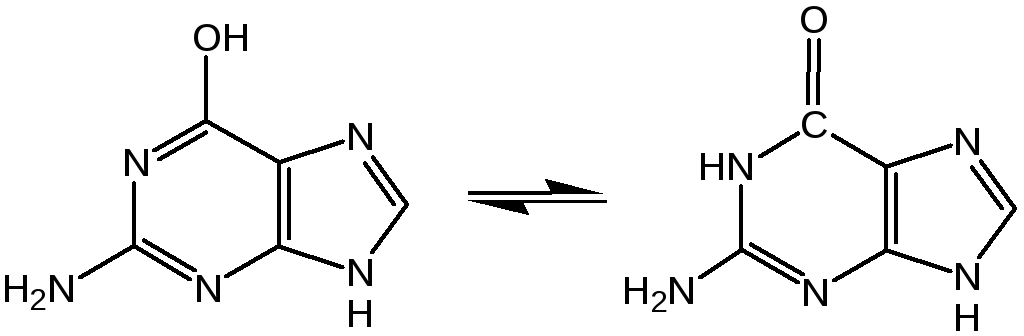
Наиболее устойчивой является лактамная форма, в которой гуанин и находится в природных нуклеиновых кислотах. Значительные количества гуанина содержатся в чешуе и коже рыб, пресмыкающихся и амфибий, от чего зависит их блеск. К таким соединениям относится аденозинтрифосфат (АТФ)– переносчик энергии в биохимических реакциях и фосфорилирующий агент.
Мочевая кислота. Мочевая кислота является первым соединением пуринового ряда, открытым Шееле еще в 1776 г. Однако прошло более ста лет, пока строение ее было точно установлено. В настоящее время принято считать, что мочевая кислота существует в оксоформе.
Она является одним из ключевых соединений в синтезе пуриновых оснований служит мочевая кислота (2, 6, 8-тригидроксипурин), играющая у птиц и рептилий роль вещества, выводящего из организма избыток азота (как мочевина у млекопитающих). Соли мочевой кислоты (ураты) откладывается при неправильной работе организма в суставах и в виде почечных камней. Мочевая кислота (окси- и оксо-форма):

Алкалоиды. Представляют собой азотистые основания природного происхождения с сильным биологическим действием.
Физические свойства. Алкалоиды – основания нерастворимы в воде (кроме кофеина, никотина), но растворимы в органических растворителях. Соли алкалоидов растворимы в воде, но нерастворимы органических растворителях (исключение – хинин HBr растворим в CHCl3).
Химические свойства
