
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1 Основные понятия и признаки химического равновесия
- •3.2 Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1 Основные понятия
- •7.2 Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Упражнения для самостоятельного решения
- •10. Окислительно_восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Упражнения для самостоятельного решения
- •11. Химическая связь.
- •11.1 Ковалентная связь
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Свойства ковалентной связи
- •11.2. Ионная связь
- •11.3 Водородная связь
- •11.4. Металлическая связь
- •11.5. Химическая связь в твердых телах
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3 Природа химической связи в комплексных соединениях
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Упражнения и задачи для самостоятельного решения
1. Дайте определение понятиям: «произведение растворимости», «растворимость»
2. Вычислите произведение растворимости хромата серебра, если в 500 мл воды при 25°С растворяются 0,011 г Аg2 СгО4.(1,2 ∙10-12)
Ответ: 1,2 ∙10-12
3. Произведение растворимости АgС1 равно 1,8∙10-10 Вычислите растворимость соли (моль/л и г/л) в воде и 0,01М КС1. Коэффициенты активностей ионов принять равными 1.
Ответ:В воде: 1,34 ∙10-5моль/л и 1,92 ∙10-3г/л ;
в растворе хлорида калия: 1,8∙10-8 моль/л и 2,58∙10-6г/л.
4. Смешали 10 мл 0,01М раствора СаС12и 40 мл 0.01М раствора оксалата аммония (NH4)2C2O4 . Выпадет ли осадок оксалата кальция, если
Копр(CaC2O4) =2∙10-9 ?
Ответ: да
5. В раствор, содержащий 0,01 моль/л BaCl2, и 0,01 моль/л SrCl2 , медленно добавляют раствор сульфата натрия. Какой осадок выпадет первым,
если Копр(BaSO4) =1,1 ∙10-10; Копр(SrSO4)=3,2 ∙ 10-7?
Ответ: BaSO4
6. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе хлорида серебра, если прибавить к нему столько соляной кислоты, чтобы её концентрация стала равной
0,03 моль/л? Копр (AgCl) = 1,8∙10-10. (2200)
Ответ: в 2200 раз
9. Строение атома
Для описания химических свойств элементов и соединений необходимо знать строение электронных оболочек атомов. Электрон - особая структура, имеющая отрицательный заряд, и обладающая свойствами как частицы, так и волны. Описание движения электрона в поле притяжении ядра атома с помощью классической механики невозможно. Для этого используются методы теории вероятности, общей теории электромагнетизма и квантовой механики.
Существует так называемая волновая функция ψ, связывающая вероятность положения электрона в пространстве с его полной энергией. Соответствующее волновое уравнение Шредингера связывает волновую функцию ψ и полную энергию электрона, потенциальную энергию электрона и его массу. Важно, что квадрат волновой функции |ψ|2 пропорционален вероятности нахождения электрона в определенной области пространства вблизи атома. Такая область получила название атомная орбиталь (АО). Графический образ – квадрат.


Понятие АО вытекает из решения волнового уравнения и определяется как область пространства вблизи атомного ядра, вероятность нахождения электрона в которой максимальна и составляет 90-95%. Данная область имеет определенную форму, размеры и энергию, которые определяются набором 3-х т.н. квантовых чисел(n, l, ml), вытекающих из решения волнового уравнения.
n — главное квантовое число которое последовательно принимает значения 1,2,3,4 …;
l — орбитальное квантовое число которое при n=const последовательно принимает целочисленные значения от 0 до (n – 1);
ml — магнитное квантовое число, которое при n, l = const последовательно принимает целочисленные значения от (–l) до (+l), включая 0;
ms — спиновое квантовое число,которое имеет два значения – либо (+1/2), либо (–1/2).
Главное квантовое число n — определяет размеры и потенциальную энергию атомной орбитали(АО). Совокупность АО с постоянным n определяет энергетический уровень.
Орбитальное квантовое число l ― «ответственно» за форму АО. Орбитальному числу l= 0 отвечают s-орбитали, числу l=1— р-орбитали, числу l =2— d-орбитали. Совокупность АО с постоянным значением l при данном n образует энергетический подуровень .
Магнитное квантовое число ml определяет ориентацию орбитали в пространстве.
Так, для p - энергетического подуровня (l=1) значения ml следующие: –1, 0, +1. Таким образом, можно определить число АО на данном энергетическом подуровне, которое равно 2l + 1.
Подуровень, содержащий s-орбитали, называется s-подуровнем, p-орбитали
р-подуровнем,d- орбитали d-подуровнем,f-орбитали f-подуровнем. Тогда,
на s-подуровне имеется одна АО, на p-подуровне — три АО, на d-подуровне —пять АО, а на f -подуровне— семь АО.
Набор трёх квантовых чисел характеризует атомную орбиталь — объём пространства, в котором электрон может находиться в атоме. Согласно принципу запрета Паули атомная орбиталь не может принять более чем два электрона и обязательно с разнонаправленными спинами
( обозначены стрелками):

вакантная АО АО с неспаренным АО с электронной
электроном парой
Форма орбитали определяется орбитальным квантовым числом. Наиболее распространённый способ изображения орбиталей заключается в графическом предсталении граничной поверхности орбиталей.
Граничная поверхность ― часть электронной орбитали, в которой вероятность нахождения электрона имеет максимальное значение.
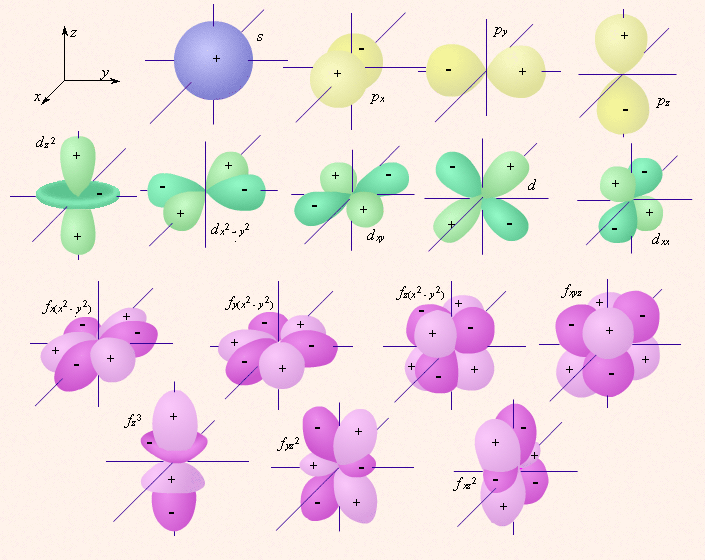
Рис. 1 Изображение с помощью граничных поверхностей s-, p-, d- и f-орбиталей.
s-Орбитали симметричны для любого главного квантового числа n и отличаются друг от друга только размером сферы.
p-Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором
ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d-Орбитали, ориентированные лопастями по осям координат, обозначаются dz² и dx²–y², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz.
Семь f-орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, приведенных на рис.1.
Электрон в атоме имеет собственный вращательный момент механического движения, который также квантуется. В зависимости от знака вращения соответствующее квантовое число (ms) – спиновое - имеет два значения +1/2 и –1/2. Следовательно, состояние каждого электрона в атоме описывается набором 4-х квантовых чисел, три из которых относятся к атомной орбитали, которую он занимает и собственное спиновое квантовое число.
Принципы заполнения атомных орбиталей электронами
1. Принцип наименьшей энергии. Наибольшая устойчивость электронной системы атома соответствует минимуму полной энергии .Электроны в атоме заполняют уровни с наименьшим значением главного квантового числа n, а в пределах уровня сначала заполняются подуровни с наименьшим значением орбитального квантового числа l.
2. Принцип Паули. В атоме не может быть 2-х электронов с одинаковым набором всех четырех квантовых чисел. Другими словами, на АО максимально может разместиться не более 2-х электронов с противоположным значением спиновых чисел.
3. Правило Гунда. При данных значениях главного и орбитального квантовых чисел электроны распределяются в атоме так, чтобы суммарный спин был максимальным, т.е. в пределах данного подуровня электроны заполняют максимальное количество орбиталей.
Правило Клечковского – детализация принципа наименьшей энергии. Заселение подуровней происходит от меньших значений суммы (n+l) к большим значениям (n+l). При одинаковых значениях этой суммы первым заполняется подуровень с меньшим значением главного квантового числа n.
Тогда последовательность заполнения подуровней представляется такой
1s→ 2s→ 2p→ 3s→ 3p→ 4s→ 3d→ 4p→ 5s→ 4d→ 5p→ 6s→ 4f→ 5d→ 6p→ 7s→ 5f→6d.
Существует два основных вида составления электронных состояний нейтральных атомов или простых ионов.
1. Электронная формула (электронная конфигурация). Для нейтрального атома число электронов равно заряду ядра этого атома. Эти электроны, в соответствии с принципами заселения, размещаются на вакантных энергетических подуровнях(ЭПУ) и записываются слева направо в порядке увеличения энергии ЭПУ. Так, для атома кремния порядковый номер 14. Тогда электронная формула нейтрального атома
будет иметь вид: Si 1s22s22p63s23p2. Часто используется сокращенная запись, в которой невалентные электроны обозначаются через устойчивую конфигурацию предшествующего благородного газа. Для кремния это неон. В таком случае можно записать: Si [Ne] 3s23p2.




2. Второй формой записи электронных состояний является энергетическая диаграмма, которая отражает различие в энергии энергетических подуровней и степень их заполнения электронами.
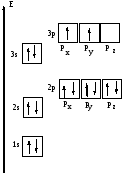
Электронные конфигурации простых катионов и анионов получаются путем удаления или добавления определенного числа электронов на валентные АО. Так, для хлора электронная формула нейтрального атома1s22s22p63s23p5. Для аниона Cl- добавляется один электрон 1s22s22p63s23p6 . Для степени окисления хлора +5 необходимо удалить 5 электронов с р-подуровня: 1s22s22p63s23p0.
При составлении электронных формул d-элементов нужно учитывать тот факт, что при наличии хотя бы одного электрона на (n–1)d-ЭПУ, энергия этого подуровня становится меньше, чем энергия ns валентного подуровня. Соответственно, при образовании катионов первыми будут «уходить» электроны именно с ns-подуровня. Так, сокращенная электронная формула нейтрального атома титана: Ti[Ar]3d24s2, для Ti (+2) формула иона будет следующей: [Ar]3d24s0.Для некоторых элементов оказывается энергетически выгодным переход электронов с ns ЭПУ на (n–1)d энергетический подуровень. В частности, такая ситуация реализуется для атомов хрома, молибдена, меди, серебра и т.д. Например, хром имеет следующую конфигурацию валентных ЭПУ: [Ar]3d54s1.
Изоэлектронные состояния реализуются для близко расположенных атомов в Периодической таблице в различных степенях окисления, при которых в них содержится равное число электронов. Так, атом водорода в степени окисления (-1) имеет электронную формулу 1s2. Такую же конфигурацию будут иметь и атом гелия, и катионы лития(+1), бериллия(+2), бора (+3).
Геометрические и энергетические характеристики атомов.
При движении по периоду слева направо возрастает как заряд ядра атомов, так и суммарный заряд электронов. Следовательно, сила притяжения между ядром и электронами, в соответствии с законом Кулона, возрастает, тогда валентные подуровни будут «сжиматься» и размеры атомов будут уменьшаться. В таком случае затраты энергии для отрыва валентных электронов будут увеличиваться. Ранее величина, характеризующая энергию отрыва наиболее слабо связанного электрона от нейтрального атома, носила название первый потенциал ионизации (I1)и измерялась в электронвольтах (эВ/атом). В настоящее время используется понятие ― энергия ионизации (Ei) — энергия, затрачиваемая для образования 1 моль однозарядных катионов из нейтральных атомов и измеряемая в кДж/моль. Энергия ионизации всегда затрачивается, т.е. является эндотермическим процессом. Естественно, обе этих величины будут увеличиваться по периоду, хотя и не вполне монотонно. С этих же позиций кажется вполне очевидным, что при движении сверху вниз по группе размеры атомов увеличиваются, а энергия ионизации уменьшается.
С другой стороны, атомы некоторых элементов могут принимать электроны с образованием анионов. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону ( в электронвольтах на атом) или энергией сродства к электрону (в кДж/моль). Этот эффект может быть как эндотермическим, так и экзотермическим.
Полусумма энергий ионизации и сродства к электрону характеризует меру способности атома смещать к себе электронную плотность от других атомов. Эта величина называется электроотрицательностью Обычно электроотрицательность выражается в условных единицах. Минимальные значения (0,7–0,8) соответствуют щелочным металлам, максимальные – активным неметаллам (у фтора 4, у кислорода 3,5). Cлева направо по периоду значения χ увеличиваются, а сверху вниз по группе уменьшаются. В таблице 1 Приложения представлена относительная электроотрицательность элементов по Полингу.
