
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1 Основные понятия и признаки химического равновесия
- •3.2 Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1 Основные понятия
- •7.2 Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Упражнения для самостоятельного решения
- •10. Окислительно_восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Упражнения для самостоятельного решения
- •11. Химическая связь.
- •11.1 Ковалентная связь
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Свойства ковалентной связи
- •11.2. Ионная связь
- •11.3 Водородная связь
- •11.4. Металлическая связь
- •11.5. Химическая связь в твердых телах
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3 Природа химической связи в комплексных соединениях
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
12.4. Устойчивость комплексных соединений
Все реакции образования комплексов в водном растворе обратимые. Состояние равновесия образования комплекса при T=const по закону действующих масс количественно характеризуется общей константой устойчивости (β). Константа устойчивости определяет меру общей устойчивости комплекса по отношению к устойчивости аквакомплекса. Для реакций образования аквакомплексов в водном растворе общие константы устойчивости приняты равными нулю.
Константа (или Ку) является термодинамической характеристикой устойчивости комплекса в растворе (см. табл. 6 Приложения), Величина, обратная константе образования, называется константой нестойкости комплекса Kн = 1/ . Величина константы образования является мерой устойчивости комплекса. Так, комплекс [Co(NH3)6]3+ более устойчив, чем [Cu(NH3)4]2+, поскольку константы устойчивости у них соответственно равны:1,991035 и 1,071022.
Поскольку образование комплексного иона происходит в результате обмена воды гидратированного иона на соответствующие лиганды, более точно процесс комплексообразования называется обменом лигандов.
Константа равновесия, соответствующая суммарной реакции:
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ +4H2O ,
является суммарной константой образования или константой устойчивости данного комплекса β4 (или Ку):у(β)=1/Кн; рКу=рКн, где Кн—константа нестойкости (диссоциации).

12.5. Свойства комплексных соединений
Окраска комплексных соединений
Поглощение света комплексными соединениями d- элементов теория кристаллического поля объясняет переходом электронов с t2g-подуровня на eg-подуровень в октаэдрических комплексах и с eg-подуровня на t2g-подуровень в тетраэдрических комплексах. При этом поглощается квант света, энергия которого равна энергии расщепления: h=, где h- постоянная Планка, ― частота колебаний. Энергия расщепления, таким образом, оказывается математически связана с частотой колебания света в максимуме поглощения и, следовательно, с длиной волны максимума поглощения: =/h и =с/, где с― скорость света.Окраска комплекса зависит от его состава и строения, и определяется длиной волны max , отвечающей максимуму полосы поглощения и интенсивностью полосы. В спектрах поглощения комплексных соединений d-элементов имеются полосы поглощения низкой интенсивности, которые проявляются в видимой области, а иногда несколько сдвинуты в фиолетовую область. Их появление связано с электронными переходами в незаполненных d- орбиталях.
Положение полосы поглощения определяется величиной расщепления в кристаллическом поле. Изъятие из потока света, падающего на поглощающее свет вещество, части энергии, отвечающей поглощённой длине волны, приводит к тому, что возникает окрашивание, соответствующее действию на глаз человека непоглощённых длин волн. Например, из солнечного спектра раствором [Ti(H2O)6]3+ поглощаются зелёные волны, поэтому мы воспринимаем растворы комплексов Ti3+ как имеющие красно-фиолетовое окрашивание (см. табл. 8 Приложения). Невозможностью
d-электронных переходов объясняется отсутствие или её низкая интенсивность у следующих комплексных соединений: [Au(CN)4], [Co(CN)6]3, [Zn(NH3)4]2+.
Магнитные свойства комплексных соединений
Молекулы с целиком заполненными электронными оболочками не обладают магнитными свойствами, так как не имеют вырожденных состояний, способных расщепляться под действием магнитного поля. Но, поскольку магнитное поле индуцирует в заполненных оболочках небольшой магнитный момент, противоположный внешнему полю, такие молекулы выталкиваются из магнитного поля. Такие молекулы называются диамагнитными. Молекулы, имеющие неспаренные электроны, втягиваются в магнитное поле и называются парамагнитными.
Наиболее существенной с химической точки зрения величиной является молярная магнитная восприимчивость м.. Магнитную восприимчивость измеряют экспериментально. Используя найденное значение, в соответствии с теорией магнитной и электрической поляризации можно вычислить величину магнитного момента:
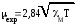
Значение магнитного момента(теор) для числа «n» неспаренных электронов, равного 1,2,3,4,5 равно соответственно:1,73; 2,83; 3,87; 4,90; 5,92 магнетонов Бора(B). Например, высокоспиновый комплекс марганца [Mn(H2O)6]2+ должен иметь
5 неспаренных электронов (d5-конфигурация), т.к. магнитный момент равен 5,92 магнетонов Бора
Кислотно-основные свойства комплексных соединений
При координации молекул воды ионами металла диссоциация воды усиливается, при этом протоны выталкиваются из внутренней сферы аквакомплексов, и образуются гидроксокомплексы, а раствор приобретает кислые свойства. Например, в растворах солей алюминия протекают реакции:
[Al(H2O)6]3++ H2O = [Al(H2O)5OH]2+ + H3O+
По таким схемам происходит гидролиз солей металлов, дающих слабые основания.
Аммиак в водном растворе обладает основными свойствами:
NH3 ∙ H2O + H2O = NH4+ + OH + H2O
В случае координации аммиака ионами металла в небольшой степени происходит диссоциация его молекулы по кислотному типу:
[Pt(NH3)6]4+ +H2O = [Pt(NH3)5NH2]3+ + H3O+
Интенсивность кислотных и основных свойств комплексных соединений зависит от размера, заряда и поляризационных свойств центрального иона, от величины заряда комплексного иона, от устойчивости комплекса в растворе, от строения комплекса и характера взаимного влияния координированных групп. Чем выше заряд центрального иона, тем сильнее выражены кислотные свойства комплекса, а основные слабее. Так, ион [Cr(H2O)6]3+ способен проявлять более сильные кислотные свойства, чем ион [Zn(H2O)6]2+. Ион [Co(NH3)6]3+, содержащий Co3+ , почти нейтрален, а ион [Pt(NH3)5Cl]3+, содержащий Pt4+, имеет сильные кислотные свойства. Чем выше заряд комплексного катиона, тем сильнее отталкивается протон и сильнее кислотные свойства. Ион [Cr(Н2О)6]3+ проявляет более сильные кислотные свойства, чем ион [Cr(H2O)4Cl2]+ , а ион [Co(NH3)5(H2O)]3+ — более сильные кислотные свойства, чем ион [Co(NH3)4(NO2)(H2O)]2+.
Основные свойства комплексного катиона при увеличении его заряда, наоборот, ослабевают.[Pt(NH3)5OH]3+ проявляет более слабые основные свойства, чем ион [Co(NH3)5OH]2+.
Пример 1. Составьте координационную формулу комплексной соли состава
Co(NO3)3 ∙ Cl ∙4NH3 , если в растворе этой соли не обнаружены ионы кобальта, нитрата и аммиака. Весь хлор, содержащийся в составе этой соли, образует хлорид серебра при взаимодействии с раствором нитрата серебра. Измерения электрической проводимости показывают, что молекула соли диссоциирует на два иона.
Решение
Так как ионы кобальта и NO3- , а также аммиак не обнаружены в растворе, они образуют внутреннюю сферу комплексного соединения. Два иона, на которые диссоциирует комплексная соль представляют собой комплексный ион [Co(NH3)4(NO3)2]+ и ион Cl-. Координационная формула соли:
[Co(NH3)4(NO3)2]Cl . Координационное число кобальта равно 6. Степень окисления кобальта (x) равна: x + 0 +(–1)2 = +1 x = +3
Пример 2 Определите тип гибридизации центрального атома в комплексном ионе
[Cr(CN)6]3-
Решение

Cr 3+ имеет две свободные 3d –, одну 4s –и три 4р – орбитали, которые они предоставляют для электронных пар лигандов, при этом осуществляется
d2sp3- гибридизация.

Пример 3 Составьте энергетическую диаграмму образования связей в октаэдрическом комплексе [FeF6]3- ,укажите тип гибридизации орбиталей центрального атома.
Решение
Fe+3 =[18Ar]3d54s04p04d0 (акцептор). F- ― донор. 6 σ–связей.

Рис.17. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [FeF6]3-.
Комплекс высокоспиновый, парамагнитный, лиганд слабого поля - гибридизация sp3d2 . Комплекс бесцветный.
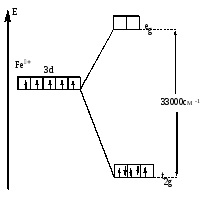
Пример 4 Составьте энергетическую диаграмму образования связей в октаэдрическом комплексе [Fe(CN)6]3- . Укажите тип гибридизации орбиталей центрального атома.
Решение Fe+3 =[18Ar]3d54s04p04d0 (акцептор). CN- - донор. 6 σ–связей.
 ―
―
Рис.18. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [Fe(CN)6]3-.
Комплекс низкоспиновый, лиганд сильного поля – гибридизация d2sp3.Комплекс окрашенный.
Пример 5. Определите окраску комплексного иона [Cr(H2O)6]3+ , если энергия расщепления энергетических уровней равна 209,5 кДж/моль.
Решение:
При переходе электронов с t2g – подуровня на eg - подуровень в октаэдрических комплексах поглощается квант света, энергия которого равна энергии расщепления: Δ = hν, где h― постоянная Планка, h = 6,63 ∙10-34 Дж∙ с, а ν ― частота колебаний света в максимуме поглощения. ν = с/ λ, где λ ― длина волны максимума поглощения, а с― скорость света ( с = 3,0 109м/с). Энергия электронного перехода Е = Δ/NA, где NA ― число Авогадро (NA=6,02∙1023 моль-1). Тогда:
λ = h∙c∙ NA/ Δ = 6,63 ∙10-34 Дж∙ с∙ 3,0∙ 108 м/с∙ 6,02∙1023 моль-1 ∙109 нм/м / 209500 Дж= =571 нм.
Согласно таблице 8 Приложения этой длине волны соответствует цвет поглощаемого излучения ― желто-зеленый, а наблюдаемый (дополнительный) цвет―фиолетовый.
Пример 6. Определите число неспаренных электронов в низкоспиновом комплексе [Fe(CN)6]3+ по следующим экспериментальным данным: молярная магнитная восприимчивость χм = 0,0012.
Решение:


По величине молярной магнитной восприимчивости вычисляем величину магнитного момента:
___ _________
μ = 2,84 √ χмТ = 2,84 √ 0,0012·298 = 1,7. магнетонов Бора. Такая величина соответствует одному неспаренному электрону.
Пример 7. Рассчитайте, выпадет ли при 250С осадок сульфида серебра (I) , если смешать равные объемы 0,001 М раствора K[Ag(CN)2], содержащего KCN с концентрацией 0,124 моль/л и раствор Na2S с концентрацией 0,004 моль/л. Общая константа устойчивости комплекса равна β2 =1,6 · 107. ПР(Ag2S) = 7,2 · 10-50.
Решение: Ag + + 2CN- = [Ag(CN)2]-
β2 = [Ag(CN)2]- / [Ag+] ∙ [CN-] , Отсюда: [Ag+] = [Ag(CN)2]- / β2 ∙ [CN-]2
Поскольку смешали равные объемы двух растворов, концентрации компонентов уменьшаются в 2 раза. Итак: [Ag+] = 5 ∙10-4 / 1,6 ∙107∙ 0,062 = 5,04 ∙ 10-10
[S2-] = 0,002 моль/л.Произведение [Ag+]2∙[S2-] равно:(5,04 ∙10-10) 2 ∙ 0,002 =5,08 ∙10-23 .
Так как 5,08 ∙10-23 > ПР(Ag2S) = 7,2 ∙10-50 осадок выпадет.
