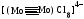- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1 Основные понятия и признаки химического равновесия
- •3.2 Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1 Основные понятия
- •7.2 Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Упражнения для самостоятельного решения
- •10. Окислительно_восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Упражнения для самостоятельного решения
- •11. Химическая связь.
- •11.1 Ковалентная связь
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Свойства ковалентной связи
- •11.2. Ионная связь
- •11.3 Водородная связь
- •11.4. Металлическая связь
- •11.5. Химическая связь в твердых телах
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3 Природа химической связи в комплексных соединениях
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Упражнения для самостоятельного решения
1. Определите степень окисления хрома в следующих соединениях:
Сг2О3 ,К2Сг2О7 ,Сг2(SO4)3,Fe(CrO2)2 .
2. Укажите, какие из приведенных процессов представляют собой окисление и какие — восстановление:
а)S→ SO42- ; б)Br2 → 2Br -; в)V2+→ V03- ; г)Cl-→ ClO3- .
3. Укажите, какие из следующих реакций относятся к окислительно-восстановительным:
а)NH4Cl= NH3 + HCl; б)2K2CrO4+ H2SO4 = К2Сг2O7+ К2S04+ Н2О;
в) Fe + S = FeS ; г) H2 + Cl2 = 2 HCl.
4. Укажите, в каких из следующих реакций азот является окислителем, в каких— восстановителем:
а)N2+O2= …; б)N2 + Li =… ; в)N2+Mg = … г)N2 + H2= …
5. Составьте уравнения полуреакций:
а)MпО4 -→ Mnz+ (рН<7); б)Cr02- → СгО4 2- (рН>7); в)SO32-→ SO4 2- (рН=7).
6. Закончите уравнения .реакций:
а) HClO3 →ClO2 + HClO4 + Н20 ; б)NH4NO3 →N2О + H20;
в)KI+ K2Cr207+ H2.SO4 →.I2 + . . .; г)Al + HNO3 →NH4NO3 + ...
7. По приведенным ниже полуреакциям составьте уравнения окислительно-восстановительных реакций в молекулярном виде:
a)lO Fe2+ → lOFe3+ + 10e
2МпО4- + 16Н+ + 10е →2Mn2+ + 8Н2О
б)3Mg° → ЗMg2+ +6e
SO4 2- + 8Н+ + 6е → S0 + 4Н2О
8. Напишите следующие окислительно-восстановительные реакции:
а)Na2S + К2 Сг2 О7 + Н2S04 →… ; б)Н202 + KI →… ;
в)РН3.+ KMnO4 + HCl → …. ; г) NaClO + CrCL3 + NaOH →. . .
9. В 1 л раствора содержится 10г HCl04 .Вычислите нормальную концентрацию
HClO4 , исходя из реакции: SO2 + HClO4 + Н20 → HCl + Н2SO4
Ответ: c(1/8HClO4) = 0,8 моль/л.
10. Какой обьём 0,1Н К2Сг207 потребуется для окисления 20мл 0,02М Na2SО3 в кислой среде?
Ответ: 8мл.
11. Химическая связь.
Химическая связь – это совокупность сил между атомами, образующая устойчивые системы: молекулы, ионы, радикалы.
Условием образования химической связи является понижение полной энергии системы взаимодействующих атомов.
Основные типы химической связи: ковалентная, ионная, металлическая, водородная.
11.1 Ковалентная связь
Для квантово-механического описания ковалентной связи используется два метода: метод валентных связей и метод молекулярных орбиталей.
Метод валентных связей
Основные положения метода:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
3. При образовании молекулы электронная структура составляющих её атомов в основном сохраняется, а все химические связи в молекуле могут быть представлены набором фиксированных(локализованных) двух центровых двухэлектронных связей. (не для всех соединений).
В целом, электронная структура молекулы выглядит как набор различных валентных схем(метод локализованных пар).
Ковалентная связь образуется за счет перекрывания электронных облаков связываемых атомов. Существуют разные способы перекрывания этих электронных облаков. Если два атома обобществляют две или три электронные пары, то образуется кратная связь. При образовании кратных связей электронные облака могут перекрываться разными способами.
1. Прямое перекрывание: В этом случае единственная область перекрывания электронных облаков лежит на прямой, соединяющей ядра атомов. Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. В зависимости от вида перекрывающихся облаков могут образоваться s-s,
s-p, p-p, s-d, p-d σ-связи (рис.2).

σ-связь σ-связь σ -связь
Рис.2 Образование σ-связи
Между двумя атомами в химической частице возможна только одна σ-связь. Все
σ-связи обладают осевой симметрией относительно межъядерной оси. Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи. Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы.
При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи, образуются π-связи.
2. Боковое перекрывание: перекрывание атомных орбиталей происходит по обе стороны от межъядерной оси – образуется π–связь. Варианты образования π–связи:
p-p, p-d, d-d (рис.3).

π –связь π –связь δ-связь
Рис.3 Образование –π и –δ связей
π-Связь –ковалентная связь между атомами, образованная при боковом перекрывании их электронных облаков. В этом случае две области перекрывания электронных облаков находятся по разные стороны от плоскости, в которой лежат ядра связываемых атомов. Как и в случае σ-связи, в зависимости от вида перекрывающихся облаков могут образоваться различные разновидности
π-связи: p-p, p-d, d-d. π-связи.
π –Связь никогда не образуется, если нет σ–связи. π-Связи могут быть лишь в молекулах с кратными связями— двойными, тройными, четверными.
В результате этого между атомами возникают кратные связи:
Одинарная (σ) (F−F); двойная (σ +π)( O=O); тройная (σ + π + π) (N≡N).
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи. Помимо σ- и π-связей, возможно образование еще одного вида связи - δ-связи(рис.3). Обычно такая связь образуется после образования атомами σ- и π-связей при наличии у атомов d- и f-орбиталей путем перекрывания их "лепестков" сразу в четырех местах.В результате кратность связи может возрасти
до 4-5. Например, в диамагнитном ионе [Mo2Cl8]4- между атомами молибдена образуются
четыре связи. Если принять, что ось z проходит через атомы Мо, то возникновение связи можно объяснить следующим образом: σ -связь образуется перекрыванием dz2-орбиталей, две π - связи взаимодействием dxz и dyz - орбиталей и δ-связь—
перекрыванием dxy-орбиталей: