
- •32. Галогеноводородные кислоты, их соли: строение, получение и химические свойства. Соединения, галогенов в положительной степени окисления. Биологическая роль галогенов.
- •3. Состояние вещества. Критерии, определяющие состояние вещества:
- •9. Ионная связь, ее свойства. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризуемость и поляризующее действие ионов, их влияние на свойства веществ.
- •8.Ковалентная связь, ее свойства и основные характеристики.
- •7. Типы химической связи. Металлическая связь, общ. Физ. И химич. Свойства металлов.
- •12. Механизм процесса растворения. Тепловой эффект растворения. Растворимость твёрдых веществ в воде и других растворителях.
- •15. Состав и строение молекул воды. Полярность молекул. Водородная связь. Ассоциации молекул воды. Аномалии воды, их объяснение. Роль воды в биологических процессах.
- •16. Основные положения тэд. Причины и механизмы тэд с различным типом химической связи. Сольватация (гидратация) ионов.
- •17. Степень электролитической диссоциации. Сильные и слабые электролиты. Истинная и кажущаяся степень диссоциации. Коэффициент активности. Константа диссоциации.
- •19. Константы кислотности и основности. Электролитическая диссоциация воды. Ионное произведение воды, pH среды. Индикаторы. Буферные растворы. Гидролиз солей. Константа гидролиза.
- •20. Строение комплексных соединений, их классификация и номенклатура.
- •21. Электролитическая диссоциация комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений.
- •22. Классификация окислительно-восстановительных реакций. Правила составления уравнений окислительно-восстановительных реакций. Методы расстановки коэффициентов.
- •23. Электродный потенциал. Понятие о гальваническом элементе. Уравнение Нернста. Роль среды в протекании окислительно-восстановительных процессах.
- •25. Сера, ее аллотропные модификации. Бинарные соединения серы, их получение и строение молекул. Серная кислота, строение молекул, получение.
- •26. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами). Представление о строении и химических свойствах других серосодержащих кислот.
- •28. Азотная и азотистая кислота, их соли: строение и получение. Химические свойства разбавленной и концентрированной азотной кислоты (реакции с металлами и неметаллами), нитратов и нитритов.
- •27. Азот, его бинарные соединения, их получение и строение молекул. Получение и свойства аммиака. Представления об азотных удобрениях.
- •31.Галогены, их бинарные соединения: получение и строение молекул. Особые свойства фтора и его соединений.
- •33. Металлы групп ia и iia: простые вещества, их реакционная способность. Строение, свойства и биологическая роль соединений щелочных и щелочноземельных металлов.
- •34. Металлы групп iiia и iva: простые вещества, их реакционная способность. Строение, свойства их бинарных соединений и гидроксидов.
- •1.Основные хим.Понятия: относительная молекулярная и атомная массы, моль, молярная масса, молярный объем, число Авогадро.
- •29.Фосфор его аллотропные модификации. Бинарные соединения фосфора, их получение и строение молекул.
26. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами). Представление о строении и химических свойствах других серосодержащих кислот.
1.Серная кислота - это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислота в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду и перемешивать раствор.
Раствор серной кислоты в воде с содержанием Н2SО4 менее 70% называется разбавленной серной кислотой. Раствор серной кислоты в воде с содержанием Н2SО4 более 70% обычно - концентрированная серная кислота.
Химические свойства
Кислотно-основные свойств. Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Ее диссоциация (ионизация) выражается следующим уравнением: H2SO4 ↔ 2Н+ + SO2-4. Разбавленная серная кислота реагирует:
а) с основными оксидами: MgO + H2SO4 = MgSO4 + Н2О;
б) с основаниями: H2SO4 + 2NaOH = Na2SO4 + 2Н2О;
в) с солями: H2SO4 + ВаС12 = BaSO4↓ + 2HC1
SO42-+Ba2+=BaSO4↓ Это качественная реакция на сульфат-ион. (белого осадка BaSO4)
Окислительно-восстановительные свойства.
Н+ - окислитель, 2Н+ + 2е- → Н20↑
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород: Zn +H2SO4=ZnSO4+ H2↑
Металлы, которые в электрохимическом ряду напряжений находятся после водорода (Сu, Ag, Hg, Аu), не реагируют с разбавленной серной кислотой: Сu + H2SO4 р ≠
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Сu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты — SO2.
Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты — SO2, S, H2S: +6 +2 +4 +6 +2
Zn° + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O /// 3Zn° + 4H2SO4 = 3ZnSO4 + S°↓ + 4H2O
+6 +2 -2
4Zn° + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
На холоду концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах: Fe + H2SO4 конц. ≠ (на холоду)
Концентрированная серная кислота H2SO4 окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
+6 +4 +6 +4
S° + 2H2SO4 конц.= 3SO2↑ + 2H2O /// С0 + 2H2SO4 конц.= 2SО2↑ + СО2↑ + 2Н2О
S+6 – окислитель ; ///S+6 +8е-→S-2 ; S+6 +6е-→S0 ; S+6 +2е-→S+4///
Используют в химической промышленности для получения красителей, минеральных удобрений, взрывчатых веществ, искусственного шелка, солей, глюкозы, кислот, для очистки нефтепродуктов, для осушки газов, для получения удобрений, различных красителей, при производстве СМС, пластмасс, тканей и лекарственных пр-ов. в качестве водоотнимающего средства. Электролит в автоаккумуляторах.
2.Сероводородная кислота — является слабой двухосновной кислотой, поэтому диссоциирует ступенчато: H2S ↔ Н+ + HS– // HS– ↔ Н+ + S2–
Сероводородная кислота имеет все общие свойства кислот. Она реагирует с:
а) основными оксидами // H2S + СаО = CaS + Н2О
б) основаниями // H2S + NaOH ↔NaHS + Н2О // H2S + 2NaOH ↔ Na2S + 2H2O в) солями // CuSO4 + H2S = CuS + H2SO4 // Cu2+ + H2S = CuS↓ + 2H+
г) металлами: // Ca + H2S = CaS + H2↑.
д) вОВР H2S–вос-ль:H2S+O2,+ Вr2,+КМпО4:H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S0↓+8Н2О
Сероводородная кислота окисляется не только сильными окислителями, такими как кислород, галогены, перманганат калия, но и более слабыми, например солями железа (III), сернистой кислотой и т. д.: 2FeCl3 + H2S→2FeCl2 + S°↓ + 2HC1 ;H2SO3 + 2H2S = 3S°↓+ 3H2O
Некоторые сульфиды имеют характерную окраску: PbS и CuS — черную, CdS — желтую, ZnS, MgS — белую, MnS — розовую. Это свойство их используется в аналитической химии для открытия катионов.
Качественной реакцией Na2S + Pb(NO3)2 = PbS↓+ 2NaNO3 (осадок черного цвета)
Применение Сероводородная вода издавна применяется в медицине для лечения ревматизма и кожных заболеваний. Пестициды в сельском хозяйстве.
3.Сернистая кислота H2SO3 — очень непрочное соединение.
Раствор сернистой кислоты поглощая из воздуха кислород, медленно окисляется в серную кислоту: 2H2SO3 + О2 = 2H2SO4
Сернистая кислота — хороший восстановитель. Свободные галогены восстанавливаются ею в галогеноводороды: H2SO3 + С12 + Н2О = H2SO4 + 2HCI
Может играть роль окислителя. H2SO3 + H2S = 3S↓ + 3H2O
Будучи двухосновной, сернистая кислота образует два ряде солей. Средние соли называются сульфитами, кислые гидросульфитами. 4Na2SO3 = Na2S + 3Na2SO4
Сульфиты калия и натрия применяются для отбеливания некоторых материалов, в текстильной промышленности при крашения тканей, в фотографии. Раствор Са (HSO3)2 (эта соль существует только в растворе) применяется для переработки древесины в сульфитную целлюлозу, из которой получают потом получают бумагу.
3
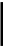 .Тиосерная
кислота.
H2S2O3
, неустойчива. Уже при комнатной
температуре она
распадается. /// H2S2O3
= H2O
+ SO2↑
+ S↓.
Значительно устойчивее ее соли —
тиосульфаты.
Из них
наиболее
употребителен
тиосульфат натрия Na2S2O3·5H2O.
.Тиосерная
кислота.
H2S2O3
, неустойчива. Уже при комнатной
температуре она
распадается. /// H2S2O3
= H2O
+ SO2↑
+ S↓.
Значительно устойчивее ее соли —
тиосульфаты.
Из них
наиболее
употребителен
тиосульфат натрия Na2S2O3·5H2O.
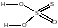
При добавлении к раствору тиосульфата натрия какой-нибудь кислоты, появляется запах диоксида серы и через некоторое время жидкость становится мутной от выделившейся серы. /// Na2S2O3 + 2HC1 = H2S2O3 + 2NaCl
Na2S2O3 – в ОВР вос-ль. /// Na2S2O3 + 4С12 + 5Н2О = 2H2SO4 + 2NaCl + 6HC1
Иначе протекает окисление тиосульфата натрия менее сильными окислителями. Под действием, например, иода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6: I2 + 2Na2S2O3 = 2NaI + Na2S4O6
