
- •32. Галогеноводородные кислоты, их соли: строение, получение и химические свойства. Соединения, галогенов в положительной степени окисления. Биологическая роль галогенов.
- •3. Состояние вещества. Критерии, определяющие состояние вещества:
- •9. Ионная связь, ее свойства. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризуемость и поляризующее действие ионов, их влияние на свойства веществ.
- •8.Ковалентная связь, ее свойства и основные характеристики.
- •7. Типы химической связи. Металлическая связь, общ. Физ. И химич. Свойства металлов.
- •12. Механизм процесса растворения. Тепловой эффект растворения. Растворимость твёрдых веществ в воде и других растворителях.
- •15. Состав и строение молекул воды. Полярность молекул. Водородная связь. Ассоциации молекул воды. Аномалии воды, их объяснение. Роль воды в биологических процессах.
- •16. Основные положения тэд. Причины и механизмы тэд с различным типом химической связи. Сольватация (гидратация) ионов.
- •17. Степень электролитической диссоциации. Сильные и слабые электролиты. Истинная и кажущаяся степень диссоциации. Коэффициент активности. Константа диссоциации.
- •19. Константы кислотности и основности. Электролитическая диссоциация воды. Ионное произведение воды, pH среды. Индикаторы. Буферные растворы. Гидролиз солей. Константа гидролиза.
- •20. Строение комплексных соединений, их классификация и номенклатура.
- •21. Электролитическая диссоциация комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений.
- •22. Классификация окислительно-восстановительных реакций. Правила составления уравнений окислительно-восстановительных реакций. Методы расстановки коэффициентов.
- •23. Электродный потенциал. Понятие о гальваническом элементе. Уравнение Нернста. Роль среды в протекании окислительно-восстановительных процессах.
- •25. Сера, ее аллотропные модификации. Бинарные соединения серы, их получение и строение молекул. Серная кислота, строение молекул, получение.
- •26. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами). Представление о строении и химических свойствах других серосодержащих кислот.
- •28. Азотная и азотистая кислота, их соли: строение и получение. Химические свойства разбавленной и концентрированной азотной кислоты (реакции с металлами и неметаллами), нитратов и нитритов.
- •27. Азот, его бинарные соединения, их получение и строение молекул. Получение и свойства аммиака. Представления об азотных удобрениях.
- •31.Галогены, их бинарные соединения: получение и строение молекул. Особые свойства фтора и его соединений.
- •33. Металлы групп ia и iia: простые вещества, их реакционная способность. Строение, свойства и биологическая роль соединений щелочных и щелочноземельных металлов.
- •34. Металлы групп iiia и iva: простые вещества, их реакционная способность. Строение, свойства их бинарных соединений и гидроксидов.
- •1.Основные хим.Понятия: относительная молекулярная и атомная массы, моль, молярная масса, молярный объем, число Авогадро.
- •29.Фосфор его аллотропные модификации. Бинарные соединения фосфора, их получение и строение молекул.
19. Константы кислотности и основности. Электролитическая диссоциация воды. Ионное произведение воды, pH среды. Индикаторы. Буферные растворы. Гидролиз солей. Константа гидролиза.
Константы кислотности и основности. Водородный показатель
Закон действующих масс применяется и для количественной характеристики кислотно-основных свойств различных веществ. В протолитической теории для этого используются константы кислотности и основности, а в теории электролитической диссоциации – константы диссоциации.
HCN + H2O
[H2O]
KK(HCN)
= KC.[H2O]
=
|
HCN H+ + CN–
Константа равновесия KC в этом случае называется константой диссоциации (или константой ионизации), обозначается К и равна константе кислотности в протолитической теории. K = 4,93.10–10 моль/л |
Степень протолиза слабой кислоты (![]() ) в теории электролитической диссоциации
называется степенью диссоциации
(если только эта теория рассматривает
данное вещество как кислоту).В
протолитической теории для характеристики
основания можно использовать его
константу основности, а можно обойтись
и константой кислотности сопряженной
кислоты. В теории электролитической
диссоциации основаниями считались
только вещества диссоциирующие в
растворе на катион и гидроксид-ионы,
поэтому, например, предполагалось, что
в растворе аммиака содержится "
гидроксид аммония" , а позже – гидрат
аммиака
) в теории электролитической диссоциации
называется степенью диссоциации
(если только эта теория рассматривает
данное вещество как кислоту).В
протолитической теории для характеристики
основания можно использовать его
константу основности, а можно обойтись
и константой кислотности сопряженной
кислоты. В теории электролитической
диссоциации основаниями считались
только вещества диссоциирующие в
растворе на катион и гидроксид-ионы,
поэтому, например, предполагалось, что
в растворе аммиака содержится "
гидроксид аммония" , а позже – гидрат
аммиака
Для характеристики кислотных и основных свойств растворов используется – водородный показатель (pH). pH = –lg[H+]
Водородный показатель – десятичный логарифм числового значения равновесной концентрации в растворе ионов оксония, взятый с обратным знаком. pH = –lg{[H3O+]}. В чистой воде [H3O+] = [OH-] = 10–7 моль/л, следовательно, pH = pOH = 7.
В растворе кислоты pH < 7.В растворе основания pH > 7.
Гидролиз солей – взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Константа гидролиза. случаи гидролиза
соли сильного основания и слабой кислоты, KNO2
Ko(NO2-)
=
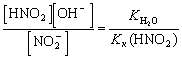 Kh
= Kc.[H2O]
=
Kh
= Kc.[H2O]
=
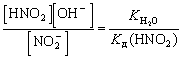
соли слабого основания и сильной кислоты NH4Cl
KK(NH4+) =
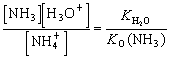 Kh =
Kh =
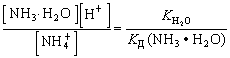
соли слабого основания и слабой кислоты NH4CN.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, показатель уровня кислотности раствора. Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует: H2O + H2O ↔ H3O+ + OH− Или H2O ↔ H+ + OH−
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная (1000 г/л)/(18 г/моль) = 55,56 моль/л.При 22 °C константа диссоциации воды равна 1,8·10−16моль/л. K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 22 °C).Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Индикаторы – вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов (рН). Лакмус (рН=5,0-8,0),метилоранж (рН=3,1-44,4), фенолфталеин (рН=8,2-10,0).
Буферные растворы – это системы, которые препятствуют изменинию рН р-ра при его разбовлении или при добовлении сильных кислот или оснований. Буферные растворы: *смесь 2-х в-в (ацетатный буфер + ее соли либо слабое основание + ее соли- аммиачно-аммонийный буфер NH3·H2O+NH4Cl, NaH2PO4+Na2HPO4), *из одного вещества (Na2B4O7·10H2O--бура)
рН=рКк-ты—lgСк-ты/Ссоли --для кислотно-солевого буфера.
рН=14—рКк-ты+ lgСосн./Ссоли –аммиачно-амфотерный буфер.
