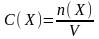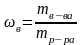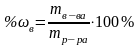- •32. Галогеноводородные кислоты, их соли: строение, получение и химические свойства. Соединения, галогенов в положительной степени окисления. Биологическая роль галогенов.
- •3. Состояние вещества. Критерии, определяющие состояние вещества:
- •9. Ионная связь, ее свойства. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризуемость и поляризующее действие ионов, их влияние на свойства веществ.
- •8.Ковалентная связь, ее свойства и основные характеристики.
- •7. Типы химической связи. Металлическая связь, общ. Физ. И химич. Свойства металлов.
- •12. Механизм процесса растворения. Тепловой эффект растворения. Растворимость твёрдых веществ в воде и других растворителях.
- •15. Состав и строение молекул воды. Полярность молекул. Водородная связь. Ассоциации молекул воды. Аномалии воды, их объяснение. Роль воды в биологических процессах.
- •16. Основные положения тэд. Причины и механизмы тэд с различным типом химической связи. Сольватация (гидратация) ионов.
- •17. Степень электролитической диссоциации. Сильные и слабые электролиты. Истинная и кажущаяся степень диссоциации. Коэффициент активности. Константа диссоциации.
- •19. Константы кислотности и основности. Электролитическая диссоциация воды. Ионное произведение воды, pH среды. Индикаторы. Буферные растворы. Гидролиз солей. Константа гидролиза.
- •20. Строение комплексных соединений, их классификация и номенклатура.
- •21. Электролитическая диссоциация комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений.
- •22. Классификация окислительно-восстановительных реакций. Правила составления уравнений окислительно-восстановительных реакций. Методы расстановки коэффициентов.
- •23. Электродный потенциал. Понятие о гальваническом элементе. Уравнение Нернста. Роль среды в протекании окислительно-восстановительных процессах.
- •25. Сера, ее аллотропные модификации. Бинарные соединения серы, их получение и строение молекул. Серная кислота, строение молекул, получение.
- •26. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами). Представление о строении и химических свойствах других серосодержащих кислот.
- •28. Азотная и азотистая кислота, их соли: строение и получение. Химические свойства разбавленной и концентрированной азотной кислоты (реакции с металлами и неметаллами), нитратов и нитритов.
- •27. Азот, его бинарные соединения, их получение и строение молекул. Получение и свойства аммиака. Представления об азотных удобрениях.
- •31.Галогены, их бинарные соединения: получение и строение молекул. Особые свойства фтора и его соединений.
- •33. Металлы групп ia и iia: простые вещества, их реакционная способность. Строение, свойства и биологическая роль соединений щелочных и щелочноземельных металлов.
- •34. Металлы групп iiia и iva: простые вещества, их реакционная способность. Строение, свойства их бинарных соединений и гидроксидов.
- •1.Основные хим.Понятия: относительная молекулярная и атомная массы, моль, молярная масса, молярный объем, число Авогадро.
- •29.Фосфор его аллотропные модификации. Бинарные соединения фосфора, их получение и строение молекул.
12. Механизм процесса растворения. Тепловой эффект растворения. Растворимость твёрдых веществ в воде и других растворителях.
В 60х гг XIX ст в результате работ Д. И. Менделеева возникает химическая теория растворов (гидратная), в которой процесс растворения рассматривается как сложный физико-химический процесс, приводящий к образованию соединений (сольватов) между растворителем и растворённым веществом. В случае с водой соединения называются гидраты. Менделеев экспериментально подтвердил, что растворение имеет признаки химического явления: однородность системы, тепловые эффекты, изменение окраски, изменение объёма и др. Механизм процесса растворения протекает, если: 1) разрываются связи или силы межмолекулярного взаимодействия в исходных веществах (эндотермично), Q-разрушения; 2) возникают силы взаимодействия между растворённым веществом и растворителем (экзотермично), Q-гидратации.
Qобщий = Qразруш + Qгидратац
В случае растворении нитратов Qразруш > Q гидрат, следовательно Qобщее < 0.
В случае растворения H2SO4 Qгидрат> Qразр, следовательно Qобщее>0.
Растворимость – способность вещества растворяться в воде или в другом растворителе. Количественно выражается числом граммов вещества, которое можно максимально растворить в 100 г растворителя при данной температуре. Например, сахар, C2H5OH, NH3, HCl хорошо растворимы в воде. Многие металлы, инертные газы, CaCO3, AgCl практически нерастворимы в воде. N2, CaSO4 мало растворимы в воде. Растворимость большинства твёрдых веществ, как правило, с повышением температуры увеличивается.
13. Ненасыщ., насыщ. и перенасыщенные р-ры. Кристализация в-в из р-ров: зак-ти, использование для очистки соединений и разделение смесей. Растворимость газов.
Растворы – гомогенные (однофазные) системы одного состава, состоящие из двух или более компонентов. Размеры частиц в растворах <10-8.
Механизм растворения: процесс растворения протекает, если
Разрушаются связи или сила ММВ в исходных в-вах (эндотермический процесс, Qразр.<0)
Врзникают силы взаимодействия между растворенным в-вом и раств-ем (эндотермический процесс, Qгидррат.>0)
По соотношению преобладания числа частиц, переходящих и раствор или удаляющихся из раствора, различают растворы
насыщенные,ненасыщенные,пересыщенные.
По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) — величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества и раствор становится насыщенным. Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы — растворы с небольшим содержанием растворенного вещества; концентрированные растворы — растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе. Поэтому иногда встречаются определения «крепкий», «слабый» растворы в том же самом значении. Можно сказать, что эти определения возникли из практической необходимости. Так, говорят: концентрированный (крепкий) раствор H2SO4 или разбавленный (слабый) раствор H2SO4, но сказать однозначно, какой концентрации раствор серной кислоты нужно считать концентрированным, а какой — разбавленным, точно нельзя.
Количественной характеристикой растворимости является коэффициент растворимости.
Хорошо растворимые (>10 г в-ва в 1 л воды). Малорастворимые ( от 0, 01 до 10 г в-ва в 1 л воды) – СаSO4·Н2О гипс. Практически нерастворимые (<0,01 г в-ва в 1 л воды) – АgCl.
Растворимость в-в зависит от природы растворителя, от природы растворителя в-в, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления – увеличивается.
14. Орг. и неорган. растворители, их применение, физико-хим. характеристики и сольватационные свойства.Концентрация рас-ров .Способы выражения сос-ва р-ров:массовая доля. Молярная и массовая концентрация.
Способы выражения состава растворов.
Молярная концетрация, или молярность - это величина, равная отношению количества растворенного вещества к объему раствора |
|
Раствор, в 1 дм3 которого содержится 1 моль растворенного вещества, называется молярным и обозначается буквой М1 М NaOH – одномолярный раствор.В данном случае 1 дм3 раствора содержит: 1 моль вещества или 1 моль . 40 г/моль = 40 г NaOH. |
|
|
C(X) – молярная концетрация частиц X, моль/дм3. |
n(X) – количество вещества частиц Х, содержащихся в растворе, моль |
|
V – объем раствора, дм3. |
|
Примеры записи молярной концетрации
C(HCl) = 0.1 моль/дм3 |
С(H3PO4) = 0.5 моль/дм3 |
С(H+) = 1 . 10 -5 моль/дм3 |
Массовая доля растворенного вещества
mв-ва – масса растворенного вещества выражается в долях от «0» до «1».
mр-ра – общая
масса раствора может быть выражена
в процентах
mр-ра = mв-ва + mр-ля |
||
Массовая доля, выраженная в процентах, показывает массу растворенного вещества (в г), содержащегося в растворе массой 100 г. |
||