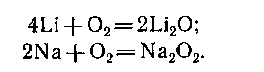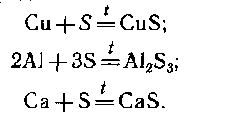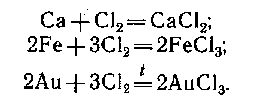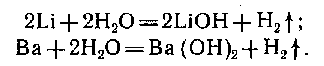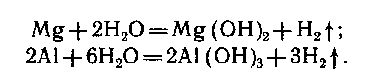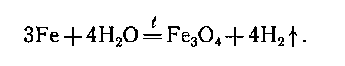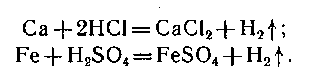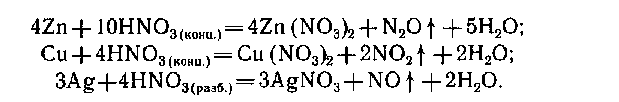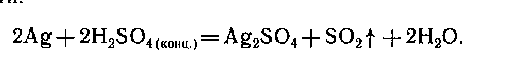- •32. Галогеноводородные кислоты, их соли: строение, получение и химические свойства. Соединения, галогенов в положительной степени окисления. Биологическая роль галогенов.
- •3. Состояние вещества. Критерии, определяющие состояние вещества:
- •9. Ионная связь, ее свойства. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризуемость и поляризующее действие ионов, их влияние на свойства веществ.
- •8.Ковалентная связь, ее свойства и основные характеристики.
- •7. Типы химической связи. Металлическая связь, общ. Физ. И химич. Свойства металлов.
- •12. Механизм процесса растворения. Тепловой эффект растворения. Растворимость твёрдых веществ в воде и других растворителях.
- •15. Состав и строение молекул воды. Полярность молекул. Водородная связь. Ассоциации молекул воды. Аномалии воды, их объяснение. Роль воды в биологических процессах.
- •16. Основные положения тэд. Причины и механизмы тэд с различным типом химической связи. Сольватация (гидратация) ионов.
- •17. Степень электролитической диссоциации. Сильные и слабые электролиты. Истинная и кажущаяся степень диссоциации. Коэффициент активности. Константа диссоциации.
- •19. Константы кислотности и основности. Электролитическая диссоциация воды. Ионное произведение воды, pH среды. Индикаторы. Буферные растворы. Гидролиз солей. Константа гидролиза.
- •20. Строение комплексных соединений, их классификация и номенклатура.
- •21. Электролитическая диссоциация комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений.
- •22. Классификация окислительно-восстановительных реакций. Правила составления уравнений окислительно-восстановительных реакций. Методы расстановки коэффициентов.
- •23. Электродный потенциал. Понятие о гальваническом элементе. Уравнение Нернста. Роль среды в протекании окислительно-восстановительных процессах.
- •25. Сера, ее аллотропные модификации. Бинарные соединения серы, их получение и строение молекул. Серная кислота, строение молекул, получение.
- •26. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами). Представление о строении и химических свойствах других серосодержащих кислот.
- •28. Азотная и азотистая кислота, их соли: строение и получение. Химические свойства разбавленной и концентрированной азотной кислоты (реакции с металлами и неметаллами), нитратов и нитритов.
- •27. Азот, его бинарные соединения, их получение и строение молекул. Получение и свойства аммиака. Представления об азотных удобрениях.
- •31.Галогены, их бинарные соединения: получение и строение молекул. Особые свойства фтора и его соединений.
- •33. Металлы групп ia и iia: простые вещества, их реакционная способность. Строение, свойства и биологическая роль соединений щелочных и щелочноземельных металлов.
- •34. Металлы групп iiia и iva: простые вещества, их реакционная способность. Строение, свойства их бинарных соединений и гидроксидов.
- •1.Основные хим.Понятия: относительная молекулярная и атомная массы, моль, молярная масса, молярный объем, число Авогадро.
- •29.Фосфор его аллотропные модификации. Бинарные соединения фосфора, их получение и строение молекул.
7. Типы химической связи. Металлическая связь, общ. Физ. И химич. Свойства металлов.
В основу теории химической связи положено представление о том, что устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершен.
В основе всех химических реакций лежит стремление атомов завершить свои внешние энергетические уровни, перейти в состояние, характеризующееся наименьшим (из всех возможных) запасом энергии, т.е. в наиболее энергетически выгодное.
Чем меньше запас энергии атома, тем более он устойчив в химическом отношении.
Различают четыре основных типа химических связи: ковалентную, ионную, водородную и металлическую.
Металлическая связь. Модель электронного газа
Металлическая связь ─ связь между положительно заряженными ионами и нейтральными атомами, свободными электронами в металлической кристаллической решетке.
Сходство с ковалентной: есть общие электроны между двумя атомами, а в металлической связи ─ общие электроны для атома всего куска металла.
Сходство с ионной связью: есть положительно заряженные ионы; отличие ─ нет отрицательно заряженных ионов, их выполняют электроны.
Отметим, что металлическая связь не исключает и некоторой доли ковалентности. В наиболее чистом виде металлическая связь характерна только для щелочных и щелочноземельных металлов, для атомов которых число валентных электронов невелико (1—2), а энергии ионизации наиболее низки.
Для кристаллической решетки каждого металла характерно свое, специфическое, повторяющееся во всех направлениях в кристалле расположение ионов в пространстве — элементарная ячейка. Различных вариантов такого расположения — различных типов элементарных ячеек — известно много.
Металлическая химическая связь определяет специфику физических свойств металлов.
Физические свойства металлов
К ним относятся:
высокая (по сравнению с неметаллами) электро- и теплопроводность;
ковкость и пластичность;
способность образовывать при смешивании друг с другом однородные смеси (сплавы);
металлический блеск.
Несмотря на то что в целом у металлов есть много общего, физические свойства конкретных металлов могут различаться очень сильно. Причина этого в различной прочности связи ионов металлов с кристаллической решеткой, что обусловлено различным их размером, эффективным зарядом и расположением в пространстве.
Теплопроводность определяется тем, что колебание узлов кристаллической решетки через свободные электроны передается всему куску металла.
Если температура плавления металла ниже 1000 °С, его принято называть легкоплавким, а если выше — тугоплавким. Самым легкоплавким металлом является ртуть, температура плавления которой составляет —39 °С, а самым тугоплавким—вольфрам, он плавится при температуре более 3400 °С.
При нагревании электропроводность металла снижается.Чемпионом по электропроводности среди металлов является серебро. Наиболее низкая электропроводность среди металлов у марганца.
По твердости металлы различаются очень сильно. Самыми твердыми среди металлов являются молибден и хром. Твердость щелочных металлов крайне низка и не превышает твердости пластилина — их можно легко резать тупым столовым ножом. Пластичность определяется свободными электронами, которые удерживают пласты металла.
Металлический блеск обусловлен отражением лучей спектра света.
Химические свойства.
Все металлы более или менее легко по сравнению с металлами в химических реакциях отдают валентные электроны. Таким образом, простые вещества металлы выступают как восстановители, сами же они при этом окисляются:
Ме – ne → Men+
С чем взаимодействует |
Реакции |
О химической активности металла можно примерно судить по его расположению в ряду активности. 1. С простыми веществами |
1. Комнатная температура
Металлы средней активности реагируют с кислородом при нагревании:
При нагревании металлов с порошком серы образуются соответствующие сульфиды:
Реагируют с галогенами. Условия зависят от активности металла и галогена (комнатная температура для активных металлов, сильное нагревание для малоактивных металлов:
|
2. Со сложными веществами: вода |
2. вода: активные металлы + вода при комнатной температуре:
Если убрать пленку у металлов (магний , алюминий):
При повышенной температуре → менее активные металлы:
кислоты: металлы, стоящие в ряду
активности до водорода, реагируют с
кислотами:
Малоактивные металлы могут практически не растворяться в кислотах. Это обусловлено образованием на их поверхности пленки нерастворимой соли. В азотной кислоте растворяются все металлы:
Концентрированная серная кислота также может вступать в реакции с металлами, расположенные после водорода в ряду активности (Алюминий, хром, железо при комнатной температуре не вступают в реакцию с концентрированной серной и азотной кислотами из-за образования на поверхности плотной пленки оксида металла ( пассивация поверхности)):
Алюминий, хром, бериллий, цинк растворяются не только в кислотах, но и в водных растворах щелочей с образованием комплексных соединений:
|